Alkil Halida
Diunggah oleh
OktaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Alkil Halida
Diunggah oleh
OktaHak Cipta:
Format Tersedia
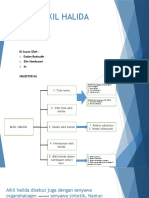
ALKIL HALIDA (REAKSI SN1 DAN SN2)
ALKIL HALIDA Alkil halida adalah molekul organik yang mengandung sebuah atom X
halogen yang diikat ke sebuah hibridisasi atom karbon sp 3 . Alkil halida diklasifikasikan
sebagai primer (1o ), sekunder (2o ), atau tersier (3o ) tergantung pada nomor dari ikatan
karbon yang terikat dengan halogen. Alkil halida mempunyai rumus molekul CnH2+1X, dan
secara resmi diperoleh dari sebuah alkana dengan mengganti atom hidrogen menjadi halogen.
A. Sifat˗sifat haloalkana
1. Sifat kimia
Sifat kimia yang khas bagi senyawa haloalkana dapat dilihat dari reaksi penggantian atom
halogen yang reaktif dengan atom gugus monovalen lain. Iodida lebih reaktif daripada
bromida sedangkan bromida lebih reaktif daripada klorida. Contoh reaksi˗reaksi yang
melibatkan haloalkana, yaitu:
a. Hidrolisis
Dalam senyawa alkil halida dapat terhidrolisis dengan lambat dalam air yang mendidih tetapi
akan terhidrolisis dengan cepat dalam larutan alkalis panas, kemudian akan menghasilkan
alkohol. Reaksinya sebagai berikut.
C2H5Br + NaOH → C2H5OH + NaBr
Etil alkohol
b. Reaksi dengan kalium sianida
Bila alkil halida dididihkan dengan larutan kalium sianida (pelarut alkohol), maka yang
terbentuk adalah alkil sianida. Contoh:
C2H5Br + KCN → C2H5CN + KBr
Etil sianida
c. Reaksi dengan amonia
Amonia dalam larutan berair yang pekat bereaksi dengan alkil halida menghasilkan garam
amin primer. Contoh
C2H5Br + NH3 → C2H5NH3Br
Etilamin hidrobromida
2. Sifat fisik
Untuk menjelaskan sifat fisik dari alkil halida perhatikan tabel dibawah ini:
Tabel 1. Alkil halida sederhana
sifat˗sifat fisik halida sederhana diberikan dalamtabel di atas, pada tabel tersebut jelas bahwa
metil klorida, metil bromida dan etil klorida adalah gas pada suhu kamar sedangkan yang lain
berupa cairan.
Alkil halida terasa manis dan semua tak berwarna bila murni, meskipun alkil halida
cenderung berubah menjadi kuning bila terkena sinar matahari dalam waktu yang lama.
Alkil halida praktis tak dapat bercampur dengan air, membentuk lapisan terpisah bila
dicampur dan emulsi bila dikocok, tetapi larutan dengan cepat daam alkohol dan eter.
Senyawa yang terhalogenasi banyak memiliki titik didih lebih tinggi, seperti terlihat untuk
klorometana dalam tabel di bawah ini.
Tabel 2. Massa molekul dan titik didih klorometana
B. Kegunaan haloalkana
Seperti halnya yang lain, haloalkana juga memiliki banyak kegunaan, berikit ini kita akan
membahas contoh haloalkana dan kegunaannya.
Metil klorida dan metil bromida
Metil klorida dapat digunakan di bidang industri sebagai refrigerant (pendingin) dan agen
metilasi, yaitu dalam industri silikon dan pewarna. Metil bromida digunakan sebagai
pemadam api pesawat terbang dan pengasapan hama buah˗buahan.
Etil klorida
Etil klorida digunakan pada skala besar untuk pembuatan tetraetil timbal (C2H5)4Pb, dari
paduan natrium˗timbal (Na4Pb). Reaksinya:
4C2H3Cl (aq) + Na4Pb (s) → (C2H3)4Pb (s) + 4 NaCl (aq)
Etil klorida juga digunakan sebagai anestesi lokal dalam operasi kecil karena efek dingi bila
menguap pada kulit dan yang paling penting untung untuk pembuatan plastik etil selulosa.
Kloroform (CHCl3) dan iodoform (CHI3)
Kloroform merupakan zat pembius yang kuat, tetapi penggunaannya dapat merusak hati.
Haloalkana yang lebih baik sebagai pembius adalah 2˗ bromo˗2 kloro ˗1,1,1 trifluoroetana
(CF3˗CHClBr). Iodoform digunakan sebagai antiseptik pada pengobatan luka.
Freon
Feon merupakan nama dagang Dupont untuk senyawa terfluoronasi. Zat ini digunaka
sebagai refrigerant (cairan pendingin). Freon 12 (diklorodifluorometana) dan freon 11
(triklorofluorometana) tidak beracun, tidak berbau, dan tidak mudah terbakar. Sebagian
digunakan dalam pemadam kebakaran. Penggunaan freon telah banyak dikurangi dan bahkan
dihentikan karena freon dapat merusak lapisan ozon di stratosfer.
DDT (diklorodifenitrikloroetana)
DDT digunakan secara luas sebagai insektisida mulai tahun 1950 sampai 1970.
Penggunaanya dibatasi karena tak terurai di lingkungan dan dapat masuk ke dalam rantai
makanan.
Tertraklorometana (CCl4)
Zat ini digunakan terutama sebagai pelarut zat organik dan bahan pembuatan senyawa
senyawa yang mengandung flour.
Semoga artikel Kegunaan dan Sifat Haloalkana di atas dapat membantu teman-teman
dalam memahami dan mengetahui senyawa turunan alkana, khususnya haloalkana. Demikian
pembehasan kita kali ini, jika ada yang kurang dimengerti bisa komentar di kolom komentar
yaa, terima kasih.
Penggunaan Alkil Halida
Alkil halida menemukan berbagai kegunaan dan aplikasi dalam kehidupan sehari-hari seperti:
1. Digunakan di laboratorium sebagai senyawa antara sintetis.
2. Digunakan sebagai pembersih untuk membersihkan.
3. Penggunaan komersial dari haloalkana termasuk penggunaannya dalam extin
apiguisher.
4. Etil klorida dapat digunakan sebagai bahan untuk mendinginkan kulit di daerah tropis.
5. Alkil halida tidak larut air yang digunakan sebagai pelarut aqua
6. Karbon tetraklorida digunakan untuk mendeteksi neutrinos serta penggunaan lainnya
Daftar Pustaka:
Soebiyanto Suwardi, Dkk. (2009). Panduan Pembelajaran Kimia kelas 12. Pusat Perbukuan
Departemen Pendidikan Nasional. Jakarta
Anda mungkin juga menyukai
- Alkil HalidaDokumen17 halamanAlkil HalidaIndah Nurariska0% (1)
- SOAL TERMOKIMIA DAN KESETIMBANGANDokumen17 halamanSOAL TERMOKIMIA DAN KESETIMBANGANDela AnggrainiBelum ada peringkat
- Reaksi Senyawa KarbonDokumen46 halamanReaksi Senyawa KarbonMaria Friska Hutabarat0% (1)
- MOLEKUL KIMIADokumen12 halamanMOLEKUL KIMIALiendi Frans AbaruaBelum ada peringkat
- REDOKS DAN ELEKTROKIMIADokumen56 halamanREDOKS DAN ELEKTROKIMIASaputra RaharjaBelum ada peringkat
- Kelompok 4Dokumen34 halamanKelompok 4AryMasDewiWiantiniBelum ada peringkat
- EterDokumen11 halamanEterYenni SaragihBelum ada peringkat
- Tugas Resume Kimia Fisika TermokimiaDokumen10 halamanTugas Resume Kimia Fisika TermokimiaTiara DwiscaBelum ada peringkat
- Sifat Koligatif LarutanDokumen15 halamanSifat Koligatif LarutanIqbal NuradiBelum ada peringkat
- Lap ACC Model MolekulDokumen47 halamanLap ACC Model MolekulDarrusalam UchihaBelum ada peringkat
- Dasar Teori PemisahanDokumen4 halamanDasar Teori PemisahanMarcel LinaBelum ada peringkat
- JENIS LARUTAN DAN WAKTU TERBENTUK GASDokumen2 halamanJENIS LARUTAN DAN WAKTU TERBENTUK GASAdi Syahputra AllfoursBelum ada peringkat
- OSKI 2019Dokumen12 halamanOSKI 2019Rusli AditiyaBelum ada peringkat
- 20 Soal AnorganikDokumen5 halaman20 Soal AnorganikNur Fitri Dewi MBelum ada peringkat
- Matriks 11Dokumen10 halamanMatriks 11Intan TusepBelum ada peringkat
- Diagram Alir ALKOHOLDokumen1 halamanDiagram Alir ALKOHOLInnah MutmainnahBelum ada peringkat
- Perc. I Isolasi Pati Dari Ubi KayuDokumen16 halamanPerc. I Isolasi Pati Dari Ubi KayuMain'k Lee Yun ShoengHamin'kBelum ada peringkat
- HIDROKARBONDokumen31 halamanHIDROKARBONwd_amalia100% (1)
- Asam DikarboksilatDokumen15 halamanAsam DikarboksilatGhalintia Vanesa RekasariBelum ada peringkat
- KELARUTAN GARAM ALKALI TANAHDokumen7 halamanKELARUTAN GARAM ALKALI TANAHauliaBelum ada peringkat
- Pembuatan Mayonaise Dengan Metode KoloidDokumen11 halamanPembuatan Mayonaise Dengan Metode KoloidEko Pramudya PutraBelum ada peringkat
- Bab 01 Kimia Dasar - Matter and MeasurementDokumen41 halamanBab 01 Kimia Dasar - Matter and MeasurementSalma NurlailyBelum ada peringkat
- Pertemuan 5-6: Reaksi Substitusi Asil NukleofilikDokumen30 halamanPertemuan 5-6: Reaksi Substitusi Asil NukleofilikAkhmad FauzanBelum ada peringkat
- LaporanDokumen6 halamanLaporanRaniah SausanBelum ada peringkat
- OPTIMALKAN_LIMITDokumen9 halamanOPTIMALKAN_LIMITSylvie SilaenBelum ada peringkat
- LKS PraktikumDokumen8 halamanLKS PraktikumKostantina AninamBelum ada peringkat
- Lipid 1Dokumen15 halamanLipid 1putri azzahraBelum ada peringkat
- Alkohol Dan FenolDokumen54 halamanAlkohol Dan FenolekaBelum ada peringkat
- BAB I KoloidDokumen10 halamanBAB I Koloidsiti nur khabibahBelum ada peringkat
- Laporan Lengkap Raktikum Titrasi Asam Basa Kimia Dasar IiDokumen16 halamanLaporan Lengkap Raktikum Titrasi Asam Basa Kimia Dasar IiZaqi AdityaBelum ada peringkat
- Jurnal Praktikum Kimia OrganikDokumen6 halamanJurnal Praktikum Kimia Organiklandep ayuBelum ada peringkat
- BISMUTDokumen8 halamanBISMUTWa MeilaniBelum ada peringkat
- Sifat Koligatif LarutanDokumen13 halamanSifat Koligatif LarutanImania BidariBelum ada peringkat
- ALKANA & SIKLOALKANADokumen50 halamanALKANA & SIKLOALKANAAhmad AziizanBelum ada peringkat
- Alkohol FenolDokumen4 halamanAlkohol FenolBunga KartikaBelum ada peringkat
- Alkohol dan EterDokumen24 halamanAlkohol dan EterCindy MaidestaBelum ada peringkat
- Alkohol Dan EterDokumen19 halamanAlkohol Dan EterputriBelum ada peringkat
- Kegunaan Larutan Penyangga Dalam Kehidupan Sehari-HariDokumen21 halamanKegunaan Larutan Penyangga Dalam Kehidupan Sehari-HariFarid FauziBelum ada peringkat
- Laporan Praktikum BiokimiaDokumen28 halamanLaporan Praktikum BiokimiaNovika PurwatiBelum ada peringkat
- Laporan Praktikum Kimia Dasar IDokumen10 halamanLaporan Praktikum Kimia Dasar IEtika RosianiBelum ada peringkat
- Edi Siswanto - Alkana, Alkena Dan AlkunaDokumen8 halamanEdi Siswanto - Alkana, Alkena Dan AlkunaEdy_Siswanto_MahapBelum ada peringkat
- OPTIMASI DE DAN TEMPERATURDokumen3 halamanOPTIMASI DE DAN TEMPERATURSalsabila Salwa YBelum ada peringkat
- AnilinDokumen16 halamanAnilinErsa Nurul YarizsaBelum ada peringkat
- POLAR DAN NON POLARDokumen13 halamanPOLAR DAN NON POLARNadia Iska MaritoBelum ada peringkat
- Golongan III - Kelompok 1 - Jurnal Awal Sifat-Sifat Kimia HidrokarbonDokumen13 halamanGolongan III - Kelompok 1 - Jurnal Awal Sifat-Sifat Kimia Hidrokarbon20053 Putri Ayu Puspita SariBelum ada peringkat
- Laporan Mingguan StoikiometriDokumen10 halamanLaporan Mingguan StoikiometriKhairunnisa Rehmuli GurkyBelum ada peringkat
- Badan GolgiDokumen8 halamanBadan GolgiMuhammadFahrulBelum ada peringkat
- Anfistum Resin Gun LateksDokumen2 halamanAnfistum Resin Gun LateksTiara Putri Meinicha 019Belum ada peringkat
- Awal StoikiometriDokumen10 halamanAwal StoikiometriEndah mustika100% (1)
- Senyawa AromatisDokumen6 halamanSenyawa AromatisArssy DyonBelum ada peringkat
- Laporan PRAKTIKUM KIMIA ORGANIK 3Dokumen16 halamanLaporan PRAKTIKUM KIMIA ORGANIK 3aritamaBelum ada peringkat
- Soal Kimia Alkena AlkunaDokumen3 halamanSoal Kimia Alkena AlkunaAmal BudimanBelum ada peringkat
- MAKALAH KIMIA ORGANIK AlkoholDokumen25 halamanMAKALAH KIMIA ORGANIK AlkoholMukhamad Nurul HudaBelum ada peringkat
- ESTERIFIKASI MAKALAHDokumen15 halamanESTERIFIKASI MAKALAHJaffarudin Janu WahyudiBelum ada peringkat
- Dasar Teori SabunDokumen14 halamanDasar Teori SabunERISA ALIFIABelum ada peringkat
- Hidrolisis Tepung MaizenaDokumen17 halamanHidrolisis Tepung MaizenaARIF SAFI'IBelum ada peringkat
- ALKOHOLDokumen86 halamanALKOHOLwidy astutiBelum ada peringkat
- FenolDokumen1 halamanFenolRidho HabibieBelum ada peringkat
- Materi Reaksi Reduksi-Oksidasi (Redoks)Dokumen16 halamanMateri Reaksi Reduksi-Oksidasi (Redoks)IntanBelum ada peringkat
- ALKILHALDADokumen8 halamanALKILHALDAIndra Saputra100% (1)