1H X - Bab 2 STRUKTUR ATOM
Diunggah oleh
Moreno LorenzoJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
1H X - Bab 2 STRUKTUR ATOM
Diunggah oleh
Moreno LorenzoHak Cipta:
Format Tersedia
STRUKTUR ATOM & TABEL PERIODIK
I. TUJUAN PEMBELAJARAN
1. Memahami struktur atom, sifat-sifat periodik unsur.
2. Dapat membedakan massa atom relative, nomor atom dan menyadari keteraturan melalui konsep konfigurasi elektron.
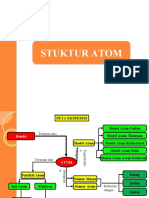
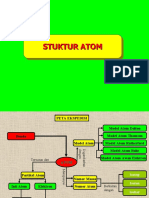
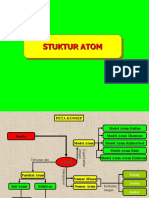
II. PETA KONSEP
STRUKTUR ATOM &
TABEL PERIODIK
PERKEMBANGAN
ATOM
MODEL ATOM
PARTIKEL
PENYUSUN DALTON
ATOM
J.J THOMSON
INTI ATOM ELEKTRON
RUTHERFORD
PROTON NEUTRON KONFIGURASI
NIELS BOHR
NOMOR ATOM
MODERN
NOMOR MASSA
KIMIA | STRUKTUR ATOM | 19
III. MATERI PEMBELAJARAN
A. Partikel Penyusun Atom
Partikel Elektron Proton Neutron
Sifat muatan Negatif Positif Tidak bermuatan
0 1 1
Lambang −1𝑒 +1𝑝 0𝑛
Penemu J.J Thomson (1897) Eugene Goldstein (1886) J. Chadwick (1932)
Massa 9,11x10-28 gram 1,67x10-24 gram 1,67x10-24 gram
(1 /1,8 sma) (1 sma) (1 sma)
B. Nomor Atom dan Nomor Massa
𝐴 Keterangan :
𝑍𝑋
X = lambang unsur
Z = nomor atom = proton (p)
n=A-Z
A = nomor massa
n = neutron
C. Nuklida/Isotop
23 23
Isotop : atom-atom memiliki jumlah proton sama. Contoh : 11𝐴 11𝐵
Isoton : atom-atom memiliki jumlah neutron sama. Contoh : 40 45
20𝐴 25𝐵
40 40
Isobar : atom-atom memiliki jumlah nomor massa sama. Contoh : 21𝐴 22𝐵
+
Isoelektron : atom-atom memiliki jumlah elektron sama. Contoh : 11 𝑁𝑎 10
Isodiasphere 𝑁𝑒Type
: atom-atom memiliki neutron dikurangi proton atau proton equation
dikurangi neutronhere.
sama.
40 40
Contoh : 𝐴
21 22 𝐵
D. Perkembangan Teori Atom
Model Teori Uraian Teori Kekurangan Gambar
John Dalton a. Atom adalah partikel terkecil a. Tidak menjelaskan sifat
yang tidak dapat dibagi lagi listrik materi.
(1803)
dan digambarkan sebagai b. Tidak menjelaskan cara
bola pejal. atom-atom berikatan
b. Atom satu unsur sama dalam c. Tidak menjelaskan
segala hal, tetapi berbeda dari perbedaan antara atom
unsur lain. satu dengan lainnya.
Gambar : Model atom Dalton
c. Atom dapat bergabung satu
sama lain secara kimia Sumber:http://bit.ly/2qUEEZX
dengan perbandingan
sederhana.
d. Atom tidak dapat diuraikan,
diciptakan atau dimusnahkan.
J.J Thomson a. Elektron-elektron tersebar a. Tidak menjelaskan
merata dalam bola bermuatan adanya inti atom
(1903)
positif (Model atom roti
kismis).
KIMIA | STRUKTUR ATOM | 18
Gambar : Model atom Thomson
Sumber : http://bit.ly/2qUqOH9
Rutherford a. Atom terdiri dari inti yang a. Tidak dapat menerangkan
bermuatan positif dan berada alasan elektron tidak jatuh
(1911)
di pusat atom. ke inti.
b. Elektron bergerak mengitari b. Belum menjelaskan letak
inti seperti planet mengitari elektron dan rotasinya
matahari. terhadap atom.
c. Tidak menjelaskan
spectrum garis pada atom
hidrogen. Gambar : Model atom Rutherford
Sumber : http://bit.ly/2rfKBSb
Niels Bohr a. Mengelilingi inti atom pada a. Kedudukan dalam
lintasan tertentu disebut orbit mengelilingi atom
(1915)
atau kulit. dinyatakan dengan pasti.
b. Elektron dapat berpindanh b. Gerakan elektron
dari orbit satu ke orbit lain. digambarkan sebagai
c. Ketika tidak berpindah dari lingkaran/elip.
orbit, elektron tidak c. Tidak dapat menerangkan
memancarkan radiasi. intensitas spektrum lebih
lanjut. Gambar : Model atom Bohr
Sumber :http://bit.ly/2s1cPMW
Model Atom a. Louis de Broglie
Modern (1923),elektron dalam atom
dapat dipandang sebagai
partikel dan gelombang.
b. Erwin Schrodinger (1926),
persamaan gelombang dalam
atom.
c. Werner Hesenberg (1927),
asas ketidakpastian posisi Gambar : Model atom Mekanika Kuantum
elektron. Sumber :http://bit.ly/2s0WFDd
KIMIA | STRUKTUR ATOM | 19
E. Konfigurasi Elektron dan Diagram Orbital
Konfigurasi adalah pengaturan posisi elektron berdasarkan tingkat energi.
1. Aturan konfigurasi
a. Aturan Aufbau
Elektron akan mengisi subkulit dengan energi terendah terlebih dahulu.
Gambar :Konfigurasi berdasarkan Aufbau
Sumber :http://bit.ly/2suJz19
b. Larangan Pauli
Tidak ada dua elektron dalam satu atom yang memiliki empat bilangan kuantum yang sama. Sehingga jika ada dua
elektron yang menempati satu orbital, maka minimal harus memiliki spin yang berlainan.
c. Kaidah Hund
Pengisian elektron ke dalam orbital-orbital suatu subkulit dilakukan dengan mengisi orbital satu per satu sampai
setengan penuh kemudian berpasangan.
2. Diagram Orbital
Dua elektron dalam satu orbital memiliki muatan negatif, sehingga terjadi tolak-menolak. Gaya tolak-menolak diimbangi
dengan rotasi yang arahnya berlawanan. Oleh karena itu, kedua elektron dalam orbital digambarkan:
↑↓
F. Bilangan Kuantum dan Bentuk Orbital
1. Bilangan Kuantum
Kuantum Utama (n) : n menyatakan nomor kulit atau tingkat energi suatu elektron.
Kulit ke-1 Kulit ke-2 Kulit ke-3 Kulit ke-4
1s 2s, 2p 3s, 3p, 3d 4s, 4p, 4d, 4f
Kuantum Azimuth (l) : menyatakan subkulit tempat terdapat elektron, bentuk orbital, dan
sub tingkatan energi.
s (Sharp) p (Participal) d (Diffuse) f (Fundamental)
0 1 2 3
Kuantum Magnetik (m) : menyatakan orientasi orbital dalam ruangan tempat terdapat
elektron dan jumlah orbital dalam subkulit.
s (Sharp) p (Participal) d (Diffuse) f (Fundamental)
0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3
Kuantum Spin (s) : menggambarkan arah putaran elektron.
Searah jarum jam : + ½ (↿) Berlawanan arah jarum jam: - ½ (⇂)
KIMIA | STRUKTUR ATOM | 20
Contoh Soal :
1. Koordinat bilangan kuantum elektron terluar atom 19K yang benar adalah…
A. (4, 0, 0, +½) atau (4, 0, 1, +½)
B. (4, 0, 1, -½) atau (4, 0, 0, -½)
C. (4, 0, 0, +½) atau (4, 0, 0, -½)
D. (4, 1, 1, +½) atau (4, 1, 1, -½)
E. (4, 0, 1, +½) atau (4, 1, 1, -½)
(SBMPTN 2014)
Kunci Jawaban : C
Pembahasan :
Konfigurasi atom 19K : 1s2 2s2 2p6 3s2 3p6 4s1 n = 4, l = 0, m = 0, s = +½
Karena dalam orbital subkulit s masih terdapat 1 elektron, sehingga bisa menangkap 1 elektron lain dan mengubah spin menjadi -
½.
2. Bentuk Orbital
Gambar : Bentuk orbital s Gambar : Bentuk orbital p
Sumber :http://bit.ly/2svc4fs Sumber : http://bit.ly/2rxdqc4
Gambar : Bentuk orbital d
Sumber : http://bit.ly/2rhX3ji
KIMIA | STRUKTUR ATOM | 21
G. Hubungan Konfigurasi Elektron dengan Letak Unsur dalam Tabel Periodik
Golongan
- Ditentukan dari elektron valensi.Elektron valensi merupakan jumlah elektron pada kulit terluar. Jumlah
maksimum elektron valensi adalah 8.
- Jika jumlah elektron valensi dalam subkulit sama dengan bilangan kuantum utama (n), maka atom unsur tersebut
terletak di golongan yang sama (selain ion).
Periode
- Ditentukan dari nomor kulit atom.
- Nilai n (bilangan kuantum utama) yang terbesar menunjukkan letak periode unsur tersebut dalam tabel periodik.
Golongan A Golongan B
Elektron valensi Elektron Valensi
IA (Alkali) ns1 1 III B ns2 (n-1)d1 3
IIA (Alkali tanah) ns2 2 IV B ns2 (n-1)d2 4
IIIA (Boron) ns2 np1 3 VB ns2 (n-1)d3 5
IVA (Karbon) ns2np2 4 VI B ns1 (n-1)d5 6
VA (Nitrogen) ns2np3 5 VII B ns2 (n-1)d5 7
VIA (Oksigen) ns2np4 6 VIII B ns2 (n-1)d6, 7, 8 8, 9, 10
VIIA (Halogen) ns2np5 7 IB ns1 (n-1)d10 11
VIIIA (Gas mulia) ns2 np6 8 II B ns2 (n-1)d10 12
Contoh Soal :
2. Unsur L dinotasikan sebagai berikut :
𝟓𝟗
𝟐𝟖𝑳
Konfigurasi elektron dan letak unsur L pada tabel periodik, sesuai golongan dan periodenya, secara berturut-turut adalah…
Konfigurasi elektron Golongan Periode
2 8
A [Ar] 4s 3d VIII B 4
B [Ar] 4s2 4p6 3d2 VIII B 3
C [Ar] 4s2 3s5 4p3 VB 4
2 3
D [Ar] 6s 3f Lantanida 6
E [Ar] 6s2 4f3 Lantanida 6
(UN 2014)
Kunci Jawaban : A
Pembahasan :
Konfigurasi 28L : [Ar] 4s2 3d8 subkulit terakhir adalah s dan d, maka termasuk ke dalam blok B
Jumlah elektron di subkulit s dan d adalah 10, sehingga termasuk ke dalam golongan VIII B.
Nomor kulit terbesar adalah 4, maka berada pada periode 4.
KIMIA | STRUKTUR ATOM | 22
H. Tabel Periodik dan Sifat Keperiodikan Unsur
1. Sejarah Tabel Periodik Unsur
a. Lavoisier (1789) : Pengelompokan unsur menjadi kelompok gas, tanah, logan, dan non logam.
b.Triade Dobereiner : Pengelompokan unsur berdasarkan kemiripan sifat dan kenaikan nomor
(1829) massa.
c. Oktaf Newlands : Penggolongan unsur berdasarkan kenaikan massa atom relatif.
(1780-1849)
d. Mendeleev (1869) : Penggolongan berdasarkan kenaikan massa atom (periode) dan persamaan
sifat (golongan).
e. Moseley (1913) : Penggolongan berdasarkan kenaikan nomor atomnya dan persamaan sifat.
2. Sifat-sifat Tabel Periode Unsur
a. Jari-jari atom : Jarak antara elektron terluar dengan inti atom
b. Logam/kebasaan : Kecenderungan unsur melepas elektron pada kulit terluar (elektropositif)
sehingga membentuk kation, dan berhubungan dengan sifar kebasaannya.
c. Potensial reduksi : Sifat unsur untuk mengalami penurunan bilangan oksidasi (reduksi).
d. Elektronegatifitas : Kemampuan atom untuk menarik elektron dari unsur lain.
e. Energi ionisasi : Energi yang dibutuhkan untuk melepaskan satu elektron.
f. Afinitas elektron : Energi yang menyertai atom ketika akan menangkap satu elektron.
d. Oksidator : Kemampuan suatu atom untuk tereduksi/mengoksidasi unsur lain.
- +
LOJA PIANO
Logam/Kebasaan Potensial reduksi
+ Jari-jari atom - Energi ionisasi (maksimal VII A)
Afinitas elektron (makimal VII A)
Elektronegativitas (maksimal VII A)
Oksidator (maksimal VII A)
KIMIA | STRUKTUR ATOM | 23
IV. UJI KOMPETENSI
SOAL JAWABAN
1. Dua buah unsur mempunyai diagram orbital sebagai berikut:
X : [Ar] ↑↓ ↑
Y : [Ne] ↑↓ ↑↓ ↑↓ ↑
Nomor atom unsur X adalah …….
A. 17
B. 18
C. 21
D. 26
E. 15
(UN 2015)
2. Dalam sistem berkala unsur, unsur X terletak pada periode
ketiga dan golngan 15 atau V A. Dalam keadaan ion, unsur ini
isoelektrik dengan unsur gas mulia periode ketiga. Muatan
unsur X adalah…
A. -1
B. -2
C. -3
D. 2
E. 3
(SBMPTN 2010)
3. Ion Co2+ mempunyai konfigurasi elektron [Ar] 3d7, jumlah
elektron yang tidak berpasangan dalam Co2+ adalah…
A. 1
B. 2
C. 3
D. 5
E. 7
(UMPTN 2000)
4. Atom dengan konfigurasi elektron [Ar] 4s2 3d10 4p2 bersifat…
A. Inert
B. Diamagnetik
C. Konduktor
D. Non logam
E. Semi logam
(SNMPTN 2012)
5. Konfigurasi elektron ion X2+ yang memiliki bilangan massa 45
dan 24 neutron adalah…
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d1
B. 1s2 2s2 2p6 3s2 3p6 4s1
C. 1s2 2s2 2p6 3s2 3p6 4d1
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d2
E. 1s2 2s2 2p6 3s2 3p6 4s2
(SNMPTN 2011)
6. Nilai yang mungkin untuk bilangan kuantum dalam satu
KIMIA | STRUKTUR ATOM | 24
orbital adalah…
A. n = 2, l = 1, m = -1
B. n = 2, l = 2, m =2
C. n = 3, l = 3, m = 1
D. n = 1, l = 1, m = -0
E. n = 3, l = 2, m =3
(SNMPTN 2008)
7. Unsur yang mempunyai diagram elektron valensi pada keadaan
dasar seperti berikut adalah…
↑↓ ↑ ↑ ↑
A. 6C
B. 8O
C. 15P
D. 13Al
E. 16S
(SNMPTN 2009)
8. Atom atau ion yang kulit terluarnya bukan ns2 np3dari atom
dibawah ini adalah…
A. N
B. Br2+
C. C-
D. Pb+
E. Cl
(SIMAK UI 2015)
27
9. Notasi suatu unsur 13𝑋 , konfigurasi elektron dari ion X3+
adalah…
A. 1s2 2s2 2p6
B. 1s2 2s2 2p6 3s2 4p1
C. 1s2 2s2 2p6 3s2 4p2
D. 1s2 2s2 2p6 3s2 4p6
E. 3s2 4p6 3d9
(UN 2011)
10. Harga kempat bilangan kuantum atom 17Cl adalah…
A. n = 3, l = 1, m = +1, s = -½
B. n = 3, l = 1, m = 0, s = +½
C. n = 3, l = 1, m = 0, s = -½
D. n = 3, l = 2, m = 0, s = +½
E. n = 2, l = 1, m = 0, s = -½
(UN 2013)
11. Diketahui nomor atom Fe = 26, konfigurasi elektron ion Fe 3+
adalah…
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d6
B. 1s2 2s2 2p6 3s2 3p6 3d5
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d3
D. 1s2 2s2 2p6 3s2 3p6 4s1 3d4
E. 1s2 2s2 2p6 3s2 3p6 3d6
(SPMB 2005)
KIMIA | STRUKTUR ATOM | 25
12. Berikut tabel data beberapa unsur.
Unsur Nomor atom
P 11
Q 12
R 13
S 14
Grafik yang menunjukkan kecenderungan energi ionisasi dari
unsur-unsur tersebut adalah…
A. D.
B. E.
C.
(UN 2015)
13. Diantara unsur-unsur berikut yang memenuhi sifat isotop
adalah…
A. 23 23
11𝐴 11𝐵
40 45
B. 20𝐴 25𝐵
C. 40 40
21𝐴 22𝐵
+
D. 10𝐴 9𝐵
E. 40 40
21𝐴 22𝐵
(UKK)
14. Kelemahan teori atom Rutherford adalah…
A. Tidak dapat menerangkan alasan elektron tidak jatuh ke
inti
B. Tidak menjelaskan adanya inti atom
C. Tidak menjelaskan perbedaan antara atom satu dengan
lainnya
D. Kedudukan dalam mengelilingi atom dinyatakan dengan
pasti
E. Tidak menjelaskan sifat listrik materi
(UKK)
KIMIA | STRUKTUR ATOM | 26
15. Perhatikan gambar berikut!
Sumber : http://bit.ly/2qMQou3
Ilustrasi diatas menggambarkan teori atom menurut…
A. Thomson
B. Rutherford
C. Bohr
D. Erwin Schrodinger
E. Dalton
(UKK)
KIMIA | STRUKTUR ATOM | 27
V. SOAL LATIHAN RUMAH
SOAL JAWABAN
1. Perhatikan notasi unsur berikut!
3X, 11Z, 19W
Gambar yang menunjukkan jari-jari atom ketiga unsur
adalah…
A. D.
B. E.
C.
(UN 2016)
2. Nomor atom Z adalah 28. Konfigurasi ion Z2+ adalah…
A. 1s2 2s2 2p6 3s2 3p6 4s2 4p6
B. 1s2 2s2 2p6 3s2 3p6 4s2 3d6
C. 1s2 2s2 2p6 3s2 3p6 3d8
D. 1s2 2s2 2p6 3s2 3p6 4s1 3d7
E. 1s2 2s2 2p6 3s2 3p6 4s2 4d8
(SBMTPN 2017)
3. Unsur X memiliki nomor atom 8, maka unsur tersebut dalam
tabel periodik unsur terletak pada…
A. Golongan 4A/Periode 3
B. Golongan 4A/Periode 2
C. Golongan 2A/Periode 3
D. Golongan 4B/Periode 2
E. Golongan 2A/Periode 2
(UKK)
4. Diantara unsur 4P, 19Q, 13R, 31S, 15T, 34U dan 53V yang
terletakdalam golongan yang sama pada sistem periodik
adalah…
A. P dan R
B. Q dan S
C. Q dan V
D. R dan S
E. T dan U
(SIMAK UI 2013)
KIMIA | STRUKTUR ATOM | 28
5. Ion M2+ memiliki konfigurasi elektron 1s2 2s2 2p6 3s2 3p6
3d9, pernyataan yang benar mengenai M adalah…
1) Pada keadaan dasar, M memiliki konfigurasi elektron1s2
2s2 2p6 3s2 3p6 4s2 3d9
2) M memiliki bilangan oksidasi umum +1 dan +2
3) Atom M berada pada golongan I B
4) M dapat bertindak sebagai konduktor listrik yang baik
(SIMAK UI 2014)
6. Perhatikan tabel periodik berikut!
Konfigurasi elektron dan nomor atom dari unsur-unsur
dalam tabel periodik tersebut yang benar adalah…
Unsur Konfigurasi Nomor Atom
A. P [He] 2s2 5
B. Q [He] 2s2 2p5 9
C. R [Ne] 4s1 13
D. Y [Ar] 4s1 18
E. T [Ar] 4s1 40
(UN 2016)
7. Dari konfigurasi elektron dari atom unsur berikut ini,
manakah konfigurasi elektron yang mengalami eksitasi?
1) [Ne]3s2 3p5
2) [Ne]3s2 3p2 4s1
3) [Ne]3s2 3p6 4s1
4) [Ne]4s2 3d10 4p5 5s1
(SIMAK UI 2013)
8. Ion bermuatan 2+ memiliki konfigurasi elektron 1s2 2s2 2p6
3s2 3p6 3d4. Unsur tersebut dalam tabel periodic unsur
terdapat pada…
A. Golongan III B, periode 4
B. Golongan VI A, periode 3
C. Golongan VI B, periode 4
D. Golongan IV A, periode 3
E. Golongan IV B, periode 3
(UM UNDIP 2012)
9. Unsur X dengan konfigurasi [Xe] 4f14 5d10 6s2 6p5
pernyataan yang benar untuk unsur X adalah…
1) Terletak pada periode 6 dalam tabel periodik
2) Termasuk golongan 17
3) Sifat kimianya sama dengan fluor
4) Bernomor atom 87
(SPMB 2007)
KIMIA | STRUKTUR ATOM | 29
10. Ion M2+ memiliki konfigurasi elektron 1s2 2s2 2p6 3s2 3p6
3d9, pernyataan yang benar mengenai M adalah…
1) Pada keadaan dasar, M memiliki konfigurasi elektron1s2
2s2 2p6 3s2 3p6 4s2 3d9
2) M memiliki bilangan oksidasi umum +1 dan +2
3) Atom M berada pada golongan I B
4) M dapat bertindak sebagai konduktor listrik yang baik
(SIMAK UI 2014)
11. Koordinat bilangan kuantum elektron terakhir 19K yang
benar adalah
A. 4,0,0, ½ atau 4,0,1, ½
B. 4,0,1 - ½ atau 4,0,0, - ½
C. 4,0,0, ½ atau 4,0,0,- ½
D. 4,1,1, ½ atau 4,1,1, - ½
E. 4,1,0, ½ atau 4, 1, 0, - ½
(SBMPTN 2014)
12. Dari konfigurasi elektron dari atom unsur berikut ini,
manakah konfigurasi elektron yang mengalami eksitasi?
1) [Ne]3s2 3p5
2) [Ne]3s2 3p2 4s1
3) [Ne]3s2 3p6 4s1
4) [Ne]4s2 3d10 4p5 5s1
(SIMAK UI 2013)
13. Ion bermuatan 2+ memiliki konfigurasi elektron 1s2 2s2 2p6
3s2 3p6 3d4. Unsur tersebut dalam tabel periodic unsur
terdapat pada…
A. Golongan III B, periode 4
B. Golongan VI A, periode 3
C. Golongan VI B, periode 4
D. Golongan IV A, periode 3
E. Golongan IV B, periode 3
(UM UNDIP 2012)
14. Unsur X dengan konfigurasi [Xe] 4f14 5d10 6s2 6p5
pernyataan yang benar untuk unsur X adalah…
5) Terletak pada periode 6 dalam tabel periodik
6) Termasuk golongan 17
7) Sifat kimianya sama dengan fluor
8) Bernomor atom 87
(SPMB 2007)
15. Nilai energi pengionan pertama sampai dengan ke enam
untuk suatu unsur pada golongan utama berturut-turut adalah
1087, 2353, 4620, 6223, 37831, dan 47277 kJ/mol.
Berdasarkan data tersebut, dapat disimpulkan bahwa unsur
tersebut berada pada golongan…
A. III A
B. IV A
C. V A
D. VI A
E. VII A
(SBMPTN 2016)
KIMIA | STRUKTUR ATOM | 30
Anda mungkin juga menyukai
- Struktur AtomDokumen69 halamanStruktur AtomPutraBelum ada peringkat
- Struktur AtomDokumen42 halamanStruktur Atomkiki edryaniBelum ada peringkat
- Struktur Atom Dan Sistem PeriodikDokumen65 halamanStruktur Atom Dan Sistem PeriodikAhmad FaizilBelum ada peringkat
- Struktur AtomDokumen69 halamanStruktur Atomcahyo arionoBelum ada peringkat
- Ufi 2Dokumen68 halamanUfi 2Ufi DamayantiBelum ada peringkat
- Teori Atom Dan Sistem Periodic Unsur - Regsus 2020 KimdasDokumen59 halamanTeori Atom Dan Sistem Periodic Unsur - Regsus 2020 KimdasAlma NurulBelum ada peringkat
- Kimia Dasar Pertemuan 2 (Struktur Atom)Dokumen20 halamanKimia Dasar Pertemuan 2 (Struktur Atom)Muh PriawibawaBelum ada peringkat
- Struktur AtomDokumen54 halamanStruktur AtomFadillah NurulBelum ada peringkat
- Struktur Atom OKDokumen57 halamanStruktur Atom OKNauratul IslamiyahBelum ada peringkat
- 3-4 Tabel Berkala Dan Konfigurasi UnsurDokumen78 halaman3-4 Tabel Berkala Dan Konfigurasi UnsurAnadia PutriBelum ada peringkat
- Struktur AtomDokumen37 halamanStruktur AtomNina100% (3)
- 2) Struktur AtomDokumen38 halaman2) Struktur AtomviviBelum ada peringkat
- Ufi 21Dokumen69 halamanUfi 21Ufi DamayantiBelum ada peringkat
- Bab 2 Struktur Atom Dan SpuDokumen15 halamanBab 2 Struktur Atom Dan SpuHesekiel Paradongan NadeakBelum ada peringkat
- 2a. Struktur AtomDokumen37 halaman2a. Struktur AtomStillyn NdasoBelum ada peringkat
- Struktur Atom Dan RadioaktivitasDokumen49 halamanStruktur Atom Dan RadioaktivitasdQw4w9WgXcQBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen58 halamanStruktur Atom Dan Sistem Periodik UnsurCindy RicisBelum ada peringkat
- PPT Kimia XDokumen57 halamanPPT Kimia XErlita RatnasariBelum ada peringkat
- Kimia Struktur AtomDokumen26 halamanKimia Struktur AtomAlifia ElvarettaBelum ada peringkat
- Bab 2 - Struktur Atom Dan Sistem Periodik EditDokumen58 halamanBab 2 - Struktur Atom Dan Sistem Periodik EditPutri LangitanBelum ada peringkat
- Struktur AtomDokumen10 halamanStruktur AtomHizkia HolongBelum ada peringkat
- Struktur AtomDokumen26 halamanStruktur AtomSyahla Az-ZahraBelum ada peringkat
- Materi Dan Struktur AtomDokumen31 halamanMateri Dan Struktur AtomWindu Jalu PutraBelum ada peringkat
- Partikel Dan Teori AtomDokumen21 halamanPartikel Dan Teori AtomHaechiBelum ada peringkat
- PERTEMUAN KE 1-Struktur AtomDokumen6 halamanPERTEMUAN KE 1-Struktur AtomSaepulloh 79Belum ada peringkat
- Bab 2 Struktur Atom Dan Spu (Ipa Kimia X Kurmer)Dokumen14 halamanBab 2 Struktur Atom Dan Spu (Ipa Kimia X Kurmer)Atariq WalidBelum ada peringkat
- Kimia BAB 2Dokumen33 halamanKimia BAB 2ausatdillaBelum ada peringkat
- 10 Struktur Atom Bagian 1Dokumen30 halaman10 Struktur Atom Bagian 1norma windaBelum ada peringkat
- Struktur AtomDokumen32 halamanStruktur AtomRisyda Qudsia 32Belum ada peringkat
- Bab 2 - Struktur Atom Dan Sistem Periodik 57 - STD yDokumen59 halamanBab 2 - Struktur Atom Dan Sistem Periodik 57 - STD yNicholas SMBelum ada peringkat
- Bab 2 - Struktur Atom Dan Sistem PeriodikDokumen58 halamanBab 2 - Struktur Atom Dan Sistem PeriodikFicky Fajar100% (1)
- Bab 2 - Struktur Atom Dan Sistem PeriodikDokumen61 halamanBab 2 - Struktur Atom Dan Sistem PeriodikDexell Layrence100% (1)
- Kimia AtomDokumen28 halamanKimia AtomNorma SyahidahBelum ada peringkat
- Diskusi 1 Kimia DasarDokumen5 halamanDiskusi 1 Kimia Dasardymas pratama putraBelum ada peringkat
- Bab 2 Struktur Atom Dan Sistem Periodik BohrDokumen31 halamanBab 2 Struktur Atom Dan Sistem Periodik BohrAcha SilmyBelum ada peringkat
- P2-ATOM - Upload BroneDokumen37 halamanP2-ATOM - Upload BroneNabila MaulidyaBelum ada peringkat
- Struktur Dan Perkembangan Model AtomDokumen5 halamanStruktur Dan Perkembangan Model AtomXiaomi CenterBelum ada peringkat
- Kimia - 10SMA - Struktur Atom Dan Tabel Periodik 1Dokumen35 halamanKimia - 10SMA - Struktur Atom Dan Tabel Periodik 1Ken Rossi Andinireswari WahyudiBelum ada peringkat
- Materi - 6 - STRUKTUR ATOM - TKR - TPMDokumen3 halamanMateri - 6 - STRUKTUR ATOM - TKR - TPMPuputh Teea'Belum ada peringkat
- BAB 2-Kimia MADokumen16 halamanBAB 2-Kimia MAnatasyadian300Belum ada peringkat
- Struktur Atom, Sistem Periodik, Ikatan KimiaDokumen67 halamanStruktur Atom, Sistem Periodik, Ikatan Kimiasumpek dikarantinaBelum ada peringkat
- Struktur AtomDokumen13 halamanStruktur AtomWiwikKartikaSariBelum ada peringkat
- STRUKTUR ATOM - Renata Sheehan (Xii Mipa 1)Dokumen28 halamanSTRUKTUR ATOM - Renata Sheehan (Xii Mipa 1)renaBelum ada peringkat
- BAB 2. Struktur Atom Dan SPU (Materi Struktur Atom)Dokumen8 halamanBAB 2. Struktur Atom Dan SPU (Materi Struktur Atom)Evlin Suzanna PakpahanBelum ada peringkat
- LK-01-modul KimiaDokumen10 halamanLK-01-modul KimiaNopita RinggoBelum ada peringkat
- Struktur Atom Karangturi SMA KarangturiDokumen41 halamanStruktur Atom Karangturi SMA KarangturiFIENGKY PRIYO SETIYONO,S.TBelum ada peringkat
- BAB 3 Struktur AtomDokumen15 halamanBAB 3 Struktur Atombensuitella666Belum ada peringkat
- BAHAN AJAR ATOM Dan SPUDokumen13 halamanBAHAN AJAR ATOM Dan SPUanggelBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen18 halamanStruktur Atom Dan Sistem Periodik UnsurRina AgustiniBelum ada peringkat
- Struktur Atom Pertemua IIDokumen57 halamanStruktur Atom Pertemua IIMiranda WaodeBelum ada peringkat
- Materi Dan Dampaknya Bagi Kesehatan Manusia - Riri.IPA.9Dokumen37 halamanMateri Dan Dampaknya Bagi Kesehatan Manusia - Riri.IPA.9Permata SGJHSBelum ada peringkat
- BAB 2 Struktur AtomDokumen11 halamanBAB 2 Struktur AtomAfifah S NBelum ada peringkat
- Struktur AtomDokumen32 halamanStruktur AtomsyarahagisnaBelum ada peringkat
- STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR (Autosaved)Dokumen43 halamanSTRUKTUR ATOM DAN SISTEM PERIODIK UNSUR (Autosaved)Salistia Miladi L.Belum ada peringkat
- LK1 ProfesionalDokumen10 halamanLK1 ProfesionalNopita RinggoBelum ada peringkat
- LK1 - Modul 1 ProfesionalDokumen10 halamanLK1 - Modul 1 ProfesionalNopita RinggoBelum ada peringkat
- Tugas Fisika IntiDokumen16 halamanTugas Fisika IntiEkha Latief PatehaBelum ada peringkat
- Materi AtomDokumen39 halamanMateri Atomfakhrun nisa'Belum ada peringkat
- 4 Struktur Atomic 1Dokumen44 halaman4 Struktur Atomic 1Ariani AdeBelum ada peringkat
- 1H X - Bab 7 Stokiometri IiDokumen12 halaman1H X - Bab 7 Stokiometri IiMoreno LorenzoBelum ada peringkat
- 1h X - Bab 1 Hakikat Ilmu KimiaDokumen16 halaman1h X - Bab 1 Hakikat Ilmu KimiaMoreno LorenzoBelum ada peringkat
- 1h X - Bab 1 Hakikat Ilmu KimiaDokumen16 halaman1h X - Bab 1 Hakikat Ilmu KimiaMoreno LorenzoBelum ada peringkat
- Hrwi 1452745776Dokumen6 halamanHrwi 1452745776Randy Pramana PutraBelum ada peringkat
- Kelas 5 SD Tematik 7 Sejarah Peradaban ManusiaDokumen140 halamanKelas 5 SD Tematik 7 Sejarah Peradaban Manusiababeradit100% (7)