Bioproses Bab 2.7
Diunggah oleh
Alfid RevtanHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Bioproses Bab 2.7
Diunggah oleh
Alfid RevtanHak Cipta:
Format Tersedia
Bagian 2.
7
Dalam reaksi kimia atau biokimia, atom dan molekul mengatur ulang untuk membentuk kelompok baru.
Hubungan massa dan molar antara reaktan yang dikonsumsi dan produk yang terbentuk dapat ditentukan
dengan menggunakan perhitungan stoikiometrik. Informasi ini disimpulkan dari persamaan reaksi yang
ditulis dengan benar dan bobot atom yang relevan.
Sebagai contoh, perhatikan reaksi utama dalam fermentasi alkohol: konversi glukosa menjadi etanol dan
karbon dioksida:
Persamaan reaksi ini menyatakan bahwa satu molekul glukosa dipecah untuk menghasilkan dua molekul
etanol dan dua molekul karbon dioksida. Dengan menerapkan berat molekul, persamaan tersebut
menunjukkan bahwa reaksi. 180 g glukosa menghasilkan 92 g etanol dan 88 g karbon dioksida. Selama
reaksi kimia atau bio-kimia, dua kuantitas digunakan sebagai berikut :
(i) massa total, yaitu massa total reaktan = massa total produk; dan
(ii) jumlah atom dari setiap elemen, mis. jumlah atom C, H dan O dalam reaktan = jumlah atom C, H dan O,
masing-masing, dalam produk.
Perhatikan bahwa tidak ada hukum yang sesuai untuk konservasi mol; mol reaktan tidak sama dengan mol
produk.
Dengan sendirinya, persamaan seperti (2.33) menunjukkan bahwa semua reaktan diubah menjadi produk
yang ditentukan dalam persamaan, dan reaksi tersebut berlanjut sampai selesai. Hal ini sering tidak terjadi
pada reaksi industri. Karena stoikiometri mungkin tidak diketahui secara tepat, atau untuk memanipulasi
reaksi yang menguntungkan, reaktan biasanya tidak diberikan dalam proporsi yang tepat yang ditunjukkan
oleh persamaan reaksi. Jumlah berlebih dari beberapa reaktan dapat diberikan. Bahan berlebih ini
ditemukan dalam campuran produk setelah reaksi dihentikan. Sebagai tambahan, reaktan sering
dikonsumsi dalam reaksi samping untuk membuat produk yang tidak dijelaskan oleh persamaan reaksi
utama; Produk sampingan ini juga merupakan bagian dari campuran reaksi akhir. Dalam keadaan seperti
ini, diperlukan informasi tambahan sebelum jumlah produk yang terbentuk atau reaktan yang dikonsumsi
dapat dihitung. Istilah yang digunakan untuk menggambarkan reaksi parsial dan bercabang diuraikan di
bawah ini:
(I) Reaktan pembatas adalah reaktan yang berjumlah kecil di stoikometri. Sementara, reaktan lain terdapat
dalam jumlah absolut yang lebih kecil, pada saat molekul terakhir dari reaktan pembatas dikonsumsi,
jumlah residu dari semua reaktan kecuali reaktan pembatas akan ada dalam campuran reaksi. Sebagai
contoh, untuk reaksi asam glutamat dari Contoh 2.4, jika 100 g glukosa, 17 g NH3 dan 48 g 0 2 yang
disediakan untuk konversi, glukosa akan menjadi reaktan pembatas meskipun massa yang lebih besar
tersedia dibandingkan dengan substrat lainnya.
(Ii)Reaktan berlebih adalah reaktan yang ada dalam jumlah yang melebihi yang dibutuhkan untuk
digabungkan dengan semua reaktan pembatas. Ini berarti bahwa reaktan berlebih adalah satu yang tersisa
dalam campuran reaksi ketika semua reaktan pembatas dikonsumsi. Persentase kelebihan dihitung
menggunakan jumlah bahan berlebih terhadap kuantitas yang dibutuhkan untuk konsumsi lengkap reaktan
pembatas:
Jumlah reaktan yang dibutuhkan adalah kuantitas stoikiometrik yang dibutuhkan untuk konversi lengkap
dari reaktan pembatas. Sebagai contoh, asam glutamat di atas, jumlah NH 3 yang diperlukan untuk
konversi total glukosa 100 g adalah 9,4 g; Oleh karena itu jika 17 g NH3 diberi persentase persen NH3
adalah 80%. Sekalipun hanya sebagian dari reaksi yang benar-benar terjadi, diperlukan dan kelebihan
kuantitas didasarkan pada keseluruhan jumlah pereaksi yang membatasi.
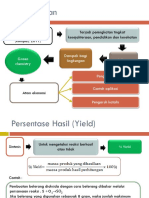
(III)Konversi adalah fraksi atau persentase reaktan yang akan menjadi produk.
(IV) Tingkat penyelesaian biasanya fraksi atau persentase dari reaktan pembatas yang dikonversi menjadi
produk. (V)Selektivitas adalah jumlah produk tertentu yang terbentuk sebagai sebagian kecil dari jumlah
yang akan terbentuk jika semua bahan umpan telah dikonversi ke produk itu.
(VI)Hasil adalah perbandingan massa atau mol produk yang terbentuk terhadap massa atau mol reaktan
yang dikonsumsi. Jika lebih dari satu produk atau reaktan dilibatkan dalam reaksi, senyawa-senyawa
partikular yang dimaksud harus dinyatakan, misalnya Hasil asam glutamat dari glukosa adalah 0,6 g g-1.
Karena kompleksitas metabolisme dan sering terjadinya reaksi samping, hasil merupakan istilah penting
dalam analisis bioproses. Penerapan konsep imbal hasil reaksi sel dan enzim dijelaskan lebih rinci pada
Bab 11.
Anda mungkin juga menyukai
- Katalis HomogenDokumen7 halamanKatalis HomogenKiki Mulqiah100% (1)
- Bab Iv PBL SboDokumen2 halamanBab Iv PBL SboKevin KuandinataBelum ada peringkat
- StoikiometriDokumen7 halamanStoikiometriFaris NurcahyaBelum ada peringkat
- Persamaan Kimia Dan Stoikiometri (Mr. Cecep Slamet Abadi)Dokumen18 halamanPersamaan Kimia Dan Stoikiometri (Mr. Cecep Slamet Abadi)GUMELAR RIZQI MAHARDIKA Mahasiswa PNJBelum ada peringkat
- Azas Teknik KimiaDokumen32 halamanAzas Teknik KimiaHikmahUtsukushiBelum ada peringkat
- 3 - Choice of Reactor 2 - Reactor ConditionsDokumen33 halaman3 - Choice of Reactor 2 - Reactor Conditionsandryan setya ramadhanBelum ada peringkat
- PPK - Neraca MassaDokumen36 halamanPPK - Neraca MassaFirmansyah B.Belum ada peringkat
- StoikiometriDokumen13 halamanStoikiometriAhmad Maulana Bintang RamadhanBelum ada peringkat
- Modul Praktek Proses KonversiDokumen33 halamanModul Praktek Proses KonversiRISTAARISRIYANTOBelum ada peringkat
- Makalah Kinetika Dan KatalisDokumen17 halamanMakalah Kinetika Dan KatalisDhea NiidiyaBelum ada peringkat
- m2 ProfDokumen17 halamanm2 ProfdeiadiBelum ada peringkat
- Neraca Massa Dan EnergiDokumen11 halamanNeraca Massa Dan EnergiHana Nurulan Asri100% (1)
- Ekonomi AtomDokumen6 halamanEkonomi AtomDhimas FebryanBelum ada peringkat
- III Jenis ReaktorDokumen47 halamanIII Jenis ReaktorJoshua AlexanderBelum ada peringkat
- Komponen Dalam KatalisDokumen35 halamanKomponen Dalam KatalisDaniiSimanjuntakBelum ada peringkat
- Azas Teknik Kimia IDokumen13 halamanAzas Teknik Kimia INungkiwidyasBelum ada peringkat
- Pada Stoikiometri LarutanDokumen11 halamanPada Stoikiometri LarutanLia AlamsyahBelum ada peringkat
- War Preparation - Sidang Akhir PDFDokumen8 halamanWar Preparation - Sidang Akhir PDFAlifFasyach Syarif SeftiajiBelum ada peringkat
- Konversi Kimia Dan Reaksi Tunggal Dalam Reaktor IdealDokumen32 halamanKonversi Kimia Dan Reaksi Tunggal Dalam Reaktor IdealNur Agni AlvinaBelum ada peringkat
- Perancangan Proses 2Dokumen46 halamanPerancangan Proses 220-124 EkkiBelum ada peringkat
- Azas Teknik Kimia IDokumen13 halamanAzas Teknik Kimia IMelisa Adrian0% (1)
- Stoikhiometri PTKDokumen27 halamanStoikhiometri PTKBella ApriliaBelum ada peringkat
- Katalis HomogenDokumen13 halamanKatalis HomogenArsendi NugrahaBelum ada peringkat
- Bab I Pendahuluan-CetakDokumen13 halamanBab I Pendahuluan-CetakErlangga Aria PratamaBelum ada peringkat
- Tugas Khusus ReaktorDokumen27 halamanTugas Khusus ReaktorAprilia SulistianingsihBelum ada peringkat
- BAB II ReactorDokumen12 halamanBAB II ReactorFitri DmBelum ada peringkat
- Reaktor KimiaDokumen38 halamanReaktor KimiaLuthfi Ma'arifBelum ada peringkat
- Laporan Batch Reaktor..Dokumen12 halamanLaporan Batch Reaktor..Nevitalia Rosananda100% (1)
- Latihan Soal Kimia Katalis Untuk Uts Part 2Dokumen8 halamanLatihan Soal Kimia Katalis Untuk Uts Part 2Gina Ai NurohmahBelum ada peringkat
- NM Dengan ReaksiDokumen16 halamanNM Dengan ReaksiSirajul HudaBelum ada peringkat
- AnalyzingChange GainDokumen40 halamanAnalyzingChange GainIva Septy WulandariBelum ada peringkat
- Bab I Pik 2 FixDokumen41 halamanBab I Pik 2 FixAdistia BungaBelum ada peringkat
- Translate Jurnal Materi and Energy BalanceDokumen28 halamanTranslate Jurnal Materi and Energy BalanceFaizatur Rofi'ahBelum ada peringkat
- Katalis Dalam IndustriDokumen8 halamanKatalis Dalam IndustriChintiya AsmaraniBelum ada peringkat
- Tugas AkhirDokumen17 halamanTugas AkhirpeterBelum ada peringkat
- Bab IDokumen27 halamanBab Ifadhillah ivanBelum ada peringkat
- IV Kondisi ReaktorDokumen43 halamanIV Kondisi ReaktorJoshua AlexanderBelum ada peringkat
- Retros in Tes IsDokumen4 halamanRetros in Tes IsMusliana sari QalbiBelum ada peringkat
- P4 NM DG Reaksi Kimia 1 AlatDokumen11 halamanP4 NM DG Reaksi Kimia 1 AlatGibran Al HudaBelum ada peringkat
- KF SaponifikasiDokumen26 halamanKF Saponifikasivenanda rismaBelum ada peringkat
- Makalah KatalisDokumen25 halamanMakalah KatalisIrvan Arfian Maulana100% (1)
- Katalis FebriDokumen37 halamanKatalis FebriSri DarmayantiBelum ada peringkat
- Kimia HijauDokumen6 halamanKimia HijauEndang ParwitiBelum ada peringkat
- Pembuatan PEDokumen13 halamanPembuatan PEChokyTraBelum ada peringkat
- KatalisssDokumen11 halamanKatalisssRona Lumban GaolBelum ada peringkat
- Uts TerbaruDokumen23 halamanUts TerbaruUllia100% (1)
- BAB VI Kinetika MasaDokumen27 halamanBAB VI Kinetika MasaAldrin AndikaBelum ada peringkat
- 6 Reaktor Dalam HysysDokumen26 halaman6 Reaktor Dalam Hysysayu PSwijayaBelum ada peringkat
- Dasar Teori Laju ReaksiDokumen6 halamanDasar Teori Laju ReaksiMila NuraidaBelum ada peringkat
- Atom EconomyDokumen14 halamanAtom EconomyEsati LibraBelum ada peringkat
- NM StoikiometriDokumen34 halamanNM StoikiometriazharBelum ada peringkat
- Kinetika Kimia 5Dokumen16 halamanKinetika Kimia 5novaratu384Belum ada peringkat
- Percobaan 8 Laju ReaksiDokumen19 halamanPercobaan 8 Laju ReaksiMega ShintaBelum ada peringkat
- Reaktor Tangki BerpengadukDokumen8 halamanReaktor Tangki BerpengadukBenny FebriansyahBelum ada peringkat
- Kinetika ReaksiDokumen15 halamanKinetika ReaksiVivi FatimatuzzuhroBelum ada peringkat
- Macam-Macam Seleksi ProsesDokumen8 halamanMacam-Macam Seleksi Proseslogik4_rx2Belum ada peringkat
- Bab 2 KinetikaDokumen7 halamanBab 2 KinetikaRachel KrisyantiBelum ada peringkat