Kimia Entalpi
Diunggah oleh
Fadli Islami0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
117 tayangan9 halamanentalpi
Judul Asli
ppt kimia entalpi
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inientalpi
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
117 tayangan9 halamanKimia Entalpi
Diunggah oleh
Fadli Islamientalpi
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 9
Agung Wijayanto (04)
Fadli Islami (13)
Raka Putra (31)
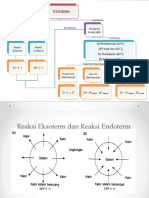
Reaksi kimia dibedakan menjadi 2 :
1. Reaksi eksoterm
- adalah reaksi kimia yang melepaskan kalor
- energi berpindah dari system ke lingkungan
- akibatnya :
- entalpi system berkurang (∆H = -)
- suhu system naik
2. Reaksi endoterm
- adl. Reaksi kimia yang menyerap kalor
- energi berpindah dari lingkungan ke system
- akibatnya :
- entalpi system bertambah (∆H= +)
- suhu system turun
1. Entalpi Pembentukan Standar ( ΔHf o)
“f” → formation
Entalpi pembentukan standar suatu senyawa menyatakan jumlah
kalor yang diperlukan / dibebaskan untuk proses pembentukan 1
mol senyawa dari unsur-unsurnya yang stabil pada keadaan
standar (298K, 1 atm).
Contoh unsur-unsur yang stabil pada keadaan standar :
H2 , O2, C, N2 ,Ag, Cl2 , Br2 , S, Na, Ca, dan Hg.
Contoh persamaan termokimia pada pembentukan senyawa:
½H2(g) + ½Cl2(g) → HCl(g) ΔH = -92,31KJ
Artinya : reaksi antara gas hidrogen (H2) dan klorin (Cl2)
membentuk 1 mol asam klorida (HCl) dan membebaskan kalor
sebanyak 92,31 KJ.
Entalpi pembentukan standar unsur-unsur dalam bentuk yang
paling stabil bernilai 0 (nol). Contohnya : O2(g), I2(s), C(grafit), H2(g) ,S(s).
Contoh persamaan termokimia pada pembentukan unsur:
I2(s) → I2(g) ΔH = +62,66 KJ
2. Entalpi Penguraian Standar (∆Hdo)
“d” → decomposition
Entalpi penguraian standar suatu senyawa menyatakan jumlah kalor
yang diperlukan/ dibebaskan untuk proses penguraian 1 mol
senyawa menjadi unsur-unsurnya pada keadaan standar (298K,
1atm).
Menurut Hukum Laplace:
Jumlah kalor yang dibebaskan pada pembentukan senyawa dari unsur-
unsurnya = jumlah kalor yang diperlukan pada penguraian
senyawa tersebut menjadi unsur-unsurnya.
Maka ΔHdo >< ∆Hfo dengan jumlah kalor sama, tetapi tandanya
berlawanan karena reaksi berlawanan arah.
Contoh persamaan termokimia:
Jika ΔHfo H2O = -240 KJmol-1 maka ∆Hdo H2O = +240 KJmol-1, dan
persamaan termokimianya:
H2O(l)→ H2(g) + ½O2(g) ∆ H = +240 KJ
3.Entalpi Pembakaran Standar ( ΔHco)
“c” → combustion
Entalpi pembakaran standar suatu senyawa menyatakan jumlah kalor
yang dibebaskan untuk pembakaran 1 mol zat (unsur atau senyawa)
pada keadaan standar (298K, 1atm).
Pembakaran selalu membebaskan kalor sehingga nilai kalor
pembakaran selalu negatif (eksoterm).
Contoh persamaan termokimia:
Jika zat yang dibakar CO(g) dan ∆Hco = -283 KJmol-1 maka persamaan
termokimianya:
CO(g)+ ½O2(g) → CO2(g) ΔH = -283 KJ
4. Entalpi Pelarutan Standar (ΔHso)
“s” → solvation
◦ Entalpi pelarutan standar menyatakan kalor yang diperlukan /
dibebaskan untuk melarutkan 1 mol zat pada keadaan standar
(298K, 1atm).
◦ Persamaan termokimia ditulis dengan mengubah keadaan standar
zat menjadi bentuk larutan.
◦ Contoh:
◦ ΔHso NaCl(aq) = +3,9 KJmol-1
◦ Persamaan termokimianya:
◦ NaCl(s) → NaCl (aq) ∆H = 3,9 KJ
◦ Penamaan entalpi atau kalor standar untuk reaksi yang lain
disesuaikan dengan reaksinya. Contoh : untuk reaksi penggaraman
disebut “entalpi atau kalor penggaraman standar”, untuk reaksi
penguapan disebut “entalpi atau kalor penguapan standar”.
Contoh:
1. HCl(aq)+ NaOH(aq) → NaCl(aq) + H2O(l) ∆H = -56KJ
∆H = -56KJmol-1 disebut entalpi atau kalor standar penggaraman NaCl.
2. H2O(l) → H2O(g) ) ∆H = +44,01 KJ
∆H = +44,01 KJmol-1 disebut entalpi atau kalor standar penguapan air.
3. I2(s) → I2(g) ∆H = +62,44 KJ
∆H = +62,44 KJmol-1 disebut entalpi atau kalor sublimasi standar iodin.
4. C2H4(g) + H2(g) → C2H6(g) ∆H = -138 KJ
∆H = -138 KJmol-1 disebut entalpi atau kalor adisi C2H4 dan Hidrogen.
ΔH reaksi dapat dihitung dengan menggunakan hukum hess.
Hukum Hess:
◦ Kalor reaksi tidak bergantung pada lintasan, tetapi hanya ditentukan
keadaan awal dan keadaan akhir.
◦ Hukum penjumlahan kalor.
Dengan menggunakan kalorimrter dapat ditentukan kalor pembentukan CO2
adalah Hf = -393,52 kJ, dan kalor pembakaran CO adalah Hf = -283,0 kJ.
Tetapi kalor yang dilepaskan atau diserap oleh reaksi CO dari c dan O2 tidak
dapat ditentukan oleh kalorimeter. Dalam hal ini hukum Hess akan
membantu kita dalam melakukan perhitungan terhadap perubahan entalpi
reaksi pembentukan CO tersebut.
C(s) + O2(g) → CO2(g) Hf = -393,52 kJ
CO(g) + ½ O2(g) → CO2(g) Hc = -283,0 kJ
Jika dianalisis lebih lanjut pembentukan CO(g) merupakan tahapan reaksi
dalam pembentukan CO2(g) dari unsur C dan gas O2.
Anda mungkin juga menyukai
- Makalah Senam Poco Poco 9 Cabang OlahragaDokumen6 halamanMakalah Senam Poco Poco 9 Cabang OlahragaFadli Islami0% (1)
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- TermokimiaDokumen17 halamanTermokimiaYosep Kevin DamanikBelum ada peringkat
- TermokimiaDokumen25 halamanTermokimiaidzni desrifaniBelum ada peringkat
- Termokimia SMADokumen23 halamanTermokimia SMAWahid ArdaniBelum ada peringkat
- Term Okimi ADokumen24 halamanTerm Okimi ASyaiful AnamBelum ada peringkat
- Term Okimi ADokumen36 halamanTerm Okimi AHasna YumnaBelum ada peringkat
- TermokimiaDokumen23 halamanTermokimiarahmatBelum ada peringkat
- BAB II TermokimiaDokumen4 halamanBAB II TermokimiaTri FaturrBelum ada peringkat
- 3 TermokimiaDokumen9 halaman3 TermokimiaIvan ApriBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- KD Mesin 7 8Dokumen40 halamanKD Mesin 7 8Saverianus JakBelum ada peringkat
- MODUL ThermokimiaDokumen12 halamanMODUL ThermokimiaIra Irani PuspitasariBelum ada peringkat
- TermokimiaDokumen40 halamanTermokimiaMega RestiaBelum ada peringkat
- TERMOKIMIADokumen37 halamanTERMOKIMIATM-21-084 RIFQI TUBAGUS HILMIBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIARahayu LestariBelum ada peringkat
- Termokimia PDFDokumen42 halamanTermokimia PDFstrygwyrgtBelum ada peringkat
- Termokimia SWDDokumen21 halamanTermokimia SWDRita AnggrainiBelum ada peringkat
- Termokimia 1Dokumen54 halamanTermokimia 1Hafidz Naufal SyamaidzarBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIAikke febri yenikaBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Bab 5 TermokimiaDokumen5 halamanBab 5 TermokimiaHafidz SayyidBelum ada peringkat
- Termokimia (12-13) PDFDokumen83 halamanTermokimia (12-13) PDFYuliantari YuliantariBelum ada peringkat
- 002 Termokimia - EnatalpiDokumen37 halaman002 Termokimia - EnatalpiAmar Ma'rufBelum ada peringkat
- Entalpi PembentukanDokumen24 halamanEntalpi PembentukanAnakLeta AnulBelum ada peringkat
- Termokimia - Tgs Kimia KLMPK 3Dokumen38 halamanTermokimia - Tgs Kimia KLMPK 3dzaky najwanBelum ada peringkat
- ThermokimiaDokumen35 halamanThermokimiaVicky raihan akbar 068Belum ada peringkat
- Termokimia 1Dokumen21 halamanTermokimia 1Desi wulandariBelum ada peringkat
- Entalpi Dan PerubahannyaDokumen5 halamanEntalpi Dan Perubahannyaani widayantiBelum ada peringkat
- TERMOKIMIADokumen14 halamanTERMOKIMIAIzzul MuttaqinBelum ada peringkat
- Termokimia 2Dokumen83 halamanTermokimia 2Smahangtuah MakassarBelum ada peringkat
- Jbptunikompp GDL Dianandria 23521 3 3.kimia ADokumen37 halamanJbptunikompp GDL Dianandria 23521 3 3.kimia Aali akbarBelum ada peringkat
- Materi Kimia Dasar Teknik Pertemuan 15Dokumen28 halamanMateri Kimia Dasar Teknik Pertemuan 15gily StrongBelum ada peringkat
- Termokimia PPTXDokumen24 halamanTermokimia PPTXpipitBelum ada peringkat
- Kimia-Terapan-TermokimiaDokumen39 halamanKimia-Terapan-TermokimiaPutri WandiniBelum ada peringkat
- Bentuk Molekul Modul 1 Pertemuan 4Dokumen37 halamanBentuk Molekul Modul 1 Pertemuan 4idatulfitriahBelum ada peringkat
- 3 - TermokimiaDokumen37 halaman3 - TermokimiaSella RamayantiBelum ada peringkat
- Termokimia EntalpiDokumen37 halamanTermokimia EntalpiMaharani ZahraBelum ada peringkat
- Term Okimi ADokumen37 halamanTerm Okimi AziziBelum ada peringkat
- Bahan Ajar TermokimiaDokumen32 halamanBahan Ajar Termokimiacecile ljBelum ada peringkat
- TermokimiaDokumen41 halamanTermokimiaCininta AdmiraBelum ada peringkat
- Energi IkatanDokumen37 halamanEnergi IkatanAnadia PutriBelum ada peringkat
- TermokimiaDokumen41 halamanTermokimiaHanifahDwi SaharaBelum ada peringkat
- TERMOKIMIADokumen44 halamanTERMOKIMIAIqna AmaliyahBelum ada peringkat
- Termokimia KimdasDokumen38 halamanTermokimia KimdasRaniBelum ada peringkat
- Pengertian EntalpiDokumen2 halamanPengertian EntalpiWidjaseno Garjito PBelum ada peringkat
- Termokimia TGTDokumen18 halamanTermokimia TGTSyafira TiaradipaBelum ada peringkat
- Materi Kimia Umum 2Dokumen53 halamanMateri Kimia Umum 2Agung Pratama Hitarijat100% (3)
- TermokimiaDokumen30 halamanTermokimiaLailatul LuthfiyatiBelum ada peringkat
- TermokimiaDokumen4 halamanTermokimiaAnggita Widya NugrohoBelum ada peringkat
- TERMOKIMIADokumen63 halamanTERMOKIMIAAri Sofyan SauriBelum ada peringkat
- Materi Termokimia MicroDokumen10 halamanMateri Termokimia MicroSitiNurAzizah A.TBelum ada peringkat
- KIMIADokumen23 halamanKIMIAIngrid PattiasinaBelum ada peringkat
- TermokimiaDokumen70 halamanTermokimiaIsma Nisa0% (1)
- Pengertian EntalpiDokumen2 halamanPengertian EntalpiEdwin WirghoBelum ada peringkat
- TermokimiaDokumen68 halamanTermokimiaEmma TheresiaBelum ada peringkat
- Termokimia Part 2Dokumen15 halamanTermokimia Part 2Devi KurniawatiBelum ada peringkat
- Termokimia SWDDokumen25 halamanTermokimia SWDDede Abdul AzisBelum ada peringkat
- Fadli Islami (B) - Praktikum 8 - R0220043Dokumen1 halamanFadli Islami (B) - Praktikum 8 - R0220043Fadli IslamiBelum ada peringkat
- Fadli Islami - R0220043 - BDokumen5 halamanFadli Islami - R0220043 - BFadli IslamiBelum ada peringkat
- RESUME1YTDokumen3 halamanRESUME1YTFadli IslamiBelum ada peringkat
- Fadli Islami - R0220043 - BDokumen5 halamanFadli Islami - R0220043 - BFadli IslamiBelum ada peringkat
- Kel 3 Kelelahan KerjaDokumen9 halamanKel 3 Kelelahan KerjaFadli IslamiBelum ada peringkat
- Bab 1 Pengantar Pendidikan PancasilaDokumen17 halamanBab 1 Pengantar Pendidikan Pancasilayanti sulistiyaniBelum ada peringkat
- Tugas Bind LiterasiDokumen9 halamanTugas Bind LiterasiFadli IslamiBelum ada peringkat
- Blk09 Pasar ModalDokumen37 halamanBlk09 Pasar ModalRachmad GemilangBelum ada peringkat
- Remed Bio X-Mipa 3Dokumen11 halamanRemed Bio X-Mipa 3Fadli IslamiBelum ada peringkat
- Uas MPK Fadli Islami r0220043 BDokumen3 halamanUas MPK Fadli Islami r0220043 BFadli IslamiBelum ada peringkat
- Pasarmodalpresentasi 141019163414 Conversion Gate01Dokumen11 halamanPasarmodalpresentasi 141019163414 Conversion Gate01Fadli IslamiBelum ada peringkat
- Pasar Modal JadiDokumen24 halamanPasar Modal JadiFadli IslamiBelum ada peringkat
- Proposal Makanan KWUDokumen6 halamanProposal Makanan KWUFadli IslamiBelum ada peringkat
- Pasarmodal 120221091855 Phpapp01Dokumen21 halamanPasarmodal 120221091855 Phpapp01Fadli IslamiBelum ada peringkat
- Biologi KelDokumen10 halamanBiologi KelFadli IslamiBelum ada peringkat
- Kel 5 SejarahDokumen23 halamanKel 5 SejarahFadli IslamiBelum ada peringkat
- Kisi-Kisi Un Gabung Sma TP 2019 - 2020 PDFDokumen71 halamanKisi-Kisi Un Gabung Sma TP 2019 - 2020 PDFAdiba KaifaBelum ada peringkat
- KEL 6 Word PKNDokumen11 halamanKEL 6 Word PKNFadli IslamiBelum ada peringkat
- Kisi-Kisi Un Gabung Sma TP 2019 - 2020 PDFDokumen71 halamanKisi-Kisi Un Gabung Sma TP 2019 - 2020 PDFAdiba KaifaBelum ada peringkat
- Kelompok 3Dokumen7 halamanKelompok 3Fadli IslamiBelum ada peringkat
- Kel 6 PKNDokumen11 halamanKel 6 PKNFadli IslamiBelum ada peringkat
- Pasarmodal 120221091855 Phpapp01Dokumen21 halamanPasarmodal 120221091855 Phpapp01Fadli IslamiBelum ada peringkat
- Pasarmodalpresentasi 141019163414 Conversion Gate01Dokumen11 halamanPasarmodalpresentasi 141019163414 Conversion Gate01Fadli IslamiBelum ada peringkat
- Pasar Modal JadiDokumen24 halamanPasar Modal JadiFadli IslamiBelum ada peringkat
- Blk09 Pasar ModalDokumen37 halamanBlk09 Pasar ModalRachmad GemilangBelum ada peringkat
- SafetyandHealthforEngineers Second 95726-2-17+ (1) .En - Id PDFDokumen16 halamanSafetyandHealthforEngineers Second 95726-2-17+ (1) .En - Id PDFFadli IslamiBelum ada peringkat
- KRS Digabungkan PDFDokumen3 halamanKRS Digabungkan PDFFadli IslamiBelum ada peringkat
- Kelompok Maba Gel 2Dokumen66 halamanKelompok Maba Gel 2Fadli IslamiBelum ada peringkat
- Lembar Acc PDFDokumen1 halamanLembar Acc PDFFadli IslamiBelum ada peringkat