ENTALPI REAKSI
Diunggah oleh
Nur Mukhlisa0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
62 tayangan18 halamanDokumen tersebut membahas tentang entalpi reaksi, hukum Hess, dan energi ikatan. Ada beberapa jenis perubahan entalpi standar yang dijelaskan seperti perubahan entalpi standar, pembentukan, penguraian, dan pembakaran. Metode penentuan nilai entalpi reaksi meliputi penggunaan kalorimeter, hukum Hess, dan perhitungan energi ikatan.
Deskripsi Asli:
Judul Asli
MATERI ENTALPI
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniDokumen tersebut membahas tentang entalpi reaksi, hukum Hess, dan energi ikatan. Ada beberapa jenis perubahan entalpi standar yang dijelaskan seperti perubahan entalpi standar, pembentukan, penguraian, dan pembakaran. Metode penentuan nilai entalpi reaksi meliputi penggunaan kalorimeter, hukum Hess, dan perhitungan energi ikatan.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
62 tayangan18 halamanENTALPI REAKSI
Diunggah oleh
Nur MukhlisaDokumen tersebut membahas tentang entalpi reaksi, hukum Hess, dan energi ikatan. Ada beberapa jenis perubahan entalpi standar yang dijelaskan seperti perubahan entalpi standar, pembentukan, penguraian, dan pembakaran. Metode penentuan nilai entalpi reaksi meliputi penggunaan kalorimeter, hukum Hess, dan perhitungan energi ikatan.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 18
TERMOKIMIA
Entalpi Reaksi, Hukum Hess,
dan
Energi Ikatan
Apa Itu Entalpi?
PENGERTIAN ENTALPI
Entapi merupakan besarnya energi yang diukur
pada tekanan tetap yang dimiliki oleh suatu
sistem. Entalpi reaksi yaitu besarnya entalpi yang
mengikuti suatu reaksi.
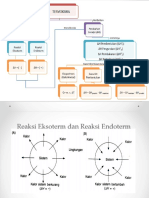
JENIS-JENIS ENTALPI
Jenis-Jenis Perubahan
Entalpi Standar
1. Perubahan Entalpi Standar (∆H⁰)
2. Perubahan Entalpi Pembentukan Standar
(∆Hf⁰)
3. Perubahan Entalpi Penguraian Standar
(∆Hd⁰)
4. Perubahan Entalpi Pembakaran Standar
(∆Hc⁰)
Perubahan Entalpi Standar (∆H⁰)
Perubahan entalpi standar adalah pengukuran
besarnya kalor yang diserap atau dibebaskan
dari suatu reaksi yang berlangsung pada
keadaan standar .
Perubahan Entalpi Pembentukan Standar (∆Hf⁰)
Perubahan entalpi pembentukan standar adalah
pengukuran besarnya energi yang diserap atau dilepas
untuk pembentukan 1 mol senyawa dari unsur-
unsurnya yang paling stabil pada keadaan standar.
Contoh:
Persamaan termokimia dari reaksi pembentukan 1 mol
NaCl yang membebaskan energi sebesar 77 kJ/mol
adalah sebagai berikut
Na (s) + ½ Cl (g) → NaCl (s) ∆Hf⁰ = -77 kJ
Perubahan Entalpi Penguraian Standar (∆Hd⁰)
Perubahan entalpi penguraian standar adalah
pengukuran besarnya energi yang diserap atau dilepas
untuk menguraikan 1 mol senyawa dari unsur-unsurnya
yang paling stabil pada keadaan standar.
Contoh:
Persamaan termokimia dari reaksi penguraian 1 mol
uap air yang membutuhkan energi sebesar 242 kJ
adalah sebagai berikut
H₂O (g) → H₂ (g) + ½O₂ (g) ∆Hd⁰ = +242 kJ
Perubahan Entalpi Pembakaran Standar (∆Hc⁰)
Perubahan entalpi pembakaran standar adalah
pengukuran besarnya energi yang dilepaskan dari
pembakaran 1 mol suatu zat
Contoh:
Persamaan termokimia dari reaksi pembakaran 1 mol
gas metana yang membebaskan energi sebesar 802 kJ
adalah sebagai berikut
CH₄ (g) + 2O₂ (g) → CO₂ (g) + 2H₂O (l) ∆Hc⁰ = -
802 kJ
Penentuan Harga Perubahan Entalpi (∆H)
1. Menentukan besarnya energi yang diserap atau
dibebaskan oleh air dengan kalorimeter.
q = m × c × ∆T
dimana:
q = energi /kalor
m = massa air
c = kalor jenis air (4,18 J/g.C)
∆T = perubahan suhu
Penentuan Harga Perubahan Entalpi (∆H)
Contoh soal:
Tentukan entalpi pembakaran standar metanol (Mr = 16) sebanyak
0,48 gram yang dibakar dalam kalorimeter yang berisi 500 gram air
dan terjadi peningkatan suhu sebesar 15⁰C. Tuliskan persamaan
termokimianya.
Pembahasan:
Diketahui :
m = 500 gram
c = 4,18 J/g.C
∆T = 15⁰C
Penyelesaian:
q = m × c × ∆T
q = 500 g × 4,18 J/g.C × 15⁰C
q = 31.350 J
q = 31,35 kJ
Penentuan Harga Perubahan Entalpi (∆H)
Mol metanol = Massa/Mr
= 0,48/16
= 0,03 mol
∆H pembakaran 0,03 mol metanol = -31,34 kJ
∆H pembakaran 1 mol metanol = 1 mol /0,03 mol × (-31,35 kJ)
= -1045 kJ
Maka Persamaan termokimianya:
CH₃OH + ½O₂ (g) → CO₂ (g) + 2H₂O (l) ∆Hc⁰ = -1045 kJ
Penentuan Harga Perubahan Entalpi (∆H)
2. Menentukan besar ∆H berdasar Hukum Hess
Hukum Hess berbunyi, “Entalpi suatu reaksi tidak dipengaruhi
oleh jalannya reaksi, akan tetapi hanya bergantung pada keadaan
awal dan keadaan akhir...”.
Proses I= A → B = ∆H1
Proses II = A → D = ∆H2
Proses II = D → E = ∆H3
Proses II = E → B = ∆H4
Proses III = A → C = ∆H5
Proses III = C → B = ∆H6
∆H proses I = ∆H proses II = ∆H proses III
∆H1 = ∆H2 + ∆H3 + ∆H4 = ∆H5 + ∆H6
Penentuan Harga Perubahan Entalpi (∆H)
Contoh Soal:
Diketahui reaksi:
C₆H₁₂O₆ + 6O₂ → 6CO₂ + 6H₂O ∆H = -2820 kJ
C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O ∆H = -1380 Kj
Tentukan perubahan entalpi (∆H) bagi reaksi fermentasi 360 gram
glukosa (Mr = 180).
Reaksi fermentasi glukosa sebagai berikut:
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂
Pembahasan:
C₆H₁₂O₆ + 6O₂ → 6CO₂ + 6H₂O ∆H = -2820 kJ
4CO₂ + 6H₂O → 2C₂H₅OH + 6O₂ ∆H = +2760 Kj(×2)
C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂ ∆H = -60 kJ
Mol C₆H₁₂O₆ = massa/Mr
= 360/180
= 2 mol
∆H untuk 2 mol glukosa = 2 mol/1 mol × (-60 kJ) = -120 kJ
Penentuan Harga Perubahan Entalpi (∆H)
3.Menentukan besar ∆H berdasar entalpi pembentukan
Reaksi: aA + bB → cC + dD
∆H Reaksi = ∆Hf⁰ produk - ∆Hf⁰ reaktan
∆H Reaksi = (c ×∆Hf⁰ C + d × ∆Hf⁰ D)-(a × ∆Hf⁰ A + b × ∆Hf⁰ B)
Contoh Soal:
Diketahui data entalpi pembentukan standar
C₃H₈ (g) = -104 kJ/mol
CO₂ (g) = -394 kJ/mol
H₂O (g) = -286 Kj/mol
Tentukan ∆H reaksi:
C₃H₈ (g) + 5O₂ (g) → 3CO₂ (g) + 4H₂O (g)
Pembahasan:
∆H Reaksi = ∆Hf⁰ produk - ∆Hf⁰ reaktan
∆H Reaksi = (3×∆Hf⁰ CO₂ + 4 × ∆Hf⁰ H₂O)-(1 × ∆Hf⁰ C₃H₈ +
5× ∆Hf⁰ O₂)
∆H Reaksi = (3 × (-394 kJ/mol) + 4 × (-286 kJ/mol)) – (1 × (-
104 kJ/mol) + (5 × 0)
Penentuan Harga Perubahan Entalpi (∆H)
∆H Reaksi = (-1182 kJ + (-1144 kJ)) – (-104 kJ)
∆H Reaksi = -2326 kJ + 104 kJ
∆H Reaksi = -2222 kJ
Penentuan Harga Perubahan Entalpi (∆H)
4. Menentukan besar ∆H berdasarkan energi ikatan
Pemutusan dan pembentukan ikatan menyebabkan
terjadinya reaksi kimia. Perubahan entalpi dapat diketahui
dari selisih ∆H pemutusan dan ∆H pembentukan ikatan.
∆H = Σ Energi pemutusan ikatan – Σ Energi pembentukan
ikatan
Contoh Soal:
Diketahui energi ikatan (kJ/mol) dari:
C ˗ H = 413
O = O = 495
C = O = 799
O ˗ H = 463
Tentukan perubahan entalpi (∆H) dari reaksi berikut:
CH₄ (g) + 2O₂ (g) → CO₂ (g) + 2H₂O (g)
Penentuan Harga Perubahan Entalpi (∆H)
Pembahasan:
∆H = Σ Energi pemutusan ikatan – Σ Energi pembentukan
ikatan
∆H = 4 (C-H) + 2 (O=O) – 2 (C=O) + 4 (O-H)
∆H = (4 × 413) + (2 × 495) – (2 × 799) + (4 × 463)
∆H = 2642 kJ – 3450 kJ
∆H = -808 kJ
Anda mungkin juga menyukai
- Entalpi Dan PerubahannyaDokumen5 halamanEntalpi Dan Perubahannyaani widayantiBelum ada peringkat
- TermokimiaDokumen19 halamanTermokimiaTasya FakhiraBelum ada peringkat
- KBM Kimia XiDokumen2 halamanKBM Kimia XiSaifullah Abi NabilaBelum ada peringkat
- Termokimia TGTDokumen18 halamanTermokimia TGTSyafira TiaradipaBelum ada peringkat
- MODUL ThermokimiaDokumen12 halamanMODUL ThermokimiaIra Irani PuspitasariBelum ada peringkat
- Bahan Ajar TermokimiaDokumen32 halamanBahan Ajar Termokimiacecile ljBelum ada peringkat
- KIMIADokumen23 halamanKIMIAIngrid PattiasinaBelum ada peringkat
- Termokimia PDFDokumen7 halamanTermokimia PDFraftwarriorBelum ada peringkat
- TermokimiaDokumen26 halamanTermokimiatin's100% (1)
- Termokimia 2Dokumen46 halamanTermokimia 2angelina josephineBelum ada peringkat
- TERMOKIMIADokumen4 halamanTERMOKIMIATri FaturrBelum ada peringkat
- Termokimia Part 2Dokumen15 halamanTermokimia Part 2Devi KurniawatiBelum ada peringkat
- REAKSI KIMIA DAN ENTALPIDokumen25 halamanREAKSI KIMIA DAN ENTALPIidzni desrifaniBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIARahayu LestariBelum ada peringkat
- Macam-macam perubahan entalpi dan perhitungan entalpiDokumen3 halamanMacam-macam perubahan entalpi dan perhitungan entalpiindahBelum ada peringkat
- Pert Emu A 1Dokumen58 halamanPert Emu A 1_Raqhuel_ALouc_2087Belum ada peringkat
- Penentuan Kalor ReaksiDokumen15 halamanPenentuan Kalor ReaksiHaifa FadilahBelum ada peringkat
- Term Okimi ADokumen8 halamanTerm Okimi ARajib Pramono H.WBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Term Okimi ADokumen36 halamanTerm Okimi AHasna YumnaBelum ada peringkat
- KD Mesin 7 8Dokumen40 halamanKD Mesin 7 8Saverianus JakBelum ada peringkat
- Energi dan EntalpiDokumen5 halamanEnergi dan EntalpiWiwied Rizky Puspita RahayuBelum ada peringkat
- Hukum Kekekalan Energi: Persamaan TermokimiaDokumen6 halamanHukum Kekekalan Energi: Persamaan TermokimiaEmbunku Dan PagimuBelum ada peringkat
- Bab 3. TermokimiaDokumen26 halamanBab 3. TermokimiaReky RumenganBelum ada peringkat
- Termokimia SMADokumen23 halamanTermokimia SMAWahid ArdaniBelum ada peringkat
- TERMOKIMIADokumen23 halamanTERMOKIMIAAdamDio ZaidanDhuhaBelum ada peringkat
- Pengantar Termodinamika 1-1Dokumen13 halamanPengantar Termodinamika 1-1AgusBelum ada peringkat
- 3 TermokimiaDokumen32 halaman3 TermokimiaernaBelum ada peringkat
- Contoh Soal TermokimiaDokumen13 halamanContoh Soal TermokimiaQurrotul A'yunBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Termodinamika KimiaDokumen5 halamanTermodinamika KimiaHafidz SayyidBelum ada peringkat
- TermokimiaDokumen17 halamanTermokimiaYosep Kevin DamanikBelum ada peringkat
- 3 TermokimiaDokumen9 halaman3 TermokimiaIvan ApriBelum ada peringkat
- MENENTUKAN ΔHDokumen3 halamanMENENTUKAN ΔHNurrahim Bambang Sholihin100% (1)
- TERMOKIMIADokumen9 halamanTERMOKIMIAikke febri yenikaBelum ada peringkat
- Term Okimi ADokumen24 halamanTerm Okimi ASyaiful AnamBelum ada peringkat
- Energitika KimiaDokumen20 halamanEnergitika KimiaRegina SilvaBelum ada peringkat
- TERMOKIMIADokumen63 halamanTERMOKIMIAAri Sofyan SauriBelum ada peringkat
- TermokimiaDokumen30 halamanTermokimiaLailatul LuthfiyatiBelum ada peringkat
- Bab 6 TermokimiaDokumen46 halamanBab 6 TermokimiaGalang Arya SaputraBelum ada peringkat
- TermokimiaDokumen36 halamanTermokimiaNyimas FebrikaBelum ada peringkat
- 002 Termokimia - EnatalpiDokumen37 halaman002 Termokimia - EnatalpiAmar Ma'rufBelum ada peringkat
- TERMOKIMIADokumen38 halamanTERMOKIMIAdzaky najwanBelum ada peringkat
- TERMOKIMIADokumen38 halamanTERMOKIMIARaniBelum ada peringkat
- REAKSI TERMOKIMIADokumen25 halamanREAKSI TERMOKIMIAhahahaBelum ada peringkat
- Materi Termokimia SMT 1Dokumen36 halamanMateri Termokimia SMT 1rendy bagasBelum ada peringkat
- Berdasarkan Data ∆HfDokumen10 halamanBerdasarkan Data ∆HfAnggi FadilahhBelum ada peringkat
- TermokimiaDokumen32 halamanTermokimiaTin InBelum ada peringkat
- ThermokimiaDokumen35 halamanThermokimiaVicky raihan akbar 068Belum ada peringkat
- TERMOKIMIADokumen39 halamanTERMOKIMIAPutri WandiniBelum ada peringkat
- Soal Kimdas 2Dokumen11 halamanSoal Kimdas 2Rachma Rumie RianthiBelum ada peringkat
- Term Okimi ADokumen32 halamanTerm Okimi Amutiara tiaraBelum ada peringkat
- LKPD tERMOKIMIADokumen11 halamanLKPD tERMOKIMIAKrisostomus AnsaBelum ada peringkat
- Termokimia Part 2Dokumen25 halamanTermokimia Part 2ANNISA SALSABILAXI MIPA 104Belum ada peringkat
- TERMOKIMIADokumen37 halamanTERMOKIMIATM-21-084 RIFQI TUBAGUS HILMIBelum ada peringkat
- Thermokimia IIDokumen31 halamanThermokimia IIChristian DaniswaraBelum ada peringkat
- 3.TERMOKIMIA 220911 PowerpointDokumen36 halaman3.TERMOKIMIA 220911 PowerpointDevi Arum Zulyhani0% (1)
- Modul Ajar Ipas Fase B Kelas Iv Bab 4 Mengubah Bentuk Energi Topik Transformasi EnergiDokumen50 halamanModul Ajar Ipas Fase B Kelas Iv Bab 4 Mengubah Bentuk Energi Topik Transformasi EnergiNur Mukhlisa100% (2)
- TugasDokumen1 halamanTugasNur MukhlisaBelum ada peringkat
- Proposal KKN-T Di Desa TambanganDokumen26 halamanProposal KKN-T Di Desa TambanganNur MukhlisaBelum ada peringkat
- Kartu Kontrol - 2022Dokumen1 halamanKartu Kontrol - 2022Nur MukhlisaBelum ada peringkat
- Pengolahan Limbah CabeDokumen15 halamanPengolahan Limbah CabeNur MukhlisaBelum ada peringkat
- X - Kimia - KD 3.5 - FinalDokumen33 halamanX - Kimia - KD 3.5 - FinalYuliansyah DharmaputraBelum ada peringkat
- PolarimeterDokumen8 halamanPolarimeterNur MukhlisaBelum ada peringkat
- Nur Mukhlisa - 1913041024 - PPD Tugas ProyekDokumen4 halamanNur Mukhlisa - 1913041024 - PPD Tugas ProyekNur MukhlisaBelum ada peringkat
- KLP 10 Kwu - Hasil SwotDokumen10 halamanKLP 10 Kwu - Hasil SwotNur MukhlisaBelum ada peringkat
- Kelompok 1 - Kimdas-2Dokumen17 halamanKelompok 1 - Kimdas-2Nur MukhlisaBelum ada peringkat
- Pengaruh Wisata Jene'tallasa Sileo dalam Peningkatan Ekonomi UMKMDokumen38 halamanPengaruh Wisata Jene'tallasa Sileo dalam Peningkatan Ekonomi UMKMNur MukhlisaBelum ada peringkat
- MANFAAT PENGHIJAUAN DAN PROSES KIMIADokumen14 halamanMANFAAT PENGHIJAUAN DAN PROSES KIMIANur MukhlisaBelum ada peringkat
- Penentuan Golongan & Periode Mekanika Kuantum Kimia DasarDokumen20 halamanPenentuan Golongan & Periode Mekanika Kuantum Kimia DasarNur MukhlisaBelum ada peringkat
- Pengolaha N Limbah CabeDokumen9 halamanPengolaha N Limbah CabeNur MukhlisaBelum ada peringkat
- Kelompok 1 - KimdasDokumen16 halamanKelompok 1 - KimdasNur MukhlisaBelum ada peringkat
- DRAF ASISTENSI KIMDAS FDokumen7 halamanDRAF ASISTENSI KIMDAS FNur MukhlisaBelum ada peringkat
- Teori Belajar Gagne KLP 8Dokumen11 halamanTeori Belajar Gagne KLP 8Nur MukhlisaBelum ada peringkat
- Kimia LingkunganDokumen8 halamanKimia LingkunganNur MukhlisaBelum ada peringkat
- Bab 3Dokumen27 halamanBab 3Nur MukhlisaBelum ada peringkat
- Kelompok Kinestetik - Masalah Remaja Dalam PembelajaranDokumen9 halamanKelompok Kinestetik - Masalah Remaja Dalam PembelajaranNur MukhlisaBelum ada peringkat
- BISMILLAH (Repaired)Dokumen32 halamanBISMILLAH (Repaired)Nur MukhlisaBelum ada peringkat
- Mata Kuliah Free FormDokumen2 halamanMata Kuliah Free FormNur MukhlisaBelum ada peringkat
- Danial Materi Ajar Ke 2 Metodologi Penelitian Kimia S1Dokumen30 halamanDanial Materi Ajar Ke 2 Metodologi Penelitian Kimia S1Nur MukhlisaBelum ada peringkat
- Nur Mukhlisa - 1913041024 - Tugas 1 Strategi Dan Metode Pemb. KimiaDokumen3 halamanNur Mukhlisa - 1913041024 - Tugas 1 Strategi Dan Metode Pemb. KimiaNur MukhlisaBelum ada peringkat
- Proposal PenelitianDokumen24 halamanProposal PenelitianNur MukhlisaBelum ada peringkat
- Analisis Dampak Lingkungan ProyekDokumen10 halamanAnalisis Dampak Lingkungan ProyekNur MukhlisaBelum ada peringkat
- Marketplace Obat HerbalDokumen12 halamanMarketplace Obat HerbalNur MukhlisaBelum ada peringkat
- Bab 4 & 5.docx RevisiDokumen11 halamanBab 4 & 5.docx RevisiNur MukhlisaBelum ada peringkat
- Media Pembelajaran Redoks dalamDokumen2 halamanMedia Pembelajaran Redoks dalamNur MukhlisaBelum ada peringkat