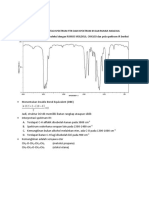
Aturan Penulisan Konfigurasi Elektron
Diunggah oleh
Afrina Dearny DamanikHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Aturan Penulisan Konfigurasi Elektron
Diunggah oleh
Afrina Dearny DamanikHak Cipta:
Format Tersedia
Aturan Penulisan Konfigurasi Elektron
Konfigurasi elektron merupakan susunan elektron dalam atom berdasarkan tingkatan
energi atau kulit. Terdapat dua macam metode konfigurasi elektron yaitu berdasarkan medel
atom Bohr dan berdasarkan model atom mekanika kuantum.
Konfigurasi elektron berdasarkan model atom Bohr
Untuk menentukan konfigurasi elektron suatu unsur, ada beberapa patokan yang harus selalu
diingat, yaitu:
a. Dimulai dari lintasan yang terdekat dengan inti, masing-masing lintasan
disebut kulit ke-1 (kulit K), kulit ke-2 (kulit L), kulit ke-3 (kulit M),
kulit ke-4 (kulit N), dan seterusnya.
b. Jumlah elektron maksimum (paling banyak) yang dapat menempati
masing-masing kulit adalah: 2n2 dimana n = jumlah kulit. Kulit K dapat menampung
maksimal 2 elektron. Kulit L dapat menampung maksimal 8 elektron. Kulit M dapat
menampung maksimal 18 elektron, dan seterusnya.
c. Kulit yang paling luar hanya boleh mengandung maksimal 8 elektron. Jumlah
elektron yang menempati kulit terluar disebut sebagai elektron valensi. Dengan
menuliskan konfigurasi elektron suatu atom kita dapat menentukan :
1. Elektron valensi dari suatu atom
2. Golongan dan periode suatu unsur dalam Sistem Periodik Unsur
3. Sifat logam dan non logam dari suatu unsur
Konfigurasi elektron berdasarkan Niels Bohr hanya dapat digunakan untuk
menentukan letak unsur golongan A dalam SPU, sedangkan untuk golongan B ada aturan
tersendiri (mekanika kuantum).
Konfigurasi Elektron Berdasarkan Model Atom Mekanika Kuantum
Pada penulisan konfigurasi elektron perlu dipertimbangkan tiga aturan (asas), yaitu
prinsip Aufbau, asas larangan Pauli, dan kaidah Hund.
1. Prinsip Aufbau
Berdasarkan prinsip Aufbau, elektron-elektron dalam suatu atom berusaha untuk
menempati subkulit subkulit yang berenergi rendah, kemudian baru ke tingkat energi yang
lebih tinggi. Dengan demikian, atom berada pada tingkat energi minimum.
Urutan-urutan tingkat energi ditunjukkan pada gambar. Jadi, pengisian orbital dimulai
dari orbital 1s, 2s, 2p, dan seterusnya. Pada gambar dapat dilihat bahwa subkulit 3d
mempunyai energi lebih tinggi daripada subkulit 4s. Oleh karena itu, setelah 3p terisi penuh
maka elektron berikutnya akan mengisi subkulit 4s, baru kemudian akan mengisi subkulit 3d.
Diagram urutan tingkat energi orbital
2. Kaidah Hund
Untuk menyatakan distribusi elektron-elektron pada orbital-orbital dalam suatu
subkulit, konfigurasi elektron dapat dituliskan dalam bentuk diagram orbital. Suatu orbital
dilambangkan dengan strip, sedangkan dua elektron yang menghuni satu orbital
dilambangkan dengan dua anak panah yang berlawanan arah.
Jika orbital hanya mengandung satu elektron, anak panah dituliskan mengarah ke atas.
Dalam kaidah Hund, dikemukakan oleh Friedrich Hund (1894 1968) pada tahun 1930,
disebutkan bahwa elektron-elektron dalam orbital-orbital suatu subkulit cenderung untuk
tidak berpasangan. Elektron-elektron baru berpasangan apabila pada subkulit itu sudah tidak
ada lagi orbital kosong.
Pengisian orbital dalam suatu atom
Subkulit yang dilambangkan dengan strip sebanyak orbital yang dimiliki
3. Larangan Pauli
Pada tahun 1928, Wolfgang Pauli (1900 1958) mengemukakan bahwa tidak ada
dua elektron dalam satu atom yang boleh mempunyai keempat bilangan kuantum yang sama.
Dua elektron yang mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama
dalam satu orbital, harus mempunyai spin yang berbeda. Kedua elektron tersebut
berpasangan.
Setiap orbital mampu menampung maksimum dua elektron. Untuk mengimbangi gaya
tolak-menolak di antara elektron-elektron tersebut, dua elektron dalam satu orbital selalu
berotasi dalam arah yang berlawanan.
Subkulit s (1 orbital) maksimum 2 elektron
Subkulit p (3 orbital) maksimum 6 elektron
Subkulit d (5 orbital) maksimum 10 elektron
Subkulit f (7 orbital) maksimum 14 elektron
Penyederhanaan Penulisan Konfigurasi Elektron
Penulisan konfigurasi elektron dapat disederhanakan dengan cara mengganti beberapa
subkulit dengan atom-atom gas mulia(golongan VIIIA):
Golongan VIIIA
He 1s2
Ne 1s2 2s2 2p6
Ar 1s2 2s2 2p6 3s2 3p6
dst.
Contoh :
Na, e =11 1s2 2s2 2p2 3s1 menjadi [Ne] 3s1
N, e =7 1s2 2s2 2p3 menjadi [He] 2s2 2p3
Anda mungkin juga menyukai
- Kunci Jawaban LKPD Babi FixDokumen7 halamanKunci Jawaban LKPD Babi FixYeskiel LinduBelum ada peringkat
- Konfigurasi Elektron, Diagram Orbital Serta Hubungannya Dengan Penentuan Letak Unsur Dan Sifat-Sifat Periodik UnsurDokumen8 halamanKonfigurasi Elektron, Diagram Orbital Serta Hubungannya Dengan Penentuan Letak Unsur Dan Sifat-Sifat Periodik UnsurWiji Dwi UtamiBelum ada peringkat
- LKPD KD 3.3 Peertemuan 1Dokumen4 halamanLKPD KD 3.3 Peertemuan 1Yulida erdaniBelum ada peringkat
- Konfigurasi ElektronDokumen21 halamanKonfigurasi ElektronGardenia LavennBelum ada peringkat
- Miskonsepsi - Two Tier - ElektrokimiaDokumen4 halamanMiskonsepsi - Two Tier - ElektrokimiafadilBelum ada peringkat
- LKPD Konfigurasi Aturan Dan OrbitalDokumen7 halamanLKPD Konfigurasi Aturan Dan OrbitalGarnis HakimBelum ada peringkat
- 8 Worksheet 2Dokumen11 halaman8 Worksheet 2smanBelum ada peringkat
- Soal Uh Kimia HidrokarbonDokumen1 halamanSoal Uh Kimia Hidrokarbonayu irsalinaBelum ada peringkat
- Diagram Tanabe-SuganoDokumen20 halamanDiagram Tanabe-SuganoDrupadiAnandaDewiBelum ada peringkat
- Aplikasi Persamaan SchrodingerDokumen10 halamanAplikasi Persamaan SchrodingerSulfiana UpiiBelum ada peringkat
- RPP Konfigurasi Elektron Hikma 3Dokumen27 halamanRPP Konfigurasi Elektron Hikma 3HikmaBelum ada peringkat
- Foto Berat Molekul Dan RekristalisasiDokumen56 halamanFoto Berat Molekul Dan Rekristalisasidedi saputraBelum ada peringkat
- Perkembangan Teori AtomDokumen17 halamanPerkembangan Teori AtomYulia RachmawatiBelum ada peringkat
- Projek StoikiometriDokumen46 halamanProjek StoikiometriChandra0% (1)
- HibridisasiDokumen7 halamanHibridisasiCitra OktasariBelum ada peringkat
- Soal Kimia Bab Elektrolit Dan Non Elektrolit Beserta Kunci JawabanDokumen5 halamanSoal Kimia Bab Elektrolit Dan Non Elektrolit Beserta Kunci JawabanHappy SoulBelum ada peringkat
- LKS Praktikum Kimia Kelas XDokumen4 halamanLKS Praktikum Kimia Kelas XYokoSimanjuntakBelum ada peringkat
- MRADokumen2 halamanMRAHaryadi AdityaBelum ada peringkat
- Penjelasan Pengecualian Aturan Oktet Dan Ikatan Ion PDFDokumen4 halamanPenjelasan Pengecualian Aturan Oktet Dan Ikatan Ion PDFyehuda pramanaBelum ada peringkat
- Soal 3Dokumen2 halamanSoal 3Amin SyamBelum ada peringkat
- Handout Bentuk MolekulDokumen6 halamanHandout Bentuk MolekulCakrayogi AmaliyBelum ada peringkat
- Makalah Alkali Kelompok 2Dokumen32 halamanMakalah Alkali Kelompok 2Fatimah AzzahraBelum ada peringkat
- LKPD KD 3.3Dokumen4 halamanLKPD KD 3.3ENdahHEkstaPurnamaDewiBelum ada peringkat
- Sifat Periodik UnsurDokumen20 halamanSifat Periodik Unsuryulina herawatiBelum ada peringkat
- LKM Listrik StatisDokumen5 halamanLKM Listrik StatisKadek PujaBelum ada peringkat
- Ruang Lingkup Kimia KineticDokumen11 halamanRuang Lingkup Kimia KineticarsitadevyBelum ada peringkat
- LKS Sistem Periodik UnsurDokumen7 halamanLKS Sistem Periodik UnsurMustika Aulia Adha100% (1)
- RPP Lks Evaluasi Penyetaraan Reaksi Redoks Dengan Setengah ReaksiDokumen6 halamanRPP Lks Evaluasi Penyetaraan Reaksi Redoks Dengan Setengah ReaksiAyu Puji LarasatiBelum ada peringkat
- Soal Rotasi Dan FluidaDokumen3 halamanSoal Rotasi Dan Fluidaburhanudin,S.PdBelum ada peringkat
- P 2 Tatanama Dan Gugus PelindungDokumen22 halamanP 2 Tatanama Dan Gugus Pelindungzilva karimahBelum ada peringkat
- Reaksi PenggaramanDokumen16 halamanReaksi PenggaramanFaZa Asy'SyirbanBelum ada peringkat
- Makalah Kel 2 - PSPK 20DDokumen11 halamanMakalah Kel 2 - PSPK 20DArfan SaragihBelum ada peringkat
- Soal Stoikiometri Kel 2Dokumen9 halamanSoal Stoikiometri Kel 2Daniel SitorusBelum ada peringkat
- Tabel Kandungan Senyawa Kimia Dalam Air Sungai Dan Air LautDokumen2 halamanTabel Kandungan Senyawa Kimia Dalam Air Sungai Dan Air LautedwinBelum ada peringkat
- ELEKTROKIMIADokumen34 halamanELEKTROKIMIASri SuhartiniBelum ada peringkat
- Soal Ikatan KimiaDokumen4 halamanSoal Ikatan KimiaIsni ChanBelum ada peringkat
- Utbk Kimia - MatDokumen76 halamanUtbk Kimia - MatYayu sri rahayuBelum ada peringkat
- Lembar Kerja Siswa TitrasiDokumen1 halamanLembar Kerja Siswa TitrasiSubainar MarantikaBelum ada peringkat
- STG - Teori Grup Dan Struktur Senyawa AnorganikDokumen68 halamanSTG - Teori Grup Dan Struktur Senyawa AnorganikHanifah RustamajiBelum ada peringkat
- Laporan Praktikum KimiaDokumen7 halamanLaporan Praktikum KimiaamaliazafitriBelum ada peringkat
- IRtasionmDokumen2 halamanIRtasionmZayn Fatahillah RBelum ada peringkat
- 7-Karakterisasi Katalis PDFDokumen30 halaman7-Karakterisasi Katalis PDFKhairatun NisaBelum ada peringkat
- Bank Soal UN Kimia SKL Asam Basa PenyanggaDokumen8 halamanBank Soal UN Kimia SKL Asam Basa PenyanggaEchi HutapeaBelum ada peringkat
- Bab 5 - Rumus Kimia, Tata Nama, Persamaan Reaksi, Dan Hukum Dasar KimiaDokumen27 halamanBab 5 - Rumus Kimia, Tata Nama, Persamaan Reaksi, Dan Hukum Dasar KimiaEdi SaputraBelum ada peringkat
- Hukum Perbandingan BergandaDokumen14 halamanHukum Perbandingan Bergandaismiatul zaroh0% (1)
- Asam BasaDokumen46 halamanAsam BasaRpdjaBelum ada peringkat
- Kisi-Kisi SoalDokumen4 halamanKisi-Kisi SoalAnonymous hlzXhwBelum ada peringkat
- Soal Non ElektrolitDokumen13 halamanSoal Non ElektrolitinesBelum ada peringkat
- 02 - Aida Maghfiroh - Poster Laju ReaksiDokumen1 halaman02 - Aida Maghfiroh - Poster Laju ReaksiAida MaghfirohBelum ada peringkat
- KorosiDokumen19 halamanKorosiPramudiaRocketBelum ada peringkat
- Soal Dan Jawaban HidrolisisDokumen5 halamanSoal Dan Jawaban Hidrolisiscahya larasatiBelum ada peringkat
- Contoh Prediksi Soal UN Kimia SMADokumen3 halamanContoh Prediksi Soal UN Kimia SMASandy HermawanBelum ada peringkat
- Lecture-2 (w#4)Dokumen18 halamanLecture-2 (w#4)nia veronikaBelum ada peringkat
- Redoks Dan StoikiometriDokumen41 halamanRedoks Dan Stoikiometri30 Nathaniel SitumorangBelum ada peringkat
- LKPD Konsep Mol FiksDokumen32 halamanLKPD Konsep Mol FiksDeasy Kania RakhmawatiBelum ada peringkat
- Proyek Pembuatan Elektrolit TesterDokumen7 halamanProyek Pembuatan Elektrolit TestermumundhBelum ada peringkat
- Kunci TekRek - Kimia 10Dokumen64 halamanKunci TekRek - Kimia 10Khoironi IqbalBelum ada peringkat
- Model Atom Niels Bohr Dan Konfigurasi ElektronDokumen23 halamanModel Atom Niels Bohr Dan Konfigurasi ElektronBayu Wisnu SaputroBelum ada peringkat
- Bahan Ajar Konfigurasi Elektron KD 3.3 Dan 4.3Dokumen5 halamanBahan Ajar Konfigurasi Elektron KD 3.3 Dan 4.348Hamada Odistia NakedaBelum ada peringkat
- Tugas 2 Tuton Pefi4421 Fisika Atom 14.2Dokumen4 halamanTugas 2 Tuton Pefi4421 Fisika Atom 14.2CVLKBelum ada peringkat
- 42 1 81 1 10 20160818 PDFDokumen11 halaman42 1 81 1 10 20160818 PDFAfrina Dearny DamanikBelum ada peringkat
- Uts No 3 4Dokumen2 halamanUts No 3 4Afrina Dearny DamanikBelum ada peringkat
- Mid Semester Pendahuluan Fisika IntiDokumen5 halamanMid Semester Pendahuluan Fisika IntiAfrina Dearny DamanikBelum ada peringkat
- Bahan AcakDokumen4 halamanBahan AcakAfrina Dearny DamanikBelum ada peringkat
- Analisis SwotDokumen1 halamanAnalisis SwotAfrina Dearny DamanikBelum ada peringkat
- Tata SuryaDokumen12 halamanTata Suryaade luthfiyaBelum ada peringkat
- Roster Partonggoan 2019Dokumen1 halamanRoster Partonggoan 2019Afrina Dearny DamanikBelum ada peringkat
- Pertanyaan Agnes Fisika IntiDokumen3 halamanPertanyaan Agnes Fisika IntiAfrina Dearny DamanikBelum ada peringkat
- Daftar IsiDokumen1 halamanDaftar IsiAfrina Dearny DamanikBelum ada peringkat
- Daftar TabelDokumen7 halamanDaftar TabelAfrina Dearny DamanikBelum ada peringkat
- Peluruhan RadioaktivitasDokumen20 halamanPeluruhan RadioaktivitasAfrina Dearny DamanikBelum ada peringkat
- Daftar TabelDokumen7 halamanDaftar TabelAfrina Dearny DamanikBelum ada peringkat
- Daftar TabelDokumen1 halamanDaftar TabelAfrina Dearny DamanikBelum ada peringkat
- Liturgi IIDokumen2 halamanLiturgi IIcintia agnesBelum ada peringkat
- Tata Ibadah Perayaan Natal Pemuda GKPS SemayangDokumen4 halamanTata Ibadah Perayaan Natal Pemuda GKPS SemayangAfrina Dearny Damanik100% (1)
- Daftar IsiDokumen1 halamanDaftar IsiAfrina Dearny DamanikBelum ada peringkat
- Liturgi IIDokumen6 halamanLiturgi IIAfrina Dearny DamanikBelum ada peringkat
- Liturgi Ke IIIDokumen2 halamanLiturgi Ke IIIAfrina Dearny DamanikBelum ada peringkat
- RPP Kwu SMK Kelas XIaIDokumen4 halamanRPP Kwu SMK Kelas XIaIAfrina Dearny DamanikBelum ada peringkat
- Liturgi IIDokumen2 halamanLiturgi IIcintia agnesBelum ada peringkat
- Liturgi IIDokumen6 halamanLiturgi IIAfrina Dearny DamanikBelum ada peringkat
- Tertib Acara Natal SM SEmayang 2015Dokumen6 halamanTertib Acara Natal SM SEmayang 2015Afrina Dearny DamanikBelum ada peringkat
- Liturgi IIDokumen2 halamanLiturgi IIcintia agnesBelum ada peringkat
- Tata Ibadah Natal Pemuda 2016Dokumen8 halamanTata Ibadah Natal Pemuda 2016Afrina Dearny DamanikBelum ada peringkat
- Soal Mata Kuliah Manajemen DataDokumen3 halamanSoal Mata Kuliah Manajemen DataAfrina Dearny DamanikBelum ada peringkat
- Lembar Kerja Mahasiswa Fakultas Matematika Dan Ilmu Pengetahuan Alamunimed Jurusan/Prodi Mata Kuliah: Semester KelasDokumen2 halamanLembar Kerja Mahasiswa Fakultas Matematika Dan Ilmu Pengetahuan Alamunimed Jurusan/Prodi Mata Kuliah: Semester KelasAfrina Dearny DamanikBelum ada peringkat
- Soal Mata Kuliah Manajemen DataDokumen1 halamanSoal Mata Kuliah Manajemen DataAfrina Dearny DamanikBelum ada peringkat
- RPP Kwu SMK Kelas XIIDokumen17 halamanRPP Kwu SMK Kelas XIIPaino Si PetualangBelum ada peringkat
- Soal Mata Kuliah Manajemen DataDokumen3 halamanSoal Mata Kuliah Manajemen DataAfrina Dearny DamanikBelum ada peringkat
- Bab I PendahuluanDokumen7 halamanBab I PendahuluanAfrina Dearny DamanikBelum ada peringkat