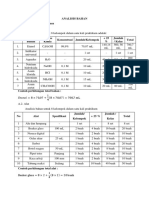
Bilangan Oksidasi
Diunggah oleh
yunitaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Bilangan Oksidasi
Diunggah oleh
yunitaHak Cipta:
Format Tersedia
Bilangan oksidasi ( biloks) disebut juga tingkat oksidasi.
Bilangan oksidasi diartikan sebagai
muatan yang dimiliki suatu atom dalam keadaan bebas atau dalam senyawa yang dibentuknya.
Bilangan oksidasi suatu unsur dapat ditentukan dengan aturan berikut:
1. Biloks atom dalam unsur adalah nol
Contoh Na, Fe, O2 , H2 memiliki biloks nol
2. Total biloks senyawa adalah nol
Contoh H2O, NaOH, CH3COOH, KNO3 total biloksnya adalah nol
3. Biloks ion sesuai dengan muatannya
Contoh Na +1 ( = +1), O -2 ( = -2), Fe +3 (= +3)
4. Biloks unsur golongan I A dalam senyawanya adalah + 1
Contoh Biloks atom Na dalam NaCl adalah + 1
5. Biloks unsur golongan II A dalam senyawanya adalah + 2
Contoh: Biloks Ca dalam CaCO3 adalah + 2
6. Biloks unsur golongan VII A dalam senyawa binernya adalah – 1
Contoh: Biloks F dalam senyawa KF dan BaF2 adalah – 1
7. Biloks unsur oksigen dalam senyawanya adalah – 2
Contoh dalam H2O, Na2O, Al2O3
8. Biloks unsur hydrogen dalam senyawanya adalah + 1
Contoh dalam H2O, HCl, H2SO4
Catatan Penting:
Biloks H = -1 dalam senyawa hidrida misal NaH, LiH, CaH2
Biloks O = -1 dalam senyawa peroksida misal H2O2
Silahkan selesaikan soal berikut ini!
Tentukan Biloks unsur yang digarisbawahi di bawah ini
1. HNO3
2. KMnO4
3. H2SO4
4. SrCO3
5. KClO2
6. NH4 +
7. CaC2O4
8. CH3OH
9. PO4 -3
10. Cu(NO3)2
11. CrCl3
12. Mn(OH)2
13. Co2(SO3)3
14. P2O5
15. CH3ONa
C. OKSIDATOR DAN REDUKTOR
Oksidator adalah istilah untuk zat yang mengalami reduksi (biloksnya turun), sedangkan
Reduktor adalah zat yang mengalami reaksi oksidasi (biloksnya naik/bertambah).
Contoh:
Pada reaksi 2Na + 2H2O → 2NaOH + H2
Reduktor adalah Na sebab biloksnya naik dari 0 ke +1
Oksidator adalah H2O sebab biloks H berubah dari +1 ke 0
Selesaikan soal berikut ini!
1. Tentukan termasuk oksidasi atau reduksi
→ I
a. IO3 - 2
b. Cl → ClO
2
–
c. AsO → AsH 3
3-
3
d. Cr → CrO
2+
4
-2
e. C O → CO
2 4
-2
2
2. Tentukan oksidator dan reduktor dari persamaan reaksi berikut
a. Sn + SnCl4 → 2 SnCl 2
b. Zn + 2HCl → ZnCl + H 2 2
c. 2KI + Cl → 2KCl + I 2 2
d. CO + 2NaOH → Na CO + H O
2 2 3 2
e. MnO + 4HBr → MnBr + 2H O + Br
2 2 2 2
f. 2KMnO + 5H C O + 3H SO →K SO + 2MnSO + 10 CO + 8 H O
4 2 2 4 2 4 2 4 4 2 2
g. Fe O + HCl → FeCl + H O
2 3 3 2
D. TATA NAMA SENYAWA
Senyawa biner adalah senyawa yang dibentuk oleh dua macam unsur, dapat terdiri ataslogam
dan non logam atau keduanya non logam. Untuk senyawa yang terdiri atas logam dan non
logam, maka unsur logam dituliskan terlebih dahulu diikuti dengan non logam.
Untuk unsur-unsur logam yang mempunyai lebih dari satu macam bilangan oksidasi diberi
nama berdasarkan system Stock, yaitu dengan membubuhkan angka Romawi yang sesuai dengan
bilangan oksidasi unsure logam dalam tanda kurung dibelakang nama logam dan diikuti nama
unsure non logam dengan akhiran ida.
Contoh:
FeCl2 besi(II)klorida
FeCl3 besi(III)klorida
Cu2O tembaga(I)oksida
CuO tembaga(II)oksida
SnCl2 timah(II)klorida
SnCl4 timah(IV)klorida
Latihan: Tuliskan rumus senyawa berikut
1. besi(II)sulfida
2. raksa(I)klorida
3. timah(IV)nitrat
4. kobal(III)karbonat
5. titan(IV)oksida
6. raksa(II)sulfat
7. mangan(II)hidroksida
8. besi(III)fosfat
Anda mungkin juga menyukai
- Reaksi Oksidasi ReduksiDokumen19 halamanReaksi Oksidasi ReduksiIkaYektiLianaSariBelum ada peringkat
- REAKSI REDOKSDokumen22 halamanREAKSI REDOKSmeri mustikasariBelum ada peringkat
- Penyetaraan Reaksi RedoksDokumen34 halamanPenyetaraan Reaksi RedoksAtikah Wulandari- 05-X MIPA 8Belum ada peringkat
- Tugas ReduksiDokumen8 halamanTugas ReduksiMelati Mayang SariBelum ada peringkat
- Soal Penyetaraan RedoksDokumen2 halamanSoal Penyetaraan RedoksMan Of CultureBelum ada peringkat
- Tugas KimiaDokumen2 halamanTugas Kimiawini primadiantiBelum ada peringkat
- Kimia Bab 17 19Dokumen18 halamanKimia Bab 17 19fildzah adanyBelum ada peringkat
- Reaksi RedoksDokumen22 halamanReaksi RedoksJulian KrisyairazyBelum ada peringkat
- BAB 2 REDOKS & ELEKTROKIMIA Rev 2018-1Dokumen28 halamanBAB 2 REDOKS & ELEKTROKIMIA Rev 2018-1Deadly BladeBelum ada peringkat
- Soal RedoksDokumen17 halamanSoal RedoksDevi Amiratul AsviaBelum ada peringkat
- REAKSI REDOKS DAN ELEKTROKIMIADokumen5 halamanREAKSI REDOKS DAN ELEKTROKIMIARias TyasBelum ada peringkat
- Menentukan BiloksDokumen2 halamanMenentukan BiloksFira SukmagustinBelum ada peringkat
- RedoksDokumen4 halamanRedoksTyaFattyaBelum ada peringkat
- Redoks Oksidasi RedoksDokumen20 halamanRedoks Oksidasi Redoksrun muffinBelum ada peringkat
- UH Redoks ElektrokimiaDokumen3 halamanUH Redoks ElektrokimiaAkhmad FaridBelum ada peringkat
- RedoksDokumen20 halamanRedokssetyawardanaBelum ada peringkat
- Redoks-Ppt 1Dokumen20 halamanRedoks-Ppt 1artha merianaBelum ada peringkat
- Soal Ulangan Redoks Dan Tata NamaDokumen4 halamanSoal Ulangan Redoks Dan Tata NamaLdee 078Belum ada peringkat
- SOAL REDOKS DAN TATANAMDokumen4 halamanSOAL REDOKS DAN TATANAMYuarina HadiBelum ada peringkat
- Bab 1. Reaksi Reduksi & OksidasiDokumen10 halamanBab 1. Reaksi Reduksi & OksidasiArif FuadiBelum ada peringkat
- Reduksioksidasi_redoks_pptDokumen20 halamanReduksioksidasi_redoks_pptavinashsatriavvBelum ada peringkat
- Redoks_dan_ElektrokimiaDokumen47 halamanRedoks_dan_ElektrokimiaavinashsatriavvBelum ada peringkat
- Bahanajar 1626330455Dokumen6 halamanBahanajar 1626330455Fillia Dzikri RahmadaniBelum ada peringkat
- REDOKSDokumen17 halamanREDOKSSofie MellyBelum ada peringkat
- BHN Ajar Redoks OkeDokumen23 halamanBHN Ajar Redoks OkeethanBelum ada peringkat
- Uji Kemamuan RedoksDokumen3 halamanUji Kemamuan RedoksMuhammad Mufti100% (1)
- Reaksi Redoks Dan Sel ElektrokimiaDokumen57 halamanReaksi Redoks Dan Sel ElektrokimiaVicky raihan akbar 068Belum ada peringkat
- Ulangan RedoksDokumen4 halamanUlangan RedoksevavatonahgmailcomBelum ada peringkat
- ELEKTOKIMIADokumen17 halamanELEKTOKIMIARizky MuslimBelum ada peringkat
- Redoks 40Dokumen25 halamanRedoks 40Jeffrey RamosBelum ada peringkat
- Latsol Redoks 10hexaDokumen4 halamanLatsol Redoks 10hexazfaulisaBelum ada peringkat
- Latsol Reaksi Reduksi-Oksidasi Kelas 10Dokumen3 halamanLatsol Reaksi Reduksi-Oksidasi Kelas 10Muhammad FaizBelum ada peringkat
- Soal Kimia RedoksDokumen4 halamanSoal Kimia Redoksoki2193Belum ada peringkat
- Soal Kimia RedoksDokumen4 halamanSoal Kimia Redoksoki2193Belum ada peringkat
- REAKSI REDOKS DAN TATA NAMADokumen6 halamanREAKSI REDOKS DAN TATA NAMAHikmatul FithryBelum ada peringkat
- REAKSI REDOKS DAN PENENTUAN BILANGAN OKSIDASIDokumen17 halamanREAKSI REDOKS DAN PENENTUAN BILANGAN OKSIDASIStefan RumenganBelum ada peringkat
- Modul RedoksDokumen6 halamanModul RedoksFaridatur Rofi'ahBelum ada peringkat
- Akn RedoksDokumen32 halamanAkn RedoksandickBelum ada peringkat
- Reaksi OksidasiDokumen10 halamanReaksi OksidasiAnisa Nurhuda UtamiBelum ada peringkat
- TJ Redoks Dan ElektrokimiaDokumen66 halamanTJ Redoks Dan ElektrokimiaRikardo SitohangBelum ada peringkat
- Bahan Ajar Redoks Dan ElektrokimiaDokumen6 halamanBahan Ajar Redoks Dan ElektrokimiaBimbel Briliant100% (1)
- REDOKSDokumen8 halamanREDOKSGloria SagitaBelum ada peringkat
- RedoksDokumen86 halamanRedoksAhmad Fauzi Bin SukardiBelum ada peringkat
- Soal Kimia Ulangan Harian Redoks Kelas 10Dokumen2 halamanSoal Kimia Ulangan Harian Redoks Kelas 10badrun arrizkiBelum ada peringkat
- Edit Soal KimiaDokumen3 halamanEdit Soal KimiaNazhif SyafiqBelum ada peringkat
- KD 1 Redoks Dan PenyetaraanDokumen6 halamanKD 1 Redoks Dan Penyetaraanubaii dillaBelum ada peringkat
- KIM 12 - Redoks Dan ElektrokimiaDokumen6 halamanKIM 12 - Redoks Dan Elektrokimiaditanur fadilahBelum ada peringkat
- A. Redok Dan Elektrokimia 300911 PowerpointDokumen51 halamanA. Redok Dan Elektrokimia 300911 Powerpointkrndaa022Belum ada peringkat
- Soal Ulangan Redoks Dan Tatanama Kelas XDokumen2 halamanSoal Ulangan Redoks Dan Tatanama Kelas XIsti SitepuBelum ada peringkat
- KD 1 Redoks Dan Penyetaraan - MASUDIDokumen4 halamanKD 1 Redoks Dan Penyetaraan - MASUDIHelmi Rizky FauzanBelum ada peringkat
- LATIHAN SOAL KIMIA KELAS X (Redoks SD PRK)Dokumen3 halamanLATIHAN SOAL KIMIA KELAS X (Redoks SD PRK)alfiraBelum ada peringkat
- Konsep Reaksi Redoks Dan Biloks (Review Materi Kelas 10)Dokumen40 halamanKonsep Reaksi Redoks Dan Biloks (Review Materi Kelas 10)BuyungPranajayaBelum ada peringkat
- REAKSI OKSIDASI DAN REDUKSIDokumen7 halamanREAKSI OKSIDASI DAN REDUKSIChusnul KhotimahBelum ada peringkat
- LKPD Reaksi Redoks 1Dokumen3 halamanLKPD Reaksi Redoks 1Muhammad AndriBelum ada peringkat
- 10 Alazhar Larutan Elektrolit Dan Redoks MIDDokumen2 halaman10 Alazhar Larutan Elektrolit Dan Redoks MIDRiky GunawanBelum ada peringkat
- REAKSI REDOKSIDokumen5 halamanREAKSI REDOKSIRiri TamiBelum ada peringkat
- DAYA HANTAR LISTRIKDokumen29 halamanDAYA HANTAR LISTRIKEkanisaKurniawatiBelum ada peringkat
- Contoh Surat LamaranDokumen9 halamanContoh Surat LamaranYanti AeBelum ada peringkat
- Tanin LumayanDokumen8 halamanTanin LumayanNenden GoodlightBelum ada peringkat
- Uji Antosianin-Kelopak RosellaDokumen10 halamanUji Antosianin-Kelopak RosellaSukmiyati AgustinBelum ada peringkat
- Contoh Surat LamaranDokumen9 halamanContoh Surat LamaranYanti AeBelum ada peringkat
- Contoh Surat LamaranDokumen9 halamanContoh Surat LamaranYanti AeBelum ada peringkat
- DAYA HANTAR LISTRIKDokumen29 halamanDAYA HANTAR LISTRIKEkanisaKurniawatiBelum ada peringkat
- DAYA HANTAR LISTRIKDokumen29 halamanDAYA HANTAR LISTRIKEkanisaKurniawatiBelum ada peringkat
- Tanin LumayanDokumen8 halamanTanin LumayanNenden GoodlightBelum ada peringkat
- PepatahDokumen1 halamanPepatahyunitaBelum ada peringkat
- Tanin LumayanDokumen8 halamanTanin LumayanNenden GoodlightBelum ada peringkat
- Uji PBDokumen4 halamanUji PBAgung GpBelum ada peringkat
- Jurnal Tugas PemisahanDokumen7 halamanJurnal Tugas PemisahanSyifa FauziyahBelum ada peringkat
- Puisi RomanceDokumen1 halamanPuisi Romancepipit1310Belum ada peringkat
- PepatahDokumen1 halamanPepatahyunitaBelum ada peringkat
- Puisi RomanceDokumen1 halamanPuisi Romancepipit1310Belum ada peringkat
- PDFDokumen19 halamanPDFNine mahardika sariBelum ada peringkat
- Bilangan OksidasiDokumen3 halamanBilangan OksidasiyunitaBelum ada peringkat
- 160 212 1 CeDokumen5 halaman160 212 1 CeWira SitorusBelum ada peringkat
- Analisis Logam Berat PB Dan CD Dalam Sampel Ikan Dan KerangDokumen4 halamanAnalisis Logam Berat PB Dan CD Dalam Sampel Ikan Dan KerangTyas D AriniBelum ada peringkat
- Tutur Kata Yang MenikamDokumen1 halamanTutur Kata Yang MenikamyunitaBelum ada peringkat
- Daftar PustakaDokumen7 halamanDaftar PustakayunitaBelum ada peringkat
- Bilangan OksidasiDokumen3 halamanBilangan OksidasiyunitaBelum ada peringkat
- Analisis BahanDokumen2 halamanAnalisis BahanyunitaBelum ada peringkat
- Pertanyaan PersentaseDokumen3 halamanPertanyaan PersentaseyunitaBelum ada peringkat
- Moti VasiDokumen16 halamanMoti VasiyunitaBelum ada peringkat
- 160 211 1 SMDokumen75 halaman160 211 1 SMyunitaBelum ada peringkat
- Bilangan OksidasiDokumen3 halamanBilangan OksidasiyunitaBelum ada peringkat
- Capaian PembelajaranDokumen20 halamanCapaian PembelajaranyunitaBelum ada peringkat