Termokimia 20
Diunggah oleh
Zakwan AlthofJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Termokimia 20
Diunggah oleh
Zakwan AlthofHak Cipta:
Format Tersedia
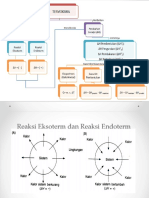
TERMOKIMIA
35
ALAM SEMESTA
SISTEM
LINGKUNGAN KEADAAN
SEKELILING DARI SISTEM
PERPINDAHAN ENERGI DAPAT BERUPA:
KALOR (Q)
KERJA (W)
Energi dalam (E)
Kerja (W)
Kerja dibentuk ketika suatu gaya bekerja melalui suatu jarak, banyaknya kerja,
wyaitu hasil kali antara gaya dan jarak
Satuan SI === Joule (J) = 1 Kg M S-2
KALOR (Q)
Energi yang dipindahkan karena perbedaan suhu
Energi sebagai kalor mengalir dari benda lebih panas(suhu tinggi) ke benda yang
lebih dingin(suhu lebih rendah)
Hal ini berarti bagi molekul molekul dari bagian yang lebih panas kehilangan energi
kinetiknya dan berpindah ke bagian yang lebih dingin ketika kedua bagaian tersebut
bersentuhan, akibatnya energi kinetik rata rata dari molekul dan dari benda yang
lebih panas menurun dapat dikatakan suhunya menurun dan dari benda yang dingin
suhunya meningkat. Disisni dapat dikatakan bahwa benda tersebut berisi energi ,
tetapi tidak berisi kalor. Kalor menjelaskan energi yang berpindah melintasi batas
sistem dan lingkungan
Kapasitas kalor: banyaknya energi kalor yang dibutuhkan untuk meningkatkan
suhu zat 1oC
Kapasitas kalor spesifik/kalor jenis : Banyaknya energi kalor yang dibutuhkan
untuk meningkatkan suhu 1 gram zat
sebesar 1oC
Kalor jenis molar : Banyaknya energi kalor yang dibutuhkan untuk meningkatkan
suhu 1 mol zat sebesar 1oC
Satuan kalori(kal): Banyaknya energi kalor yang dibutuhkan untuk meningkatkan36
suhu 1 gram air dari 14,5 oC menjadi
15,5oC
1 kal .= 4,184 joule
Banyaknya kalor=Q = massa zat x kalorjenis x perubahan suhu
Kapasitas kalor(Cp) x ∆T
Q = Cp∆T
∆T = Tf - Ti = ( suhu akhir – suhu awal)
∆T>0 (positif)= kalor diserap atau diperoleh ketika zat meningkat
∆T<0 (negatif)= kalor dilepas atau hilang ketika zat didinginkan
*/ berapakah kalor yang diperlukan untuk meningkatkan suhu 735 g air dari 21 menjadi
98oC dimana Kalor jenis air 1 kal/goC
Q = m x kj x ∆T =735 g x 1 kal/goCx (98-21) oC = 5,6 x10 4 kal
Dalam perhitungan energi kalor adalah hukum kekekalan energi ; dalam berinteraksi
antara zat zat, energi total tetap konstan atau energi yang dilepas = energi yang diterima
T=22,0oC
termometer
Timbal 150 gr
Air T=28,8 oC
air
(1) (2) penyekat
(3)
*(1) 150 g timbal pada suhu air mendidih 100 C o
*(2) 50 g air pada wadah yang diisolasi pada suhu 22oC
*(3) Campuran akhir timbal-air pada suhu 28,8oC
Q timbal + Q air = 0
energi yang dilepas = energi yang diterima
Q timbal = - Q air
Brp kalor jenis timbal =?
Q timbal = - Q air 37
= - massa air x Kalor jenis air x ∆T
= - 50 gr air x 1 kal/g air oC x (28,8 -22) oC = - 340 kal
Q timbale = massa timbal x Kalor jenis timbal x ∆T
Kalor jenis timbal = -340 kal/massa timbal x ( 28,8-100) oC
= 1 kal/goC/150 g x (-71,2 oC)= -340 kal/-10680
= 0,032 kal/g timbal oC
KALOR REAKSI
C12H22O11(P) + 12O2(g) 12CO2(g) + 11 H2O(C) Q rxn = kalor reaksi
sukrosa
1,01 g
Suhu meningkat dari 24,92 oC menjadi 28,33 oC, kalorimetri berisi 980 g air dan
kapasitas kalor kalorimetri 785 J/ oC. Brp kah kalor pembakaran sukrosa dlm Kj/mol
Q rxn + Q air + Q kalorimeter =0
Q rxn = - ( Q air + Q kalorimeter )
= -[980 g x 4,184 J /g air oCx (28,33 -24,92) oC + 7 85 J/ oCx 3,42 oC=
= -1,67x104 J/1,01 gr=16,5 Kj/g sukrosa x342 g sukrosa/1 mol sukrosa
= 16,5 Kj/2953x10-3 mol
= -5,64 x103 KJ/mol
Kalor reaksi dapat ditentukan dengan alat bom kalorimeter, kalor yang dilepaskan dari
reaksi sebagian besar digunakan untuk meningkatkan suhu air di sekeliling bom,
sebagian untuk meningkatkan suhu bom, pengaduk dan bagian bagian dari kalorimeter
jadi kita memerlukan 3 macam kalor yaitu: -Q rxn , Q air dan Q kalorimeter
Dapat disimpulkan:
Q rxn + Q air + Q kalorimeter = 0
Q rxn = -( Q air + Q kalorimeter )
=-[(massa air x kalor air x perubahan suhu) + (kapasitas kalorimeter + perubahan
suhu)]
ENTALPI (H) DAN PERUBAHAN ENTALPI (∆ H )
Kondisi sitem mengacu pada keaadaan yang disebut fungsi keaadaan tidak dapat diukur
tetapi dapat didifinisikan dengan yang lain, misaL nya sistem tertentu mempunyainilai H
yang khas.
Keadaan 1 ∆H keadaan 2 -∆ H keadaan 1 38
_
C12H22O11(P) + 12O2(g) 12 CO2(g) + 11 H2O(C) ∆ H¯= -5,64x103 kJ/mol
Keadaan 1, keadaan 2,
Entalpi H1 Entalpi H2
Untuk reaksi: ∆ H = H2 – H1
∆ H < 0 energi dilepas ke kesekeliling ( Eksoterm)
∆ H > 0 energi diserap dari sekeliling ( Endoterm)
HUBUNGAN YANG MELIBATKAN ∆ H
1. ∆ H adalah bersifat ekstensif
_
½ N2(g) + ½ O2(g) NO(g) ∆ H¯= +90,37 kJ/mol
N2(g) + O2(g) 2NO(g) ∆ H¯= 2 x (+90,37 )kJ/mol
2. ∆ H berubah tanda Jika proses reaksi berlangsung sebaliknya
NO(g) ½ N2(g) + ½ O2(g) ∆ H¯= - 90,37 kJ/mol
3. . ∆ H Mengikuti hukum Hess
" Jika suatu proses dapat dianggap berlangsung dalam beberapa tahapan atau
tingkatan maka perubahan entalpi untuk seluruh proses dapat diperoleh dengan
menjumlahkan perubahan perubahan antalpi setiap tahap"
½ N2(g) + O2(g) NO2(g) ∆ H¯= ?
Diketahui: a. ½ N2(g) + ½ O2(g) NO(g) ∆ H¯= +90,37 kJ/mol
b. NO(g) + ½ O2(g) NO2(g) ∆ H¯= -56,52 kJ/mol
--------------------------------------------------------------------------------- +
½ N2(g) + O2(g) NO2(g) ∆H= (+90,37+(-56,52)
=33,85kJ/mol
#)CO (g) + ½ O2(g) CO2(g) ∆ H¯= ? (-282,97 kJ/mol)
Jika :
1/ C(grafit) + ½ O2(g) CO (g) ∆ H¯= -110,54 kJ/mol
2/ C(grafit) + O2(g) CO2(g) ∆ H¯= -393,51 kJ/mol
Reaksi 1 dibalik delta H berubah tanda, reaksi 2 tetap kemudian 1 dan 2 di jumlahkan
39
ENTALPI PEMBENTUKAN BAKU (∆ Hf ) o
Yaitu: Perbedaan entalpi antara satu mol suatu senyawa dalam keadaan bakunya
Entalpi untuk unsur unsur = 0 keadaan baku 298
Tabel nilai entalpi pembentukan baku
Zat ∆ Hfo;(kJ/mol)
CH4(g) - 74,85
C2H2(g) 226,73
C2H4(g) 52,30
C2H6(g) -84,68
C3H8(g) -103,85
CO(g) -110,54
CO2(g) -393,51
HCl (g) 92,30
H2O(g) -285,85
NH3(g) -46,19
NO(g) 90,37
SO2(g) -296,90
NO2(g) 33,85
Q rxn = [∑υp∆ Hfo(produk)] - [∑υr∆ Hfo(pereaksi)]
2C2H6 + 7O2 4 CO2 + 6 H2O Q rxn = ....
Q rxn = [4∆ Hfo CO2 +6∆ HfoH2O]-[2∆ HfoC2H6 + 7∆ Hfo O2]
= [(4 x-393,51) + (6x -285,85) –[(2x -84,68 + 0] = -3119,78 Kj/mol
*/ (CH2)3(g) + 9/2 O2(g) 3 CO2(g) + 3 H2O (c) ∆ Hrx¯= -2091,4 kJ/mol
Brp Entalpi(∆ H) untuk pembakaran (CH2)3 = 53 5 Kj/mol
-2091,4 kJ/mol = 3(-393 51) + 3(-285,85 ) - (x) - 0
X = 3(-393 51) + 3(-285,85 ) + 2091,4 = 53, 5 Kj/mol
1. Berapakah kalor yang diperlukan untuk meningkatkan suhu 735 g air dari 21 o C
menjadi 98o C ,kalor jenis air = 1 kal/g o C
2. 43,5 Kg kloroform, suhu16,8 menjadi 22,3 o C, KJ kloroform =0,2321 kal/g o C
3. Hitunglah suhu akhir jikaa 7,15 g air pada 18,21 o
C menyerap kalor 107 kal
40
41
Anda mungkin juga menyukai
- Kimia Bab 5Dokumen8 halamanKimia Bab 5Putri Chairany ITIBelum ada peringkat
- Term Okimi ADokumen5 halamanTerm Okimi AMala Audia SariBelum ada peringkat
- Termokimi ADokumen24 halamanTermokimi AYohanes SutrisnoBelum ada peringkat
- Soal Dan Pembahasan Termokimia Kelas XIDokumen19 halamanSoal Dan Pembahasan Termokimia Kelas XIBerlian Puji Rahma33% (6)
- Soal Dan Pembahasan Termokimia Kelas XI IPA Soal Dan Pembahasan Termokimia Kelas XI IPADokumen19 halamanSoal Dan Pembahasan Termokimia Kelas XI IPA Soal Dan Pembahasan Termokimia Kelas XI IPAirawati sholikhahBelum ada peringkat
- SBMPTN - Termokimia PDFDokumen38 halamanSBMPTN - Termokimia PDFHansel HendrawanBelum ada peringkat
- Termo KimiaDokumen26 halamanTermo KimiaDjoko Sriyadi67% (3)
- Soal TermokimiaDokumen6 halamanSoal TermokimiaEmir Nobel ImaltinBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- SoaljawabtermokimiaDokumen52 halamanSoaljawabtermokimiaHeri RahmatBelum ada peringkat
- TermokimiaDokumen25 halamanTermokimiaidzni desrifaniBelum ada peringkat
- MODUL ThermokimiaDokumen12 halamanMODUL ThermokimiaIra Irani PuspitasariBelum ada peringkat
- 3 TermokimiaDokumen32 halaman3 TermokimiaernaBelum ada peringkat
- Termokimia TGTDokumen18 halamanTermokimia TGTSyafira TiaradipaBelum ada peringkat
- Kfi 3Dokumen14 halamanKfi 3Estina SipayungBelum ada peringkat
- TERMOKIMIA OkDokumen2 halamanTERMOKIMIA OkYuliyanto HasanBelum ada peringkat
- Materi Termokimia SMT 1Dokumen36 halamanMateri Termokimia SMT 1rendy bagasBelum ada peringkat
- Bab 3. TermokimiaDokumen26 halamanBab 3. TermokimiaReky RumenganBelum ada peringkat
- Bab 5 TermokimiaDokumen5 halamanBab 5 TermokimiaHafidz SayyidBelum ada peringkat
- TermokimiaDokumen14 halamanTermokimiaAgus SanzdingerBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIARahayu LestariBelum ada peringkat
- Soal 2 TermokimiaDokumen12 halamanSoal 2 TermokimiaRatna SulaimanBelum ada peringkat
- TermokimiaDokumen26 halamanTermokimiatin's100% (1)
- TermokimiaDokumen36 halamanTermokimiaNyimas FebrikaBelum ada peringkat
- Kfi 3Dokumen14 halamanKfi 3Winanda Riski FebriantiBelum ada peringkat
- Penentuan Perubahan Entalpi ReaksiDokumen4 halamanPenentuan Perubahan Entalpi ReaksiArdy AmrizalBelum ada peringkat
- TermokimiaDokumen23 halamanTermokimiarahmatBelum ada peringkat
- Termokimia 2Dokumen46 halamanTermokimia 2angelina josephineBelum ada peringkat
- Contoh SoalDokumen14 halamanContoh SoalNina FauziahBelum ada peringkat
- Soal TermodinamikaDokumen9 halamanSoal TermodinamikaBali32Gede Wisnu Ambara PutraBelum ada peringkat
- Termokimia 1Dokumen33 halamanTermokimia 1Rizki SaputraBelum ada peringkat
- Term Okimi ADokumen32 halamanTerm Okimi AFahrul Rozy PohanBelum ada peringkat
- Modul 3 TermoDokumen16 halamanModul 3 Termoxa8100% (1)
- Soal KimiaDokumen18 halamanSoal KimiaNisrina NadhifahBelum ada peringkat
- Contoh Soal TermokimiaDokumen10 halamanContoh Soal TermokimiaAndi Fauzy100% (1)
- TermokimiaDokumen59 halamanTermokimiaLorin GBelum ada peringkat
- Termokimia 2Dokumen51 halamanTermokimia 2AfifaAzmiBelum ada peringkat
- Soal TermokimiaDokumen10 halamanSoal TermokimiaArika AnisaBelum ada peringkat
- Rangkuman Dan Soal TermokimiaDokumen22 halamanRangkuman Dan Soal TermokimiaFatimatuz ZahroBelum ada peringkat
- Soal TermokimiaDokumen24 halamanSoal TermokimiaRiyan IchwanudinBelum ada peringkat
- Term Okimi ADokumen12 halamanTerm Okimi Awisokresno100% (1)
- TermokimiaDokumen59 halamanTermokimiaEndri SaputraBelum ada peringkat
- TermoDokumen23 halamanTermoLen NnBelum ada peringkat
- Contoh Soal TermokimiaDokumen10 halamanContoh Soal TermokimiaRicky Sie NuratBelum ada peringkat
- Term Okimi ADokumen36 halamanTerm Okimi AHasna YumnaBelum ada peringkat
- TermokimiaDokumen15 halamanTermokimiaFatimah DeaBelum ada peringkat
- Termokimia 2Dokumen28 halamanTermokimia 2Ayu Tri AstutiBelum ada peringkat
- Pert Emu A 1Dokumen58 halamanPert Emu A 1_Raqhuel_ALouc_2087Belum ada peringkat
- Soal Dan Pembahasan Termokimia Kelas XiDokumen11 halamanSoal Dan Pembahasan Termokimia Kelas XiTsabita AfaaninBelum ada peringkat
- Perhitungan Entalpi ReaksiDokumen6 halamanPerhitungan Entalpi ReaksiApel TimunBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Penentuan Entalpi ReaksiDokumen7 halamanPenentuan Entalpi ReaksiReza Fajriyani100% (1)
- Term Okimi ADokumen24 halamanTerm Okimi ASyaiful AnamBelum ada peringkat
- MHD Syah Solih NST - LKPDokumen75 halamanMHD Syah Solih NST - LKPZakwan AlthofBelum ada peringkat
- Tugas Agama Ke 3Dokumen9 halamanTugas Agama Ke 3Zakwan AlthofBelum ada peringkat
- Termokimia ZoomDokumen11 halamanTermokimia ZoomZakwan AlthofBelum ada peringkat
- Statiska Tugas 2Dokumen1 halamanStatiska Tugas 2Zakwan AlthofBelum ada peringkat
- BAB V Modul 1 Penelitian PasarDokumen11 halamanBAB V Modul 1 Penelitian PasarZakwan AlthofBelum ada peringkat
- Bab 3 PMMDokumen4 halamanBab 3 PMMZakwan AlthofBelum ada peringkat