214 293 1 SM
214 293 1 SM
Diunggah oleh
Yudha Setia AdyJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
214 293 1 SM
214 293 1 SM
Diunggah oleh
Yudha Setia AdyHak Cipta:
Format Tersedia
Marina Chimica Acta, April 2004, hal.
2-5
Jurusan Kimia FMIPA, Universitas Hasanuddin
Vol. 5 No.1
ISSN 1411-2132
ISOLASI DAN PENENTUAN STRUKTUR
METABOLIT SEKUNDER AKTIF DARI SPONS Biemna triraphis
ASAL PULAU KAPODASANG (KEPULAUAN SPERMONDE)
Ajuk Sapar1) A. S. Kumanireng2), N.de Voogd3), dan Alfian Noor2)
1)
Jurusan Kimia FMIPA Universitas Tanjung Pura, Pontianak
2)
Jurusan Kimia FMIPA Universitas Hasanuddin, Makassar
3)
Institute for Biodiversity and Ecosystem Dynamics,
Universitas Amsterdam, Belanda
ABSTRACT
An isolation and structure determination of secondary metabolites of sponge of Biemna triraphis has
been carried out. Separation techniques used consisted of maceration (ethanol) and fractionation
(mixture of n-hexane & acetone), while structural determination were conducted using GC-MS, H-NMR,
and IR. Activity tests to Artemia salina were applied. White crystals were found with Rf value 0.68 on
TLC with eluent of n-hexane:acetone 5:2 and m.p 1300C. Instrumental analysis indicated fragmentation
values (m/e) were 414, 396, 381, 371, 329, 303, 273, 255, 231, 213, 159, 57, and 43 and chemical shift
of H-NMR () were 0.678, 0.819, 0.854, 0.905, 1.008, 3.525 and 5.345 and infra red absorptions,
(cm-1) were 3432.67, 2931.26, 2869.55, 1635.33, 1457.92, 1380.78, 1056.79, and 802.24.
Apparently, -sitosterol was the most possible candidate for the structure of the compound. Activity test
results also indicated its high bioactivity.
Keywords : isolation, sponge, - sitosterol
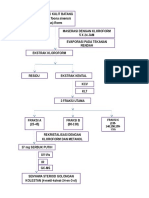
diperoleh adalah antara 120 122 fraksi. Pengujian
KLT kembali dilakukan untuk setiap fraksi dan
mengumpulkan fraksi-fraksi yang mempunyai Rf
yang sama. Kemudian dilakukan reevaporasi suhu
rendah dilanjutkan dengan KLT sekali lagi untuk
memastikan ketunggalan isolat yang diperoleh.
Penentuan
struktur organik isolat dilakukan
melalui beberapa analisis instrumental seperti
spektrometri infra merah, Resonansi Magnit Inti
Proton (H-NMR), dan spektrometri Massa
Kromatografi Gas (GCMS). Jenis HP 5972 yang
dilengkapi rujukan data kepustakaan (SDL)
Uji bioaktivitas ekstrak etanol dan isolat
murni dilakukan terhadap larva Artemia salina.
Ekstrak dibuat larutan dengan konsentrasi 1000,
100 dan 10 ppm. Setiap konsentrasi dibuat dalam 3
vial kemudian pelarut diuapkan dan zat uji
diemulsikan dengan 50 L 5 % Tween 80. Ke
dalam tiap-tiap vial dimasukkan air laut 4 mL dan
10 ekor larva udang, kemudian volumenya
dicukupkan sampai 5 mL dan diletakkan di bawah
lampu TL, dan selama 24 jam kemudian dihitung
jumlah larva udang laut yang mati. Penentuan LC50
dilakukan dengan menggunakan perangkat lunak
Finney.
PENDAHULUAN
Spong merupakan sumber senyawa bahan
alam seperti terpenoid, steroid, poliketida, alkaloid
dan masih banyak lagi senyawa-senyawa yang lain.
Senyawa-senyawa tersebut memiliki potensi
biomedik yang berguna bagi penyembuhan
penyakit tertentu pada manusia, misalnya sebagai
anti kanker, antibiotik, antitumor, antiinflamasi,
inhibitor enzim, dan sifat-sifat lainnya (Ralph,
1998).
Penelitian ini melaporkan hasil isolasi dan
penentuan struktur sterol yang ditemukan pada
spesis Biemna triraphis (Voogd, 1997) di perairan
kepulauan Spermonde oleh Tim Buginesia,
kerjasama riset kelautan UNHAS dan Belanda.
METODE PENELITIAN
Contoh spons diambil pada kedalaman
10 m di perairan pulau Kapodasang (Kepulauan
Spermonde), 16 km dari Pantai Makassar, lalu
dideterminasi
spesisnya
untuk
selanjutnya
dianalisis.
Proses isolasi dilakukan menurut prosedur
yang telah banyak diterapkan (Daloze & Braekman,
1994) yaitu maserasi dengan etanol selama 48 jam,
evaporasi pelarut suhu rendah dan ekstrak
keringnya disaponifikasi dengan NaOH 0,1 N. Uji
kromatografi lpis tpis (KLT) digunakan untuk
mengidentifikasi noda atau hasil pemisahan
sekaligus menentukan komposisi eluen dalam
kolom adsorpsi. Fraksi eluat, @ 5 mL, yang
HASIL DAN PEMBAHASAN
Contoh spesis spong, yaitu Biemna
triraphis yang diambil dari perairan pesisir pantai
pulau Kapodasang tanggal 10 Juli 2001 dapat
dilihat pada Gambar-1.
Ajuk Sapar, A.S Kumanireng, N.de Voogd, dan Alfian Noor
Mar.Chim.Acta
Gambar 1
Spong spesis Biemna triraphis
Gambar 2
Fragmentasi isolat tunggal dan estimasi
Struktur adalah -stigmasterol
Hasil identifikasi H-NMR menunjukan
adanya puncak-puncak serapan pada pergeseran
kimia, (ppm) : 0,678; 0,819; 0,854; 0,905; 1,008;
3,535; dan 5,345 sebagaimana yang ditunjukkan
pada Gambar-3.
Berat Maserat kering hasil maserasi
(dengan etanol) terhadap 362,4 gram Biemna
triraphis adalah 23,4267 gram dan berat ekstrak
kering dari hasil saponifikasi adalah 774,7 mg.
Kombinasi pelarut yang baik digunakan pada KLT
adalah n-heksana : aseton (5:2), sedangkan untuk
kromatografi kolom digunakan campuran nheksana : aseton dengan perbandingan berturutturut 50 : 1; 40 : 1; 30 : 1; 20 : 1; 15 : 1; dan 10 : 1.
Jumlah fraksi yang terkumpul dari hasil elusidasi
adalah 121 fraksi.
Uji KLT fraksi-fraksi tersebut menghasilkan satu noda tunggal dalam kelompok fraksi
67-85 dengan nilai Rf yang sama yaitu 0,68.
Setelah pelarutnya diuapkan sampai kering
diperoleh kristal putih berbentuk jarum seberat
26,5 mg dan setelah rekristalisasi titik lelehnya
adalah 130 C.
Uji bioaktivitas terhadap ekstrak etanol
Biemna triraphis pada konsentrasi 10, 100, dan
1000 ppm menunjukkan bahwa tingkat kematian
artemia salina berturut-turut adalah 0 %, 30 %, dan
56,67 %. Hasil perhitungan dengan program
Finney menunjukkan bahwa ekstrak tersebut
adalah bioaktif dengan nilai LC50 = 543 artinya
bahwa pada konsentrasi 543 ppm prosentase
kematian artemia salina adalah 50 %, sedangkan
terhadap
kristal
isolat
Biemna
triraphis
menunjukkan bahwa pada konsentrasi di atas,
tingkat kematiannya adalah 20 %, 50 %, dan 90 %
dengan nilai LC50 = 76 artinya pada konsentrasi 76
ppm tingkat kematian artemia salina mencapai 50
%.
Analisis GC-MS menunjukkan bahwa
massa ion molekuler isolat pada spektrum MS
adalah 414. Fragmentasi massa adalah 396; 381;
371; 354; 329; 303; 273; 255; 231; 213; 159; 57;
dan 43 (Gambar-2).
Gambar 3.
Spektrum H-NMR dengan puncak-puncak serapan yang
mendukung interpretasi hasil fragmentasi spektrum massa
Dari hasil interprestasi pergeseran kimia
senyawa isolat di atas, puncak-puncak tersebut
merupakan puncak serapan karateristik steroid
jenis stigmastan. Data ini didukung dengan adanya
puncak serapan pada daerah 0,678 ppm dengan
1,008 ppm sebagai puncak serapan metil angular.
Puncak serapan duplet pada daerah 0,905 ppm dan
0, 819 ppm adalah serapan puncak pada atom C-21,
C-26 dan C-27. Puncak serapan yang muncul pada
daerah 5,345 ppm yang merupakan ciri khas suatu
proton dari gugus vinil (ikatan rangkap) yang
mengandung tiga subsituen karbon pada atom C-6.
Tipe puncak serapan sektet pada daerah 3,525 ppm
Vol. 5 No.1
Isolasi dan Penentuan Struktur Metabolit ...
merupakan puncak serapan proton pada atom C-3
yang memiliki gugus hidroksil beriorientasi .
Dengan demikian puncak-puncak serapan tersebut
mengacu pada puncak serapan karateristik senyawa
jenis sterol yaitu -sitosterol.
Dari hasil analisis inframerah berbagai
serapan gugus fungsi dapat dilihat dalam Tabel-1 di
bawah ini.
Struktur -sitosterol diduga terbentuk dari
asam asetat melalui jalur asam mevalonat
kemudian mengalami berbagai macam reaksi
kondensasi, siklisasi, dan sebagainya sampai
terbentuknya senyawa-antara (intermediates). Pada
pembentukan turunan-turunan 24-alkil kolesterol,
metilen kolesterol menjadi zat antara untuk
pembentukan senyawa-senyawa lain seperti
clionasterol,
-sitosterol, campesterol, 28isofukosterol, fukosterol dan brassikasterol.
Struktur -sitosterol dapat dilihat dalam Gambar 4.
Hasil penelitian yang dilakukan oleh Renai
Sante
Institute
of
Integrative
Medicine
menunjukkan bahwa salah satu efek farmakologis
dari -sitosterol adalah kemampuan menghambat
kerja enzim yang mengkonversi testosteron menjadi
dehidrotestosteron (DHT) yang merupakan
penyebab terjadinya kanker prostat.
Tabel 1.
Pita Serapan Spektrum IR
No.
Gugus Fungsi
Serapan (cm-1)
1.
Uluran O-H
3432,67
2.
Uluran C-H Asimetrik
2931,26
3.
Uluran C-H simetrik
2869,55
4.
Uluran C=C
1635,33
5.
Tekukan C-H
1457,92 dan 1380,78
6.
Uluran C-O
1056,79
7.
Tekukan C-H
802,24
KESIMPULAN
Hasil interprestasi dengan IR, H-NMR,
dan GC-MS mengindikasikan bahwa isolat tunggal
berupa senyawa berbentuk kristal memiliki sifat
dan karateristik yang sama dengan -sitosterol.
Selain itu, uji bioaktivitas menunjukkan
bahwa
Biemna triraphis
adalah bioaktif
dengan nilai LC50 terhadap Artemia
salina
sebesar 454 ppm, dan uji bioaktivitas terhadap
isolat kristal menunjukkan bahwa metabolit
sekunder yang dikandungnya adalah bioaktif
dengan nilai LC50 sebesar 76 ppm.
Serapan maksimum
pada daerah
= 3432,67 cm-1 menjelaskan adanya gugus OH
dan didukung oleh serapan ulur C-O pada =
1056,79 cm-1. Puncak serapan u lur tak simetrik
dar metil atau metilen (-CH2-) terlihat pada daerah
= 2931,26 cm-1 dan uluran simetrik pada daerah
= 2869,55 cm-1. Serapan tekukan dari gugus metil
dan metilen muncul pada = 1457,92 cm-1.
Serapan pada daerah = 1635,33 cm-1 memberi
isaarat adanya ikatan rangkap (=C-H) dalam
molekul yang dibuktikan dengan munculnya
serapan tekukan C-H keluar bidang pada daerah
= 802,24 cm-1. Dengan demikian senyawa isolat
memiliki gugus fungsi OH, -CH3, -CH2-, dan =CH-
UCAPAN TERIMA KASIH
Kepada Program Buginesia dan Rob van
Soest dari Universitas Amsterdam atas bantuannya
dalam memberikan informasi rujukan tentang
kekayaan keragaman hayati spong di Kepulauan
Spermonde.
Gambar 4.
Struktur senyawa -sitosterol yang ditemukan dalam contoh
spong Biemna triraphis
Ajuk Sapar, A.S Kumanireng, N.de Voogd, dan Alfian Noor
Mar.Chim.Acta
DAFTAR PUSTAKA
Daloze, D. and J. C. Braekman, 1994. Separation Methods : Application to the Isolation of Sponge
Metabolites. In : Soest, R. W. M. Van, Th. M. G. van Kempen, and J. C. Braekman. (Eds.), Spons in Time
and Spaces. Proc.4th Int. Porifera Congr. Rotterdam : Balkema.
Ireland, C., D. Roll, T. Molnski, T. McKee, M. Zabriske, and J. C. Swersey, 1988. Uniqueness of The Marine
Chemical Environment. Categories of Marine Natural Products from Invertebrates in Biomedical
Importance of Marine Organisms, Fautin, D. G., (Ed.), California Academy of Sciences, San Fransisco
45-57.
Voogd, N. de, 1997. Cross-shelf Distribution of South West Sulawesi Open Reef Sponges, thesis, University of
Amsterdam
Ralph, D. F., 1988. What Are Sponnges ?. Adapted From : Hooper, JNA. Sponguide, version April 1988.
Queensland Museum. Australia.
Silverstein, R. M., G. C. Bassler and T. C. Morril, 1986. Spectrometric Identification of Organic Compounds.
Fourth Edition. John Wiley and Sons, Inc. Singapore.
Soest, R. W. M. van and J. C. Braekman, 1999. Cheomosystematics of Polifera : A Review. Memories of The
Queensland Museum 44 : 569-589. Brisbane
Anda mungkin juga menyukai
- Pinostrobin 1Dokumen5 halamanPinostrobin 1Rizky Ade PutraBelum ada peringkat
- ISOLASI, ELUSIDASI STRUKTUR, DAN UJI BIOAKTIVITAS SENYAWA STEROID DARI BUAH MAHKOTA DEWA (Phaleria Macrocarpa)Dokumen8 halamanISOLASI, ELUSIDASI STRUKTUR, DAN UJI BIOAKTIVITAS SENYAWA STEROID DARI BUAH MAHKOTA DEWA (Phaleria Macrocarpa)RaisyIkrimahBelum ada peringkat
- Review Jurnal Praktikum Fitokimia Kelompok 1Dokumen26 halamanReview Jurnal Praktikum Fitokimia Kelompok 1roni setiawanBelum ada peringkat
- PrESENTASE SENYAWA BARUDokumen15 halamanPrESENTASE SENYAWA BARURosalinda MaarebiaBelum ada peringkat
- Tugas FabaDokumen6 halamanTugas FabaRhesky Noer FhadillahBelum ada peringkat
- Sintesis TerpenoidDokumen9 halamanSintesis TerpenoidIndahLestariBelum ada peringkat
- 9184 15659 1 PBDokumen4 halaman9184 15659 1 PBBoy DullBelum ada peringkat
- Ujian Akhir Semester Kimia Bahan AlamDokumen7 halamanUjian Akhir Semester Kimia Bahan Alamhumairah ulfaBelum ada peringkat
- 453-Article Text-587-1-10-20180418-1Dokumen4 halaman453-Article Text-587-1-10-20180418-1Mai A BakarBelum ada peringkat
- Metode Pemisahan Dan Analisis Sediaan Steroid Menggunakan Spektrofotometri FtirDokumen12 halamanMetode Pemisahan Dan Analisis Sediaan Steroid Menggunakan Spektrofotometri FtirAhmad MujahidinBelum ada peringkat
- Senyawa TerpenoidDokumen6 halamanSenyawa Terpenoidniken retno100% (1)
- TUGAS ISOLASI SENYAWA BIOAKTIF FixDokumen14 halamanTUGAS ISOLASI SENYAWA BIOAKTIF FixIsmiatunBelum ada peringkat
- Ekstraksi SteroidDokumen3 halamanEkstraksi SteroidEty Permata SariBelum ada peringkat
- Identifikasi SenyawaDokumen14 halamanIdentifikasi SenyawaFernanda orlandaBelum ada peringkat
- 1625-Article Text-3287-1-10-20161126Dokumen7 halaman1625-Article Text-3287-1-10-20161126RAFIE IRAWANBelum ada peringkat
- Studi Pendahuluan Kandungan Kimia Tumbuhan Paku Nephrolepis RadicansDokumen10 halamanStudi Pendahuluan Kandungan Kimia Tumbuhan Paku Nephrolepis RadicansNatalie CarReen RadjahBelum ada peringkat
- TerpenoidDokumen13 halamanTerpenoidnitaBelum ada peringkat
- 454-Article Text-589-1-10-20180418Dokumen5 halaman454-Article Text-589-1-10-20180418Santi ahmaniaBelum ada peringkat
- Glikosida - KIBA - Yeremia Baali - 19101101007Dokumen9 halamanGlikosida - KIBA - Yeremia Baali - 19101101007Yeremia W. BaaliBelum ada peringkat
- Project Metode Fitokimia Kelompok 3 Review Jurnal Tentang Isolasi Dan Identifikasi Senyawa Kimia SteroidDokumen32 halamanProject Metode Fitokimia Kelompok 3 Review Jurnal Tentang Isolasi Dan Identifikasi Senyawa Kimia SteroidAldo ScipioBelum ada peringkat
- Kelompok 4 Spektrofluorometri - ppt-1Dokumen29 halamanKelompok 4 Spektrofluorometri - ppt-1NURDIANA TANDI PAREBelum ada peringkat
- Terjemahan Jurnal Aiello Dkk.Dokumen8 halamanTerjemahan Jurnal Aiello Dkk.Aulia RhamdaniBelum ada peringkat
- JMS - Vol. 9 - No.1 - 209-213Dokumen5 halamanJMS - Vol. 9 - No.1 - 209-213WahyudinBelum ada peringkat
- Review SINTESIS DERIVATIF KALKON NOVEL DARI MKRISTIKAN UNTUK AKTIVITAS PENCEGAHAN KANKER KULITDokumen7 halamanReview SINTESIS DERIVATIF KALKON NOVEL DARI MKRISTIKAN UNTUK AKTIVITAS PENCEGAHAN KANKER KULITMIKAEL ELFINDO WAKURBelum ada peringkat
- AKTA Kelompok 8Dokumen15 halamanAKTA Kelompok 824tb8cfdmzBelum ada peringkat
- Laporan Uv VisDokumen21 halamanLaporan Uv VisMelda HasanovaBelum ada peringkat
- Analisis FarmasiDokumen13 halamanAnalisis FarmasiMannan ZubaidiBelum ada peringkat
- 35-Article Text-759-1-10-20230829Dokumen15 halaman35-Article Text-759-1-10-20230829aprilianidevi367Belum ada peringkat
- Steroid Jstfok (Dian)Dokumen5 halamanSteroid Jstfok (Dian)Andriliana TrihastutyBelum ada peringkat
- (Jurnal) Nelli Agusti h31111272Dokumen8 halaman(Jurnal) Nelli Agusti h31111272Reza Aulia RahmanBelum ada peringkat
- Jurnal Tumbuhan Tingkat RendahDokumen4 halamanJurnal Tumbuhan Tingkat RendahummiyatiBelum ada peringkat
- Kimia Organik IiiDokumen28 halamanKimia Organik IiiFauzan PatawariBelum ada peringkat
- Jurnal KbaDokumen9 halamanJurnal KbaUuswatunHasanah100% (1)
- Jurnal SteroidDokumen5 halamanJurnal SteroidJohan LampungChelsea FcBelum ada peringkat
- Jurnal Iccs UgmDokumen5 halamanJurnal Iccs UgmAndre MaarufBelum ada peringkat
- Review Jurnal Fraksinasi Dan Identifikasi Senyawa Tanin Pada Daun Belimbing WuluhDokumen4 halamanReview Jurnal Fraksinasi Dan Identifikasi Senyawa Tanin Pada Daun Belimbing WuluhRisma Indah ArdiyanaBelum ada peringkat
- FraksinasiDokumen19 halamanFraksinasiAgus Virga TendeanBelum ada peringkat
- KimiaDokumen9 halamanKimiaIyan MuliyanaBelum ada peringkat
- Sri Suparthini - Uts Analisis FarmasiDokumen3 halamanSri Suparthini - Uts Analisis FarmasiMade Dwita PertiwiBelum ada peringkat
- Pembahasan Monitoring Kromatografi Lapis TipisDokumen7 halamanPembahasan Monitoring Kromatografi Lapis TipisAGATHA RIA BUDIYANABelum ada peringkat
- Jurnal Asam Urat Dan HiperurisemiaDokumen4 halamanJurnal Asam Urat Dan Hiperurisemiaranz ibonkBelum ada peringkat
- Alkaloid Erythrina Dan Pterocarpan Dari Kulit Kayu Erythrina SubumbranDokumen6 halamanAlkaloid Erythrina Dan Pterocarpan Dari Kulit Kayu Erythrina Subumbranthelover_zrdBelum ada peringkat
- Rieview Jurnal Eka Devi Rahmawati A28226832Dokumen9 halamanRieview Jurnal Eka Devi Rahmawati A28226832Eka Devi RahmawatiBelum ada peringkat
- JurnalDokumen6 halamanJurnalMuhamad RifaiBelum ada peringkat
- Review Jurnal Kimia Organik - (Puji Astuti A28226995)Dokumen5 halamanReview Jurnal Kimia Organik - (Puji Astuti A28226995)PUJI ASTUTIBelum ada peringkat
- JURNAL Ekstrak KloroformDokumen16 halamanJURNAL Ekstrak KloroformDwi Sartika SariBelum ada peringkat
- Karya Ilmiah Wahyu Puji Hastiningrum PDFDokumen11 halamanKarya Ilmiah Wahyu Puji Hastiningrum PDFSisQha LuCiiajjaBelum ada peringkat
- JurnalDokumen4 halamanJurnalMegawati R NBelum ada peringkat
- 1934-Article Text-3819-1-10-20150121Dokumen4 halaman1934-Article Text-3819-1-10-20150121Dina FadhilaBelum ada peringkat
- Elusidasi Dan Isolasi Senyawa Pada Ekstrak Etanol Rimpang KecombrangDokumen12 halamanElusidasi Dan Isolasi Senyawa Pada Ekstrak Etanol Rimpang KecombrangSitti Munawarah IIBelum ada peringkat
- Resume Dan Review JurnalDokumen5 halamanResume Dan Review JurnalAdam Danish GhaisaniBelum ada peringkat
- Skrining Fitokimia Dan Bioaktivitas Ekstrak Dan Isolat DARI DAUN TERAP (Artocarpus Odoratissimus Blanco)Dokumen4 halamanSkrining Fitokimia Dan Bioaktivitas Ekstrak Dan Isolat DARI DAUN TERAP (Artocarpus Odoratissimus Blanco)Rizki FebriyanaBelum ada peringkat
- Kel 1 PsbaDokumen10 halamanKel 1 PsbaLadyes RamadinriBelum ada peringkat
- KumarinDokumen17 halamanKumarinSyukriyati Na'imatul AisyahBelum ada peringkat
- Tugas Mata Kuliah Fitokimia - Kelompok 3Dokumen7 halamanTugas Mata Kuliah Fitokimia - Kelompok 3Tika SeptiaBelum ada peringkat
- Mudah Dan Aktif Belajar Kimia SMA Kelas XII-Yayan Sunarya-2009Dokumen310 halamanMudah Dan Aktif Belajar Kimia SMA Kelas XII-Yayan Sunarya-2009Muhammad Yusi Anda Rizky0% (1)
- Daftar Nama Dosen KimiaDokumen1 halamanDaftar Nama Dosen KimiaMuhammad Yusi Anda Rizky33% (3)
- Contoh Judul PKMDokumen505 halamanContoh Judul PKMSasmi NopiyaniBelum ada peringkat
- Laporan Kiman KompleksometriDokumen20 halamanLaporan Kiman KompleksometriMuhammad Yusi Anda RizkyBelum ada peringkat
- Kinetika Kimia Dan Katalis-Reaksi KompleksDokumen3 halamanKinetika Kimia Dan Katalis-Reaksi KompleksMuhammad Yusi Anda RizkyBelum ada peringkat
- Perhitungan Fungsi Gelombang (Bentuk Orbital 2px Atom Karbon)Dokumen20 halamanPerhitungan Fungsi Gelombang (Bentuk Orbital 2px Atom Karbon)Muhammad Yusi Anda Rizky100% (2)
- 1.penentuan Kerapatan Dan Bobot JenisDokumen20 halaman1.penentuan Kerapatan Dan Bobot JenisMuhammad Yusi Anda Rizky100% (2)
- Reaksi Asam-Asam Amino Dan ProteinDokumen29 halamanReaksi Asam-Asam Amino Dan ProteinMuhammad Yusi Anda RizkyBelum ada peringkat