Kation Golongan 1
Diunggah oleh
Biieb0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
40 tayangan4 halamanKimia Analisis kualitatif dan kuantitatif kation golongan I
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniKimia Analisis kualitatif dan kuantitatif kation golongan I
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
40 tayangan4 halamanKation Golongan 1
Diunggah oleh
BiiebKimia Analisis kualitatif dan kuantitatif kation golongan I
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 4
NAMA KELOMPOK:
1. EMMALIA G. GINTING-20101101016
2. HOTMA P LESTARI TAMPUBOLON-20101101029
Tugas Kimia Analisis Kualitatif dan Kuantitatif Analisis
Kation Golongan I
-
1. Jelaskan dasar klasifikasi analisis kation (ion logam) menjadi 5 golongan!
Jawaban:
Untuk tujuan analisis kualitatif sistematis, kation diklasifikasikan menjadi lima
kelompok berdasarkan perilakunya terhadap beberapa reagen. Dengan penggunaan
sistematis dari apa yang disebut reagen kelompok ini, kita dapat memutuskan ada atau
tidak adanya kelompok kation, dan juga dapat memisahkan kelompok ini untuk
pemeriksaan lebih lanjut. Reaksi kation akan dibahas di sini sesuai dengan urutan
yang ditentukan oleh sistem grup ini. Selain sebagai cara tradisional untuk
menyajikan materi, itu membuat studi reaksi ini lebih mudah karena ion perilaku
analog ditangani dalam satu kelompok. Kelompok reagen yang digunakan untuk
klasifikasi kation yang paling umum adalah asam klorida, hidrogen sulfida, amonium
sulfida, dan amonium karbonat. Klasifikasi didasarkan pada apakah kation bereaksi
dengan reagen ini dengan pembentukan endapan atau tidak. Oleh karena itu dapat
dikatakan bahwa klasifikasi kation yang paling umum didasarkan pada perbedaan
kelarutan klorida, sulfida, dan karbonatnya. Kelima golongan kation dan ciri-ciri
golongan tersebut adalah sebagai berikut:
a. Golongan I
Membentuk endapan jika direaksikan dengan asam klorida encer
Pb2+ , Hg2 2+ , Ag
b. Golongan II
Tidak bereaksi dengan asam klorida tetapi membentuk endapan dengan
hidrogen sulfida dalam suasana asam mineral encer
SUB GOLONGAN II A SUB GOLONGAN II B
Merkurium (II) Arsenik (III)
Tembaga Arsenic (V)
Bismut Stibium (III)
Kadmium Stibium (V)
Timah (II)
Timah (III), (IV)
Sulfida dari kation gol II a tak dapat larut dalam amonium polisulfida, gol
II b dapat larut
c. Golongan III
Tidak bereaksi dengan asam encer ataupun dengan hidrogen sulfida dalam
suasana asam mineral encer
Kation ini membentuk endapan dengan amonium sulfida dalam suasana
netral atau amoniakal
Kobalt(II), nikel(II), besi(II), besi(III), kromium(III), aluminium, Zink,
mangan(II)
d. Golongan IV
Tak bereaksi dengan reagensia golongan I, II, III
Kation-kation ini membentuk endapan amonium karbonat dengan adanya
amonium klorida dalam suasana netral atau sedikit asam
Kalsium, stronsium, barium
e. Golongan V
Kation-kation yang umum, yang tidak bereaksi dengan reagensia-reagensia
golongan sebelumnya merupakan golongan kation yang terakhir
Ion-ion magnesium,natrium, kalium, amonium, litium dan hidrogen
2. Jelaskan bagaimana cara mengidentifikasi dan menganalisis setiap kation golongan I.
Penjelasan dilengkapi dengan reaksi yang terjadi dan perubahan yang dapat diamati.
Jawaban:
Analisis campuran kation-kation memerlukan pemisahan kation secara
sistematik dalam golongan dan selanjutnya diikuti pemisahan masing-masing
golongan ke dalam sub golongan dan komponen-komponennya. Pemisahan dalam
golongan didasarkan perbedaan sifat kimianya dengan cara menambahkan pereaksi
yang akan mengendapkan ion tertentu dan memisahkan dari ion-ion lainnya. Sebagai
suatu gambaran, penambahan HCl dalam larutan yang mengandung semua ion hanya
akan mengendapkan klorida dari ion-ion timbal (Pb2+), perak (Ag+ ) dan raksa (Hg2+).
Setelah ion-ion golongan ini diendapkan dan dipisahkan, ion-ion lain yang ada dalam
larutan tersebut dapat diendapkan dan penambahan H2S dalam suasana asam. Setelah
endapan dipisahkan perlakuan selanjutnya dengan pereaksi tertentu memungkinkan
terpisahnya golongan lain. Jadi dalam analisis kualitatif sistematik kation-kation
diklasifikasikan dalam 5 golongan, berdasarkan sifat-sifat kation terhadap beberapa
pereaksi antara lain adalah asam klorida, hidrogen sulfida, amonium sulfida dan
amonium karbonat. Umumnya klasifikasi kation didasarkan atas perbedaan kelarutan
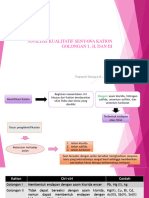
dari klorida, sulfida dan karbonat dari kation-kation tersebut. Skema di bawah ini
memperlihatkan pemisahan kation-kation dalam golongan I sampai dengan V
berdasarkan sifat kimianya. Setelah pemisahan dilakukan uji spesifik untuk masing-
masing kation (Vogel, 1985).
Didalam kation ada beberapa golongan yang memiliki ciri khas tertentu
diantaranya: Golongan I: Kation golongan ini membentuk endapan dengan asam
klorida encer. Ion golongan ini adalah Pb, Ag, Hg. Dalam suasana asam, klorida dan
kation dari golongan lain larut. Penggunaan asam klorida berlebih untuk
pengendapkan kation golongan I memiliki dua keuntungan yaitu memperoleh
endapan klorida semaksimal mungkin dan menghindari terbenuknya endapan BIOCI
dan SbOCI. Kelebihan asam klorida yang terlalu banyak dapat menyebabkan AgCl
dan PbCl2 larut kembali dalam bentuk kompleks sedangkan klorida raksa (I), Hg,
Cl2, tetap stabil.
Kation golongan I :Timbal (II), Merekurium (I), dan Perak (I)
Pereaksi golongan :Asam klorida encer(2M)
Reaksi golongan :Endapan putih timbal klorida (PbCl2), Merkurium(I) klorida
(Hg2Cl2), dan perak klorida (AgCl).
Kation-kation golongan I diendapkan sebagai garam klorida. Pemisahan
kation golongan I tersebut dari campuran sebagai garam klorida didasarkan fakta
bahwa garam klorida dari golongan I tidak larut dalam suasana asam (pH 0,5-1).
Kation-kation dalam golongan I yang terdiri atas Ag+ , Hg+ , dan Pb2+. Garam
klorida dari kation golongan I adalah: Hg2Cl2, AgCl, dan PbCl2. Pemisahan masing-
masing kation tersebut dilakukan berdasarkan cara sebagai berikut:
1. PbCl2 dipisahkan dari Hg2Cl2 dan AgCl berdasarkan perbedaan kelarutan
kation. PbCl2 larut dalam air panas, sedangkan Hg2Cl2 dan AgCl tidak dapat
larut dalam air panas.
2. Hg2Cl2 dan AgCl dipisahkan berdasarkan perbedaan kelarutan antara
kompleks Hg(NH2)Cl dan [Ag(NH3)2] yang dibentuk dengan penambahan
amonia terhadap Hg2Cl2 dan AgCl setelah PbCl2 terpisah. Kompleks
Hg(NH2)Cl berbentuk endapan hitam yang bercampur dengan Hg+ ,
sedangkan [Ag(NH3)2] tidak berbentuk endapan.
Identifikasi terhadap ketiga kation tersebut setelah terpisah adalah sebagai berikut:
a. Pb2+ dapat direaksikan dengan K2CrO4 yang akan membentuk PbCrO4
(endapan kuning). Pb2+ + CrO4 - PbCrO4 (endapan kuning)
b. Ag+ dapat diidentifikasi dengan mereaksikannya terhadap KI, sehingga
terbentuk AgI (endapan kuning muda). Atau mengasamkan filtrat yang
diperoleh dari pemisahan dengan asam nitrat encer, sehingga kompleks
[Ag(NH3)2] terurai kembali dan dihasilkan endapan putih AgCl.
[Ag(NH3)2] + KI>>AgI(endapan kuning muda) + 2 NH3
c. Hg (I) dapat diidentifikasi dari warna endapan yang terjadi pada pemisahannya
dengan Ag+ , adanya Hg2 2+ ditandai dengan adanya endapan berwarna hitam.
Hg2Cl2 + 2 NH3 [Hg(NH2)Cl + Hg] (endapan hitam) + NH4 + + Cl- Kation
golongan II ini bereaksi dengan asam klorida, tetapi membentuk endapan
dengan hidrogen sulfida dalam suasana asam mineral encer. Ion golongan ini
adalah Hg, Bi, Cu, cd, As, Sb, Sn.
Uji Gol.1 (Pb2+) Pengamatan Keterangan
1. HCl + NH3 + Endapan putih Pb2+ + 2Cl- PbCl2 Tak
air panas Tidak ada perubahan ada kompleks amina
Larut tetapi membentuk
Pb(OH)2 33,4 g PbCl2
larut per L pada 100o C
2. H2 S+ HCl + Endapan hitam Pb2+ + H2S PbS +
HNO3 pekat + Endapan putih 2H+
dididihkan Endapan putih
3. NH3 + berlebih Endapan putih
Tetap
4. NaOH + Endapan putih
berlebih Endapan larut
5. KI + berlebih Endapan kuning
Tak ada perubahan
Kation golongan II dibagi dalam dua sub-golongan yaitu sub golongan tembaga dan
sub golongan arsenik. Dasar dari pembagian ini adalah kelarutan endapan sulfida dalam
ammonium polisulfida. Sementara sulfida dari sub golongan tembaga tidak larut dalam
regensia ini, sulfida dari sub grup arsenik melarut dengan membentuk garam tio. Golongtan
II sering disebut juga sebagai asam hidrogen sulfida atau glongan tembaga timah. Klorida,
nitrat, dan sulfat sangat mudah larut dalam air. Sedangkan sulfida, hidroksida dan
karbonatnya tak larut.
Referensi:
1. Svehla, G. 1996. Vogel’s Qualitative Inorganic Analysis, 7th edition. Longman Singapore
Publishers (Pte) Ltd., Singapore. P 59-76
Anda mungkin juga menyukai
- TugasDokumen7 halamanTugasMulti ArmainahBelum ada peringkat
- Penggolongan Kation KLP 1Dokumen9 halamanPenggolongan Kation KLP 1Zhalzhabilla AzzahrahBelum ada peringkat
- Analisis KationDokumen17 halamanAnalisis KationSileents ShaadowBelum ada peringkat
- Analisiskation 190425155404Dokumen13 halamanAnalisiskation 190425155404Dechia Sachamyta LicheresBelum ada peringkat
- Analisa Kualitatif Adalah Proses Dalam Mendeteksi Keberadaan Suatu Unsur Kimia Dalam Sampel Yang Tidak DiketahuiDokumen3 halamanAnalisa Kualitatif Adalah Proses Dalam Mendeteksi Keberadaan Suatu Unsur Kimia Dalam Sampel Yang Tidak DiketahuiYoon Hye MyeongBelum ada peringkat
- Analisis Kation Golongan I II III IV DanDokumen13 halamanAnalisis Kation Golongan I II III IV Dannadya aulia100% (1)
- Entifisi Kation Logam BeratDokumen31 halamanEntifisi Kation Logam BeratTifa KahestiyBelum ada peringkat
- Analisis KationDokumen16 halamanAnalisis KationLinggar Rudiarto100% (1)
- Entifisi Kation Logam BeratDokumen30 halamanEntifisi Kation Logam BeratTifa KahestiyBelum ada peringkat
- Laporan Praktikum Kation Dan AnionDokumen23 halamanLaporan Praktikum Kation Dan AnionFatimah Jufri50% (4)
- Analisis Kation Golongan I II III IV TUGASDokumen12 halamanAnalisis Kation Golongan I II III IV TUGASdutaBelum ada peringkat
- Pemisahan KationDokumen7 halamanPemisahan KationRaihani Firdausi 1807113552Belum ada peringkat
- Bab IDokumen13 halamanBab IMoch Khoirul UmamBelum ada peringkat
- Analisis Senyawa KimiaDokumen17 halamanAnalisis Senyawa KimiaZulitaBelum ada peringkat
- Jurnal Praktikum Analisis Kation Dan Anion - 008 - Tiara PuspitasariDokumen31 halamanJurnal Praktikum Analisis Kation Dan Anion - 008 - Tiara PuspitasariBani AsrorBelum ada peringkat
- Praktikum Pemisahan Kation Golongan IDokumen2 halamanPraktikum Pemisahan Kation Golongan IFitriyatun Nur JannahBelum ada peringkat
- JJXJDKSMXDokumen15 halamanJJXJDKSMXAufa QaysBelum ada peringkat
- Makalah Kation Dan AnionDokumen29 halamanMakalah Kation Dan AnionCahaya PratamaBelum ada peringkat
- RX Kation Gol 1 & 2 Kmia AnalisaDokumen27 halamanRX Kation Gol 1 & 2 Kmia Analisalisa andriani100% (1)
- Materi KA1 Minggu 1Dokumen28 halamanMateri KA1 Minggu 1Arnes TataBelum ada peringkat
- Kation III Kelompok 1Dokumen24 halamanKation III Kelompok 1ZahraBelum ada peringkat
- Kation Golongan IDokumen13 halamanKation Golongan IDWIBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Dokumen22 halamanMakalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Fajar Yusya Ramadhan94% (33)
- Kimia AnalitikDokumen20 halamanKimia AnalitikYannieApriyani50% (2)
- Analisis Anion KationDokumen6 halamanAnalisis Anion KationPuspipita DewiBelum ada peringkat
- Analis Kation AnionDokumen5 halamanAnalis Kation AnionAnnyzar Maulana BachtiarBelum ada peringkat
- Pemisahan Kation Golongan I Dan IiDokumen14 halamanPemisahan Kation Golongan I Dan IiFadhil FerdianBelum ada peringkat
- Golongan Kation - Kiman FinishDokumen10 halamanGolongan Kation - Kiman Finishreyani dita rahmadaniBelum ada peringkat
- MAKALAH ANALISIS KATION GOL 1,2 (Celine Alfiona)Dokumen19 halamanMAKALAH ANALISIS KATION GOL 1,2 (Celine Alfiona)Celine AlfiBelum ada peringkat
- Analisis Kation Golonggan IIDokumen25 halamanAnalisis Kation Golonggan IISri SumartiniBelum ada peringkat
- Pratikum Kimia - Kation AnionDokumen7 halamanPratikum Kimia - Kation AnionImeldaMiYukiRenyutBelum ada peringkat
- 27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIDokumen22 halaman27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIMawar RamadhaniBelum ada peringkat
- Laporan Resmi KationDokumen20 halamanLaporan Resmi KationFikriyah Nugiari RachmahBelum ada peringkat
- Kation IV Kelompok 3Dokumen21 halamanKation IV Kelompok 3ZahraBelum ada peringkat
- Modul 2 Analisa Kualitatif Metoda Reagen Spesifik Sampel Anorganik Untuk KationikDokumen14 halamanModul 2 Analisa Kualitatif Metoda Reagen Spesifik Sampel Anorganik Untuk KationikAl GhifarBelum ada peringkat
- Pemisahan Kation Gol 2Dokumen13 halamanPemisahan Kation Gol 2Meitri Wulandari KoharBelum ada peringkat
- Laporan Analisis Kation AnionDokumen10 halamanLaporan Analisis Kation AnionDeni St-setia Van HoutenBelum ada peringkat
- Tugas Kimia Analisis ALFILADokumen9 halamanTugas Kimia Analisis ALFILAdhiya zahra maharaniBelum ada peringkat
- (Makalah) Pemisahan Kation Golongan I-VDokumen16 halaman(Makalah) Pemisahan Kation Golongan I-VYuyunBelum ada peringkat
- LA ArrheniusDokumen27 halamanLA Arrheniuseli eliBelum ada peringkat
- Identifikasi Kation Golongan 4 Dan 5Dokumen7 halamanIdentifikasi Kation Golongan 4 Dan 5asnhyBelum ada peringkat
- Laporan Analisis KationDokumen5 halamanLaporan Analisis KationIrma WahonganBelum ada peringkat
- Identifikasi Kation Golongan II (Teori)Dokumen8 halamanIdentifikasi Kation Golongan II (Teori)AdeFriscaDianaII100% (4)
- Kimia AnalisisDokumen17 halamanKimia AnalisisJuan LambeyBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion Ira JaperDokumen23 halamanMakalah Analisis Kualitatif Kation Dan Anion Ira JaperFauziahBelum ada peringkat
- Reaksi Terhadap KationDokumen30 halamanReaksi Terhadap KationRegarian SoganiBelum ada peringkat
- Warna Warni Ilustrasi Sains PresentasiDokumen25 halamanWarna Warni Ilustrasi Sains Presentasialexandria sonBelum ada peringkat
- Draft Pemisahan Golongan IV Dan V (Kimia Analisa) PrintDokumen12 halamanDraft Pemisahan Golongan IV Dan V (Kimia Analisa) PrintFaisal RahmadBelum ada peringkat
- Reaksi Identifikasi Kation DataDokumen72 halamanReaksi Identifikasi Kation DataLaurenBelum ada peringkat
- Pemisahan Kation Jane Ila NunukDokumen22 halamanPemisahan Kation Jane Ila Nunukjane nizar rahmanBelum ada peringkat
- Golongan 2Dokumen10 halamanGolongan 2Beby HapsariBelum ada peringkat