Mekanisme Menstruasi
Diunggah oleh
Hendra Brahmantyo RatsmanandaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Mekanisme Menstruasi
Diunggah oleh
Hendra Brahmantyo RatsmanandaHak Cipta:
Format Tersedia
BAB 1 PENDAHULUAN
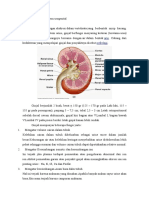
Menstruasi adalah perdarahan vagina secara berkala akibat terlepasnya lapisan endometrium uterus. Fungsi menstruasi normal merupakan hasil interaksi antara hipotalamus, hipofisis, dan ovarium dengan perubahan-perubahan terkait pada jaringan sasaran pada saluran reproduksi normal, ovarium memainkan peranan penting dalam proses ini, karena tampaknya bertanggung jawab dalam pengaturan perubahan-perubahan siklik maupun lama siklus menstruasi. Menstruasi terjadi sebagai akibat dari remodelling jaringan yang terjadi setiap bulan pada wanita usia reproduktif. Setelah penghentian hormon steroid, lapisan fungsional dari endometrium mengalami berbagai macam perubahan yang akan menyebabkan kerusakan jaringan total. Pada tiap siklus menstruasi, endometrium mengalami peluruhan dan regenerasi. Menstruasi hanya terjadi pada beberapa hewan yang memiliki plasentasi hemokhorial. Pada plasentasi hemochorial, trophoblas menginvasi pembuluh darah maternal dan villi chorionic yang berhubungan langsung dengan darah maternal. Pada kehamilan, di bawah pengaruh progesteron, stroma endometrium mengalami desidualisasi yang luas. Desidualisasi membatasi invasi tropoblas; namun demikian, perlindungan dari tropoblas yang invasif membutuhkan penghalang yang pada akhirnya akan menyebabkan diferensiasi terminal. Keadaan diferensiasi ini hanya dapat diperbaharui melalui regenerasi sel progenitor yang terletak di dalam lapisan basal dari endometrium. Pemahaman mengenai fisiologi endometrium yang normal diperlukan untuk memahami gangguan-gangguan menstruasi.
BAB 2 FISIOLOGI MENSTRUASI
Pada siklus menstruasi normal, terdapat produksi hormon-hormon yang paralel dengan pertumbuhan lapisan rahim untuk mempersiapkan implantasi dari janin (proses kehamilan). Gangguan dari siklus menstruasi tersebut dapat berakibat gangguan kesuburan, abortus berulang, atau keganasan. Gangguan dari siklus menstruasi merupakan salah satu alasan seorang wanita berobat ke dokter. Siklus menstruasi normal berlangsung selama 21-35 hari, 2-8 hari adalah waktu keluarnya darah haid yang berkisar 20-60 ml per hari. Penelitian menunjukkan wanita dengan siklus mentruasi normal hanya terdapat pada 2/3 wanita dewasa, sedangkan pada usia reproduksi yang ekstrim (setelah menarki <pertama kali terjadinya menstruasi> dan menopause) lebih banyak mengalami siklus yang tidak teratur atau siklus yang tidak mengandung sel telur. Siklus mentruasi ini melibatkan kompleks hipotalamus-hipofisis-ovarium.
Gambar 1. Kompleks Hipotalamus-Hipofisis-Ovarium
2.1 Siklus Menstruasi Normal Siklus menstruasi normal dapat dibagi menjadi 2 segmen yaitu, siklus ovarial dan siklus uterus. Siklus ovarial terbagi lagi menjadi 2 bagian, yaitu siklus
folikular dan siklus luteal, sedangkan siklus uterus dibagi menjadi masa proliferasi dan masa sekresi. Perubahan di dalam rahim merupakan respon terhadap perubahan hormonal. Uterus terdiri dari 3 lapisan yaitu perimetrium (lapisan terluar), miometrium (lapisan tengah), dan endometrium (lapisan terdalam). Endometrium adalah lapisan yangn berperan di dalam siklus menstruasi. 2/3 bagian endometrium disebut desidua fungsionalis yang terdiri dari kelenjar, dan 1/3 bagian terdalamnya disebut sebagai desidua basalis.
2.2 Sistem hormonal yang mempengaruhi siklus menstruasi adalah: 1. FSH-RH yang dikeluarkan hipotalamus untuk merangsang hipofisis
mengeluarkan FSH 2. LH-RH yang dikeluarkan hipotalamus untuk merangsang hipofisis
mengeluarkan LH 3. PIH yang menghambat hipofisis untuk mengeluarkan prolaktin
Gambar 2. Siklus Hormonal
Pada setiap siklus menstruasi, FSH yang dikeluarkan oleh hipofisis merangsang perkembangan folikel- folikel di dalam ovarium. Pada umumnya hanya satu folikel yang terangsang namun perkembangan dapat menjadi lebih dari satu, dan folikel tersebut berkembang menjadi folikel de graaf yang membuat
estrogen. Estrogen ini menekan produksi FSH, sehingga hipofisis mengeluarkan hormon yang kedua yaitu LH. Produksi hormon LH maupun FSH berada di bawah pengaruh releasing hormones yang disalurkan hipotalamus ke hipofisis. Penyaluran RH dipengaruhi oleh mekanisme umpan balik estrogen terhadap hipotalamus. Produksi hormon gonadotropin (FSH dan LH) yang baik akan menyebabkan pematangan dari folikel de graaf yang mengandung estrogen. Estrogen mempengaruhi pertumbuhan dari endometrium. Di bawah pengaruh LH, folikel de graaf menjadi matang sampai terjadi ovulasi. Setelah ovulasi terjadi, dibentuklah korpus rubrum yang akan menjadi korpus luteum, di bawah pengaruh hormon LH dan LTH. Korpus luteum menghasilkan progesteron yang dapat mempengaruhi pertumbuhan kelenjar endometrium. Bila tidak ada pembuahan maka korpus luteum berdegenerasi dan mengakibatkan penurunan kadar estrogen dan progesteron. Penurunan kadar hormon ini menyebabkan degenerasi, perdarahan, dan pelepasan dari endometrium. Proses ini disebut haid atau menstruasi. Apabila terdapat pembuahan dalam masa ovulasi, maka korpus luteum tersebut dipertahankan. Pada tiap siklus endometrium dikenal 3 masa utama yaitu: Masa menstruasi yang berlangsung selama 2-8 hari. Pada saat itu endometrium dilepaskan sehingga timbul perdarahan dan hormon-hormon ovarium berada dalam kadar paling rendah Masa proliferasi dari berhenti darah menstruasi sampai hari ke-14. Setelah menstruasi berakhir, dimulailah fase proliferasi dimana terjadi pertumbuhan dari desidua fungsionalis untuk mempersiapkan uterus untuk perlekatan fetus. Pada fase ini endometrium tumbuh kembali. Antara hari ke-12 sampai 14 dapat terjadi pelepasan sel telur dari indung telur (disebut ovulasi) Masa sekresi. Masa sekresi adalah masa sesudah terjadinya ovulasi. Hormon progesteron dikeluarkan dan mempengaruhi pertumbuhan
endometrium untuk membuat kondisi uterus siap untuk implantasi. Siklus ovarium : 1. Fase folikular. Pada fase ini hormon reproduksi bekerja mematangkan sel telur yang berasal dari satu folikel kemudian matang pada pertengahan siklus dan siap untuk proses ovulasi (pengeluaran sel telur dari indung telur). Waktu ratarata fase folikular pada manusia berkisar 10-14 hari, dan variabilitasnya
mempengaruhi panjang siklus menstruasi keseluruhan. 2. Fase luteal. Fase luteal adalah fase dari ovulasi hingga menstruasi dengan jangka waktu rata-rata 14 hari. Siklus hormonal dan hubungannya dengan siklus ovarium serta uterus di dalam siklus menstruasi normal: 1. Setiap permulaan siklus menstruasi, kadar hormon gonadotropin (FSH, LH) berada pada level yang rendah dan sudah menurun sejak akhir dari fase luteal siklus sebelumnya. 2. Hormon FSH dari hipotalamus perlahan mengalami peningkatan setelah akhir dari korpus luteum dan pertumbuhan folikel dimulai pada fase folikular. Hal ini merupakan pemicu untuk pertumbuhan lapisan endometrium. 3. Peningkatan level estrogen menyebabkan feedback negatif pada pengeluaran FSH hipofisis. Hormon LH kemudian menurun sebagai akibat dari peningkatan level estradiol, tetapi pada akhir dari fase folikular level hormon LH meningkat drastis ( respon bifasik ). 4. Pada akhir fase folikular, hormon FSH merangsang reseptor (penerima) hormon LH yang terdapat pada sel granulosa, dan dengan rangsangan dari hormon LH, keluarlah hormon progesteron. 5. Setelah perangsangan oleh hormon estrogen, hipofisis LH terpicu yang menyebabkan terjadinya ovulasi yang muncul 24-36 jam kemudian. Ovulasi adalah penanda fase transisi dari fase proliferasi ke sekresi, dari folikular ke luteal. 6. Kadar estrogen menurun pada awal fase luteal dari sesaat sebelum ovulasi sampai fase pertengahan, dan kemudian meningkat kembali karena sekresi dari korpus luteum. 7. Progesteron meningkat setelah ovulasi dan dapat merupakan penanda bahwa sudah terjadi ovulasi. 8. Kedua hormon estrogen dan progesteron meningkat selama masa hidup korpus luteum dan kemudian menurun untuk mempersiapkan siklus berikutnya
Gambar 3. Siklus Menstruasi Normal
2.3 Dating Endometrium Untuk menentukan hari yang tepat dari siklus menstruasi disebut dating endometrium. Dating dilakukan pada masa sekresi, oleh karena berbeda dari fase proliferasi, fase ini menunjukkan perubahan perubahan yang nyata setiap harinya dengan perubahan morfologi tertentu. Jika siklus haid 28 hari dan perkiraan ovulasi terjadi pada hari ke 14, maka 36 48 jam setelah ovulasi belum terlihat perubahan yang menonjol pada endometrium. Karena itu dating hari ke 14 dan ke 15 tidak berguna dilakukan, dan sebaliknya baru dilakukan pada hari ke 16. Hari ke 16 : Vakuola basal subnukleus terlihat pada banyak kelenjar. Hari ini hari terahir pseudostratifikasi barisan inti. Terlihat mitosis pada kelenjar kelenjar dan stroma. Hari ke 17 : Nukleus dari kelenjar kelenjar tersusun dalam satu baris, dengan sitoplasma yang homogen diatasnya dan vakuola yang besar besar di bawahnya. Pseudostratifikasi menghilang, mitosis di kelenjar dan stroma jarang. Hari ke 18 : Sebagian vakuola mengecil karena sebagian isinya dilepaskan ke arah sitoplasma sekitar lumen dan kemudian termasuk ke dalam lumen. Karena vakuola subnukleus ini mengecil maka nukleus mendekati basis dari sel. Tidak terlihat mitosis pada saat ini. Hari ke 19 : Hanya sebagian kecil vakuola terlihat. Sepintas lalu gambarannya menyerupai hari ke 16. Dapat terlihat sekresi intraluminal. Tidak terdapat pseudostratifikasi dan mitosis. Hari ke 20 : Vakuola subnukleus hanya satu satu. Sekresi intraluminal tampak jelas. Hari ke 21 : Mulai terlihat perubahan perubahan pada stroma. Sel sel stroma mempunyai nukleus yang gelap dan padat. Mulai adanya edema stroma. Hari ke 22 : Edema stroma mencapai maksimum. Sel sel stroma tampak kecil, padat. Mulai terlihat arteri spiralis dengan dindingnya yang tipis. Sekresi intaluminal aktif, tetapi mulai berkurang. Hari ke 23 : Edema stroma menetap. Kondensasi stroma pada sekitar arteri spiralis. Dapat juga dijumpai mitosis. Hari ke 24 : Kumpulan sel sel pradesidua tampak jelas disekeliling arteriola. Mitosis aktif, edema berkurang. Endometrium akan mulai berinvolusi, kecuali terjadi kehamilan.
Hari ke 25 : Sel sel pradesidua mulai terdapat di bawah sel sel epitel permukaan. Sedikit edema sekitar arteriola. Sedikit infiltrasi limfosit pada stroma. Hari ke 26 : Sel sel pradesidua mengelompok di seluruh stroma disertai infiltrasi sel sel leukosit polinuklear. Hari ke 27 : Pradesidua menonjol sekitar pembuluh darah dan di bawah epitel permukaan. Jelas terlihat infiltrasi sel sel leukosit polinuklear. Hari ke 28 : Mulai terlihat daerah dengan nekrosis (fokal nekrosis), dan daerah daerah kecil dengan perdarahan dalam stroma. Infiltrasi sel sel leukosit polinuklear sangat banyak. Kelenjar kelenjar kelihatan mengalami secretory exhaustion. 2.4 Darah menstrual Siklus menstruasi terjadi pada manusia dan primata yang lain. Menstruasi merupakan sebuah fase dari siklus menstruasi dimana endometrium mengalami peluruhan. Menstruasi normalnya berlangsung selama beberapa hari (3-5 hari). Rata-rata darah yang hilang selama menstruasi adalah 35 ml. untuk mengkultur sel yang berasal dari darah menstrual, darah menstrual diambil pada hari pertama menstruasi, karena menstruasi pada hari pertama ini mengandung banyak sel dan jaringan yang tercampur dengan darah karena peluruhan endometrium (Gambar 4). Siklus menstruasi dikontrol oleh sistem hormonal. Selama fase proliferasi, endometrium mengalami penebalan yang dirangsang oleh peningkatan kadar estrogen. Folikel di dalam ovarium mulai berkembang karena pengaruh hormon-hormon. Setelah beberapa hari, satu atau terkadang dua folikel akan menjadi dominan. Folikel yang dominan akan merilis ovum atau telur pada proses ovulasi. Setelah ovulasi, folikel dominan yang tersisa di dalam ovarium akan menjadi corpus luteum. Korpus ini memiliki fungsi utama yaitu memproduksi sejumlah besar progesteron. Dengan adanya progesteron, endometrium siap untuk implantasi embrio. Bila implantasi tidak terjadi dalam waktu 2 minggu, korpus luteum akan mati, sehingga kadar progesteron dan estrogen menurun tajam. Penurunan kadar hormon ini menyebabkan uterus luruh sehingga terjadilan menstruasi.
Gambar 4. Transdiferensiasi myogenik dari sel-sel yang berasal dari darah menstrual. Darah menstrual, yang daimbil pada hari pertama menstruasi, mengandung banyak sel dan jaringan yang tercampur dengan darah karena peluruhan endometrium.
BAB 3 ENDOMETRIUM SELAMA PROSES MENSTRUASI
3.1 Struktur endometrium Darah menstrual mengandung sel atau jaringan dari lapisan fungsional endometrium. Lapisan ini terbentuk setelah akhir masa menstruasi. Proliferasi diinduksi oleh progesteron (fase proliferasi dari siklus menstruasi), dan selanjutnya terjadi peningkatan kadar progesteron dari corpus luteum (fase sekretori). Tidak adanya progesteron menyebabkan konstriksi arteri yang menyuplai darah ke lapisan fungsional, sehingga sel di dalam lapisan ini mengalami iskemia dan mati. Hal ini menyebabkan terjadinya menstruasi. Sebaliknya, lapisan basal, di dekat myometrium dan di bawah lapisan fungsional, tidak mengalami peluruhan selama siklus menstruasi. Secara histologis, endometrium fungsional terdiri dari selapis epitel kolumnar yang berada di atas lapisan jaringan ikat. Lapisan jaringan ikat ini memiliki ketebalan yang bervariasi sesuai dengan pengaruh hormonal stroma. Kelenjar uterus tubular sederhana mencapai dasar stroma melalui permukaan endometrium, yang juga
mendapatkan banyak darah dari arteri spiralis. Endometrium terdiri dari lapisan basal dan fungsional. Lapisan basal berada di dalam dan dekat dengan myometrium, sementara lapisan fungsional merupakan dua pertiga dari endometrium bagian superfisial. Lapisan fungsional terdiri dari stratum compactum dan stratum spongiosum. Stratum compactum merupakan lapisan superfisial tipis dengan leher kelenjat dan stroma yang padat, sementara stratum spongiosum merupakan bagian dalam dari lapisan fungsional yang terdiri dari kelenjar dan stroma yang longgar. Hanya lapisan fungsional dari endometrium yang mengalami peluruhan pada tiap siklus. Lapisan basal mengandung sel progenitor yang me-regenerasi lapisan fungsional pada tiap siklus. Jaringan endometrium berrespons terhadap hormon steroid seks yang dihasilkan di pada fase flikular dan fase luteal dari siklus ovarium. Siklus menstruasi terbagi menjadi fase proliferatif dan fase sekretori. Perbedaan sitoarsitektural dan molekular antar kedua fase ini mencerminkan respons endometrium terhadap perubahan siklis dari paparan hormon ovarium.
10
Selama siklus haid, endometrium mengalami beberapa perubahan histologis dan sitologis. Lapisan basalis dekat miometrium, hanya sedikit mengalami perubahan selama siklus haid dan tidak ikut terlepas saat haid. Dari lapisan basalis ini akan terbentuk lapisan intermedial yaitu spongiosum dan lapisan superfisial yaitu kompaktum, kedua lapisan ini terlepas saat haid. Dibawah pengaruh estrogen dengan IGF-I sebagai mediator parakrin, kelenjar endometrium pada kedua lapisan ini mengalami proliferasi selama fase folikuler, sehingga bertambah tebal. Selama fase luteal, kelenjar menjadi bekelok-kelok dibawah pengaruh progesteron, dengan IGF-II dicurigai sebagai mediator parakrin. Endometrium menjadi oedematous dan vaskularisasi semakin
meningkat. Dengan menurunnya estrogen dan progesteron pada fase luteal, maka endometrium dan pembuluh darah akan mengalami nekrosis, dan akhirnya terjadi perdarahan haid. Tampaknya sekresi prostaglandin yang memulai vasospasme dan iskemik pada endometrium, dan juga kontraksi uterus yang sering terjadi bersamaan dengan haid. Aktivitas fibrinolitik di endometrium juga mengalami peningkatan selama haid, ini menjelaskan kenapa darah haid tidak mengalami penggumpalan pada haid yang normal.
3.2 Fase proliferatif Lapisan fungsional (2/3 atas) dari endometrium mengalami peluruhan pada tiap siklus menstruasi. Pada akhir masa menstruasi, lapisan endometrium memiliki ketebalan sekitar 2 mm dan terdiri dari sel epitel yang berasal dari kelenjar di lapisan basal dan bermigrasi ke permukaan endometrium. Lapisan basal tipis berepitel yang dapat ditemukan pada awal siklus menstruasi serupa dengan sitoarsitektur endometrium dari wanita post menopause dan wanita dengan amenorrhea hipotalamikus. Perbaikan awal dari permukaan
endometrium, suatu proses penting dalam regenerasi, terjadi sebelum akhir masa menstruasi dan sebelum peningkatan estradiol. Penambahan ketebalan endometrium tidak berhenti hingga proses ini selesai. Estradiol, yang diproduksi oleh ovarium pada hari ke-4 atau 5 siklus, menginduksi pertumbuhan dan proliferasi endometrium. Sel epitel dan stroma mengalami mitosis dan multiplikasi, sehingga panjang kelenjar semakin
11
bertambah dan sel stroma berkembang dan memperluas matriks ekstraselular. Beberapa sel epitel permukaan yang umum ditemukan di dekat ostium tuba dan endoserviks menjadi bersilia pada waktu ini. Pertumbuhan endometrium dapat dimonitor dengan menggunakan ultrasound, yang diukur dari total lebar permukaan epitel endometrium (disebut juga dengan trilaminar endometrial stripe). Pertumbuhan endometrium
berlangsung cepat pada hari ke-4 atau 5 siklus. Ketebalan endometrium pada hari ke-4 siklus adalah sekitar 4.5mm dan meningkat secara linier hingga 10 mm pada hari ke-9 atau 10. Pertumbuhan endometrium terhenti sebelum kadar estradiol mencapai puncaknya dan sebelum onset fase sekretori produksi estrogen. Hal ini menunjukkan bahwa faktor-faktor non steroid membatas pertumbuhan endometrium. Amenorrhea pada beberapa wanita disebabkan oleh anovulasi kronis, yang mungkin terjadi karena paparan estrogen dan gangguan pertumbuhan endometrium. Meskipun beberapa wanita yang mengalami anovulasi memiliki endometrium yang lebih tebal, mereka tidak mengalami pertumbuhan jaringan endometrium yang cepat dan kontinu pada fase proliferatif, seperti pada wanita normal. Pertumbuhan endometrium terbatas dan ketebalan umumnya adalah 11 mm. paparan estrogen tidak cukup untuk mendukung pertumbuhan
endometriumyang kontinu. Hal ini menunjukkan adanya faktor-faktor yang membatas proliferasi endometrium. Mekanisme selular yang bertanggungjawab untuk disfungsi pertumbuhan endometriummasih belum diketahui. namun demikian, patofisiologi dari endometriumpada wanita anovulasi mencerminkan gangguan pengaturan modulator yang bertanggungjawab dalam perbaikan endometriumdan penghentian pertumbuhan; yang mendukung stabilisasi jangka panjang pada kondisi anovulasi atau defisiensi estrogen.
3.3 Fase sekretori Sekresi progesteron setelah ovulasi menyebabkan berhentinya proliferasi epitel endometrium. Reseptor estrogen yang diekspresikan oleh sel epitel endometrium selama fase proliferasi dapat berkurang karena aksi dari progesteron, sehingga efek proliferatif dari estrogen terhambat. Paparan
12
progeseron menyebabkan vakuola sub-nuklear yang kaya-glikogen muncul (hari ke-16) dan menghambat mitosis sel epitel pada hari ke-17. Vakuola menjadi supranuklear pada hari ke-18 dan sekret dapat ditemukan pada lumen kelenjar pada hari ke-19-20. Aktivitas sekretori puncak terjadi pada hari ke 20-21. Perubahan ini sangat penting untuk konsepsi dan pembentukan permukaan endometriumyang tepat untuk perlekatan blastocyst. Progesteron mencetuskan terjadinya perubahan fibroblas stromal yang dicirikan dengan pembesaran selular serta akumulasi laminin dan kolagen tipe 4. Pada fase luteal, kolagen tipe 4 dan laminin terdapat di rongga ekstraselular dari stroma endometrium dan membran basal kelenjar serta dinding pembuluh darah. Meskipun kolagen tipe 1, 3, dan 6, serta laminin terdapat di dalam endometrium selama siklus menstruasi, rasionya berubah karena paparan terhadap progesteron yang terus menerus. Endometriumjuga menghasilkan sejumlah besar prolaktin dan IGF-binding proteins (IGFBP-1). Perubahan ini menyebabkan perubahan yang dramatis di dalam matriks ekstraselular dan produk-produk sekretori dari endometrium, edema stroma terjadi pada hari ke 2023. Dalam beberapa hari sebelum menstruasi stroma terinfiltrasi dengan sel NK, makrofag, dan sel T. sebaliknya, paparan progesteron yang kontinu
menyebabkan atrofi dan penipisan endometrium, penyempitan kelenjar, dan gangguan vaskular yang dicirikan dengan terbentuknya sinusoid dan sel-sel endotel yang hiperplastik. Histologi endometriumini merupakan gambaran khas dari wanita yang mengalami amenorrhea karena paparan progestin yang kronis.
3.4 Pengaturan Pertumbuhan Endometrium Sejumlah faktor pertumbuhan dan hormon steroid ovarium mengatur pertumbuhan endometriumselama siklus menstruasi. 3.4.1 Steroid ovarium Endometrium berrespons terhadap steroid ovarium estrogen dan progesteron; kedua hormon ini adalah satu-satunya sinyal ekstrinsik yang siperlukan untuk terjadinya siklus menstruasi yang normal. Fase proliferatif dari siklus ini terutama dimediasi oleh estrogen.
13
ERa, disebut juga dengan ESR1 dan ERb, disebut juga dengan ESR2 ditranskripsi dari gen-gen yang berbeda dan memiliki pola ekspresi yang berbeda. ESR2 diekspresikan dalam endometrium selama siklus menstruasi. ESR1 bervariasi di sepanjang siklus menstruasi dan diekspresikan oeh sel epitel dan sel stromal selama fase proliferasi. Reseptor estrogen berkurang banyak di dalam epitel setelah pasien diberi paparan progesteron. Selain itu, juga terdapat bukti penelitian yang menemukan bahwa sinyal estrogen ditransmisikan melalui reseptor non-estrogen, termasuk membrane receptor GRP30, namun, temuan ini masih kontroversial. Efek progesteron pada uterus dimediasi melalui PR-A, PR-B, dan PR-C. Masing-masing merupakan suatu protein homolog yang ditranskripsikan dari gen yang sama oleh promoter yang berbeda. Sel epitel dan stromal mengekspresikan PR-A dan PR-B pada fase proliferasi. Pada fase luteal, hanya sel stromal yang mengekspresikan PR-A dan PR-B (PR-A lebih dominan). Sementara ekspresi kedua reseptor berkurang pada sel epitel. Ekspresi PR dalam sel stromal tidak dipengaruhi oleh paparan kronis terhadap agen pro-gestasional jangka panjang.
3.4.2 Faktor pertumbuhan Sejumlah besar faktor pertumbuhan mitogenik disekresikan oleh
endometrium, dan memodulasi kerja steroid seks pada endometrium. Molekul peptida ini dapat mengawali aktivasi jalur intraselular dengan berikatan dengan cognate membrane bound receptor EGF diekspresikan oleh sel epitel selama fase proliferasi dan oleh sel stromal selama fase sekretori. Kadar EGF tetap stabil di sepanjang siklus menstruasi. EGF dapat bersinergi dengan estradiol atau bekerja secara independen untuk merangsang pertumbuhan sel epitel. Stimulasi EGF secara tidak langsung menyebabkan aktivasi ERa. EGF dapat memediasi efek proliferatif pada sel epitel, seperti yang tampak pada endometriumselama fase folikular awal, saat kadar estradiol sangat rendah. TGF, salah satu anggota dari famili EGF, mengikat reseptor yang sama dengan EGF dan kadarnya mencapai puncak pada pertengahan siklus. TGF juga memediasi aksi proliferatif dari estrogen pada endometrium. FGF merupakan sebuah famili yang terdiri dari 9
14
anggota. FGF-1, -2, -4, and -7 diekspresikan pada endometrium manusia. Sel epitel menghasilkan FGF-1 and -2 selama fase proliferatif dan fase sekretori dari siklus menstruasi. Sel stroma mengekspresikan FGF-2 pada fase proliferasi, dimana ekspresi ini menginduksi mitosis dan sintesis DNA.
Gambar 5 Skema dari sistem vaskular endometrium. Endometrium primata terdiri dari stratum basalis (s. basilis) dan stratum fungsionalis (s. fungsionalis). Arteri uterus bercabang dalam myometrium dan menghasilkan arteria racuata dan arteri radialis. Arteri radialis bercabang di dalam s.basilis dan menghasilkan sejumlah arteriol lurus dan spiral di dalam sepertiga bawah endometrium. Arteriol spiral mensuplai darah di s. fungsionalis.
IGF-1 dan -2 dihasilkan oleh sel epitel dan stromal pada kadar tinggi selama siklus menstruasi. Proliferasi fibroblas stroma endometrium diinduksi oleh IGF-1; namun IGF-1 dan -2 juga dapat mendukung terjadinya diferensiasi. Produksi IGF-1 ditingkatkan oleh estradiol dan hal ini memediasi efek estrogen terhadap pertumbuhan endometrium. IGF-2 terlibat dalam diferensiasi sel sebagai respons terhadap efek progesteron. Efeknya dimediasi oleh ikatan dengan IGFBP-1. IGFBP-1 merupakan salah satu dari keenam protein homolog yang memodulasi efek mitogenik dan metabolik dari IGF-1 dan -2. Protein IGFBP-1 dan mRNA terdapat di sel stroma pre-desidua pada fase sekretori akhir dan di sel desidua pada masa kehamilan.
15
Sejumlah sitokin dan faktor pertumbuhan yang lain juga telah ditemukan, seperti KGF, salah satu anggota dari famili FGF. KGF diekspresikan dalam sel stroma selama fase sekretori. Sitokin ini memediasi sinyal epitel-sroma. PDGF disekresikan oleh sel stroma dan platelet. Sitokin ini terletak di sekitar sel stroma dan merangsang proliferasi sel stroma dan angiogenesis. Aktivitas TNF di dalam endometrium meningkat pada fase proliferatif dan sekretori. Sitokin ini memberikan beberapa efek pada pertumbuhan sel. TNFb bersifat mitogenik, angiogenik, immunomodulatori, dan inflamatori. Ketidakseimbangan dari jaringan jalur selular ini akan menimbulkan konsekuensi-konsekuensi yang
mempengaruhi siklus menstruasi dan implantasi, dan/atau meningkatkan kerentanan terhadap neoplasia.
3.5 Pembuluh darah Endometrium Karena menstruasi merupakan remodelling jaringan dimana lapisan dalam kavum uterus mengalami peluruhan secara reguler, pembuluh darah endometrium berperan penting dalam proses regenerasi. Selain pembuluh darah di sistem reproduksi, pembuluh darah di sistem yang lain tidak mengalami regenerasi yang dramatis dan rutin seperti ini. Angiogenesis dan pembentukan sistem mikrovaskulatur di dalam endometrium merupakan kunci dari siklus yang terjadi di endometrium, karena proliferasi dan maturasi endometrium tergantung dari suplai oksigen lokal dan nutrisi ke jaringan.
3.6 Suplai Vaskular Endometrium Arteri arkuata berasal dari arteri uterus yang ada di dalam myometrium. Arteri ini bercabang tepat di perbatasan endometrium dan berkembang menjadi sejumlah arteriol lurus yang mensuplai sepertiga dalam endometrium. Pembuluh darah ini berlanjut menjadi arteriol spiral dan mensuplai dua pertiga bagian fungsional dari endometrium. Pembuluh darah endometrium memiliki banyak sel otot polos dan berubah menjadi kapiler tepat di bawah permukaan endometrium. Venul bermuara ke vena uterus. Skema dari sistem vaskular endometrium dapat ditemukan pada Gambar 5
16
3.7 Pengaturan Pertumbuhan Pembuluh Darah Endometrium Menstruasi menyebabkan pembuluh darah menjadi terbuka, hingga perlu dikoreksi untuk mengontrol perdarahan. Pembuluh darah mengalami regenerasi pada akhir masa menstruasi dan terus berlanjut ke fase proliferasi dari siklus menstruasi. Keseimbangan antar faktor-faktor yang merangsang dan
menghambat angiogenesis akan mengatur proses peluruhan dan regenerasi endometrium. Sejumlah faktor angiogenik telah ditemukan oleh beberapa peneliti, seperti EGF, TGFa, TGFb, TNFa, FGF-1, FGF-2, PDGF, dan VEGF.. Gangguan fungsi pembuluh darah akan menimbulkan kelainan perdarahan uterus. Beberapa faktor spesifik yang terlibat dalam regenerasi endotel endometrium telah diteliti dengan baik. VEGF merupakan molekul sebesar 30-45 kDa yang mengikat heparin dan berpotensi sebagai mitogen. VEGF dianggap berperan penting dalam perkembangan endotel vaskular dan formasi pembuluh darah yang baru. Dari kelima variasi VEGF, VEGF 121 dan 165 merupakan bentuk yang dominan yang mengatur angiogenesis endometrium. VEGF-A dihasilkan di dalam epitel luminal dan kelenjar, serta di dalam stroma pada fase proliferasi. Pada fase sekretori, hanya sel epitel yang terus mengekspresikan VEGF-A. Beberapa penelitian menunjukkan bahwa VEGF diatur secara hormonal. Estradiol dianggap meningkatkan rilis VEGF, namun peranan hormon ovarium dalam pengaturan ekspresi dan fungsi VEGF masih belum jelas.
17
Gambar 6. Faktor pertumbuhan endometrium. Sejumlah besar faktor pertumbuhan (atas) dan reseptor faktor pertumbuhan (bawah) mRNA dan protein pada endometriummanusia selama siklus menstruasi. Kadar yang ditunjukkan ini sesuai dengan kadar pada fase proliferasi awal. CSF-1 colony stimulating factor1; EGF epidermal growth factor; FGF fibroblast growth factor; IGF-1 insulin like growth factor-1; IL-1 interleukin-1; LIF leukemia-inhibiting factor; PDGF plateletderived growth factor; TGF transforming growth factor.
18
3.8 Perubahan desidua menjelang haid Tujuan utama desidualisasi adalah persiapan endometrium untuk menerima implantasi blastokis. Desidualisasi disertai dengan peningkatan sekresi komponen matriks, seperti kolagen, fibronektin dan laminin. Bahan yang dapat mendegranasi matriks seperti MMP-3 dipertahankan dalam kadar rendah oleh progesteron dan mekanisme yang diperantarai IL-1 untuk terjadinya desidualisasi. Perubahan sitokin yang menyokong aktivitas parakrin sel desidua juga terjadi selama proses desidualisasi, sel desidua mensekresi IL-15 yang mana sangat penting untuk pertumbuhan dan perubahan sel NK.
3.9 Fisiologi withdrawal progesteron Withdrawal persiapan progesteron mencegah implantasi dan menghentikan
endometrium untuk kehamilan. Fisiologi withdrawal progesteron
memicu kaskade interaksi molekuler dan seluler yang menghasilkan perdarahan haid. Withdrawal progesteron mengaktifkan mediator inflamasi, yang mempunyai lokasi di perivaskuler, Diantara bahan yang dipicu antara lain kemokin: alfachemokine CXCL8 (IL-8) dan beta-chemokine CCL-2 (monocyte chemotactic peptide-1, MCP-1), dan juga memicu enzim yang bertanggung jawab untuk sintesis prostaglandin, COX-2. Penelitian terdahulu tentang keterkaitan antara prostaglandin dengan haid mendapatkan adanya peningkatan sintesis prostaglandin dan penurunan metabolismenya sebagai respon dari penurunan kadar progesteron. Sintesis prostaglandin melalui COX-2 membantu menjelaskan kerja obat anti inflamasi non steroid dalam gangguan haid. Kerja prostaglandin pada pembuluh darah dan sel-sel disekitarnya didasari oleh karena adanya reseptor prostaglandin yang cukup bermakna pada tempat tersebut. PDGH, adalah enzim yang bertanggung jawab mengubah prostaglandin menjadi metabolit yang inaktif adalah enzim
yang kerjanya tergantung dari progesteron. Penghambatan terhadap kerja progesterone berarti menghambat ekspresi PDGH. Respon lokal dari withdrawal progesteron adalah terjadinya peningkatan konsentrasi PGE2 dan PGF2 alfa dan adanya sinergisme dengan kemokin, CXCL-8. Terdapat migrasi yang bermakna leukosit terdiri dari netrofil, makrofag dan sel hematopoietik lainnya. Terdapat ekspresi CXCL-8 yang luas di endometrium manusia, kemokin ini merupakan
19
signal kemotaktik utama untuk masuknya netrofil ke dalam endometrium. Sudah diketahui bahwa kontraksi miometrium dan vasokonstriksi dapat diakibatkan oleh peningkatan dari PGF2 alfa, sebagai akibat dari withdrawal progesteron. Akibat dari vasokonstriksi arteri spiralis maka akan terjadi hipoksia. Hipoksia adalah induktor yang poten terhadap munculnya VEGF yaitu factor yang meningkatkan reaksi angiogenik dan permeabilitas vaskuler. Withdrawal progesteron telah dilaporkan meningkatkan ekspresi reseptor VGEF tipe 2, kinase domain reseptor (KDR) pada stroma endometrium. Pro-MMP-1 juga meningkatkan akibat dari withdrawal progesteron. Jadi VEGF-KDR-MMP merupakan komponen yang penting dalam proses haid.
Gambar 7. Fisiologi withdrawal progesterone
20
BAB 4 KESIMPULAN
Endometrium, tempat implantasi embrio, mengalami peluruhan setiap bulan pada siklus menstruasi. Seorang wanita umumnya akan mengalami 500 siklus menstruasi sepanjang hidupnya. Gangguan menstruasi merupakan masalah yang umum ditemukan dan merupakan salah satu indikasi perawatan medis pada wanita usia reproduktif. Proses menstruasi yang normal
membutuhkan pengaturan degradasi jaringan, pengontrolan perdarahan, dan hemostasis yang normal. Pemahaman mengenai mekanisme yang mendasari proses ini diperlukan untuk memahami dasar dan terapi untuk kelainan ini. Siklus menstruasi normal pada manusia dapat dibagi menjadi dua yaitu siklus ovarium dan siklus uterus. Siklus ovarium sendiri dapat dibagi menjadi fase follikuler dan fase luteal. Siklus endometrium terdiri dari 4 fase yaitu, fase menstruasi, fase post menstruasi, fase intermenstruum dan fase pramenstruum. Faktor endokrin yang mempengaruhi siklus menstruasi dipengaruhi lewat sistem korteks serebri, hipofisis, ovarium dan rangsangan ekstern. Kelenjar hipofisis tidak dapat membentuk dan mengeluarkan hormon gonadotropin tetapi harus dipengaruhi oleh hipotalamus, hipotalamus sendiri juga dipengaruhi oleh korteks serebri dan faktor faktor ekstern.
21
DAFTAR PUSTAKA
A Ferenczy.1979. Diagnostic electron microscopy in gynecologic pathology. Pathol Annu 14(1): 353381 A Ferenczy.1979. Regeneration of the human endometrium. In: Fenoglio CM, Wolff M (eds) Progress in surgical pathology. Mason, New York, pp 157172 Abberton KM, Taylor NH, Healy DL. 1996. Vascular smooth muscle a-actin distribution around endometrial arterioles during the menstrual cycle: increased expression during the perimenopause and lack of correlation with menorrhagia. Hum Reprod 11:204211 AM Goodger, PAW Rogers. 1994. Endometrial endothelial cell proliferation during the menstrual cycle. Hum Reprod 9:399405 Chan RW, Gargett Ce. 2006. Identification of label-retaining cells in mouse endometrium. Stem Cells 24:15291538 Charnock-Jones DS, Sharkey AM, Rajput-Williams J, et al. 1993. Identification and localization of alternately spliced mRNAs for vascular endothelial growth factor in human uterus and estrogen regulation in endometrial carcinoma cell lines. Biol Reprod 48:11201128 Chwalisz K, Garfield Re. 2000. Role of nitric oxide in implantation and menstruation. Hum Reprod 15:96111 Collett GP, Kohnen G, Campbell S, Davenport AP, Jeffers MD, Cameron IT. 1996. Localization of endothelin receptors in human uterus throughout the menstrual cycle. Mol Hum Reprod 2:439444 DX Wen, YF XU, Mais De, et al. 1994. The A and B isoforms of the human progesterone receptor operate through distinct signaling pathways within target cells. Mol Cell Biol 14:83568364 Esch F, Ueno N, Baird A. 1985. Primary structure of bovine brain acidic fibroblast growth factor (FGF). Biochem Biophys Res Commun 133:554562 F Casanas-Roux, M Nisolle, Marbaix, et al.1996. Morphometric, immunohistological and three-dimensional evaluation of the endometrium of menopausal women treated by oestrogen and crinone, a new slow release vaginal progesterone. Hum Reprod 11:357363 Ferenczy A. 1987. In: Blausteins pathology of the genital tract. Springer, New York, pp 257291 Ferrara N, Henzel WJ. 1989. Pituitary follicular cells secrete a novel heparinbinding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun 161:851858 Ferriani RA, Charnock-Jones DS, Prentice A, et al. 1993. Immunohistochemical localization of acidic and basic fibroblast growth factors in normal
22
human endometrium and endometriosis and the detection of their mRNA by polymerase chain reaction. Hum Reprod 8:1116 FJ Cornillie, JM Lauweryns, IA Brosens.1985. Normal human endometrium: an ultra structural survey. Gynecol Obstet Invest 20:113129 Folkman J, DAmore PA. 1996. Blood vessel formation: what is its molecular basis? Cell 87:11531155 Fong GH, Rossant J, Gertsenstein M, et al. 1995. Role of the Flt-1 receptor tyrosine kinase in regulating the assembly of vascular endothelium. Nature 376:6670 H Wang, HOD Critchley, RW Kelly, et al. 1998. Progesterone receptor subtype B is differen- tially regulated in human endometrial stroma. Mol Hum Reprod 4:407412 Hanahan D. 1997. Signaling vascular morphogenesis and maintenance. Science 277:4850 Hey NA, Li TC, Devine PL et al.1995. MUC1 in secretory phase endometrium: expression in precisely dated biopsies and flushings from normal and recurrent miscarriage patients. Hum Reprod 10:26552662 HJ Church, LM Vicovac, JDL Williams, et al. 1996. Laminins 2 and 4 are expressed by human decidual cells. Lab Invest 74:2132 HOD Critchley, KM Abberton, NH Taylor, et al. 1994. Endometrial sex steroid receptor expression in women with menorrhagia. Br J Obstet Gynecol 101:428434 Ignar-Trowbridge DM, Teng CT, Ross KA, et al. 1993. Peptide growth factors elicit estrogen receptor-dependent transcriptional activation of an estrogen-responsive element. Mol endocrinol 7:992998 Irwin JC, De Las Fuentes L, Dsupin BA, et al. 1993. Insulin-like growth factor regulation of human endometrial stromal cell function: coordinate effects of insulin-like growth factor binding protein-1, cell proliferation and prolactin secretion. Regul Pept 48:165177 JD Aplin, AK, Charlton, S Ayad. 1988. An immunohistochemical study of human endometrial extracellular matrix during the menstrual cycle and first trimester of pregnancy. Cell Tissue Res 253:231240 JG Bromer, Aldad TS, Taylor HS.2009. Defining the proliferative phase endometrial defect. Fertil Steril 91(3):698704 JM Rey, P Pujol, H Dechaud, et al. 1998. Expression of oestrogen receptor-alpha splicing variants and oestrogen receptor beta in endometrium of infertile patients. Mol Hum Reprod 4:641647 Kech PJ, Hauser SD, Krivi G, et al. 1989. Vascular permeability factor, an endothelial cell mitogen related to platelet-derived growth factor. Science 246:13091312 KG Nelson, T Takahashi, NL Bossert, et al. 1991. Epidermal growth factor replaces estrogen in the stimulation of female genital-tract growth and differentiation. Proc Natl Acad Sci U S A 88:2125 Klauber N, Rohan RM, Flynn e, et al. 1997. Critical components of the female
23
reproductive pathway are suppressed by the angiogenesis inhibitor AGM-1470. Nat Med 3:443446 Krikun G, Schatz F, Lockwood CJ. 2004. Endometrial angiogenesis: from physiology to pathology. Ann N Y Acad Sci 1034:2735 Leung DW, Cachianes G, Kuang WJ, et al. 1989. Vascular endothelial growth factor is a secreted angiogenic mitogens. Science 246:13061309 Li TC, Rogers AW, Dockery P, et al.1988. A new method of histologic dating of human endometrium in the luteal phase. Fertil Steril 50:5260 Li XF, Gregory J, Ahmed A. 1994. Immunolocalisation of vascular endothelial growth factor in human endometrium. Growth Factors 11:277282 LL Wei, NL Krett, MD Francis, et al. 1988. Multiple human progesterone receptor messenger ribonucleic acids and their auto regulation by progestin agonists and antagonists in breast cancer cells. Mol endocrinol 2:62 72 Lockwood CJ, Krikun G, Hausknecht V, Wang eY, Schatz F. 1997. Decidual cell regulation of hemostasis during implantation and menstruation. Ann N Y Acad Sci 828:188193 Lockwood CJ, Schatz F. 1996. A biological model for the regulation of periimplantational hemostasis and menstruation. J Soc Gynecol Investig 3(4):159165 M Iwahashi, Y Muragaki, A Ooshima, et al. 1996. Alterations in distribution and composition of the extracellular matrix during decidualization of the human endometrium. J Reprod Fertil 108:147155 Markee Je. 1940. Menstruation in intraocular endometrial transplants in the rhesus monkey. Contrib embryol Carnegie Inst 28:219308 Matsui H, Taga M, Kurogi K, et al. 1997. Gene expression of keratinocyte growth factor and its receptor in the human endometrium/decidua and chorionic villi. endocr J 44:867871 P Dockery, TC Li, AW Rogers, et al.1988. The ultrastructure of the glandular epithelium in the timed endometrial biopsy. Hum Reprod 3:826834 Presta M. 1988. Sex hormones modulate the synthesis of basic fibroblast growth factor in human endometrial adenocarcinoma cells: implications for the neovascularization of normal and neoplastic endometrium. J Cell Physiol 137:593597 Ramsey eM. 1982. In: Biology of the uterus. Plenum Press, New York, pp 5976 ReB Haining, IT Cameron, C Van Papendorp, et al. 1991. Epidermal growth factor in human endometrium: proliferative effects in culture and immunocytochemical localization in normal and endometriotic tissues. Hum Reprod 6:12001205 ReB Haining, JP Schofield, DSC Jones, et al. 1991. Identification of mRNA for epidermal growth factor and transforming growth factor a present in low copy number in human endometrium and decidua using reverse transcriptase polymerase chain reaction. J Mol endocrinol 6:207214 Rogers PA, Abberton KM. 2003. Endometrial arteriogenesis: vascular smooth
24
muscle cell proliferation and differentiation during the menstrual cycle and changes associated with endo- metrial bleeding disorders. Microsc Res Tech 60:412419 Roy RN, Cecutti A, Gerulath AH, et al. 1997. Endometrial transcripts of human insulin-like growth factors arise by differential promoter usage. Mol Cell endocrinol 135:1119 Sangha RK, Xiao Feng L, Shams M, et al. 1997. Fibroblast growth factor receptor 1 is a critical component for endometrial remodeling: localization and expression of basic fibroblast growth factor and FGF R1 in human endometrium during the menstrual cycle and decreased FGF R1 expression in menorrhagia. Lab Invest 77:389402 Shalaby F, Rossant J, Yamaguchi TP, et al. 1995. Failure of blood island formation and vasculogenesis in Flk 1 deficient mice. Nature 376:62 66 Siegfried S, Pekonen F, Nyman T, et al. 1997. Distinct patterns of expression of keratinocyte growth factor and its receptor in endometrial carcinoma. Cancer 79:11661171 Smith SK. 1989. Prostaglandins and growth factors in the endometrium. Baillieres Clin Obstet Gynaecol 3:249270 TF Ogle, D Dai, P George, et al. 1998. Regulation of the progesterone receptor and estrogen receptor in decidua basalis by progesterone and estradiol during pregnancy. Biol Reprod 58:11881198 Wang GL, Semenza GL. 1993. Characterization of hypoxia-inducible factor 1 and regulation of DNA binding activity by hypoxia. J Biol Chem 268:2151321518 Wilkinson N, Buckley CH, Chawner L, et al.1990. Nucleolar organizer regions in normal, hyperplastic and neoplastic endometria. Int J Gynecol Pathol 9:5559
25
Potensi myogenik dari sel-sel yang berasal dari darah menstrual Sel-sel yang berasal dari darah menstrual manusia (Gambar 1) memiliki kapasitas untuk memperbaharui diri sendiri sepanjang minimal 25 Population Doublings (PDs) (9 passage) selama lebih dari 60 hari, dan berhenti membelah sebelum 30 PD. berhentinya pembelahan sel ini disebabkan oleh pemendekan telomere. Sel-sel yang didapat dari pasien usia muda memiliki masa hidup yang lebih panjang daripada pasien yang lebih tua. Sel-sel yang berasal dari darah menstrual memiliki kemampuan replikasi yang sangat tinggi, sama dengan sel progenitor yang dapat memperbaharui diri sendiri dalam jangka panjang. Sel ini juga memiliki kecepatan pertumbuhan yang lebih tinggi daripada sel-sel fetus atau sel-sel stroma yang berasal dari sumsum tulang. Di samping kecepatan pertumbuhannya yang tinggi, masa hidup sel darah menstrual relatif lebih singkat daripada sel fetus. Hal ini disebabkan oleh panjang telomere yang lebih pendek pada sel dewasa. Sel-sel yang berasal dari darah menstrual dapat
bertransdiferensiasi menjadi myoblas/myosit. Potensi myogenik dari sel-sel ini lebih besar daripada yang diperkirakan sebelumnya. Ekspresi MyoD, desmin, dan myogenin, petanda untuk diferensiasi myogenik skeletal, menunjukkan bahwa sel-sel ini memiliki potensi myogenik. Diferensiasi myogenik dari sel-sel yang berasal dari darah menstrual mengingatkan kita pada tumor Mullerian campuran di endometrium. Tumor ini mengandung elemen stroma dan epitel. Elemen stroma cenderung berdiferensiasi menjadi berbagai macam komponen mesodermal, termasuk sel otot lurik. Bagian kaudal dari saluran Mullerian berkembang menjadi uterus dan vagina bagian atas dalam embriogenesis manusia. Diferensiasi divergen, meliputi myogenesis sel-sel menstrual,
mencerminkan plastisitas dari sel-sel Mullerian yang primitif. Sel-sel yang berasal dari darah menstrual memiliki dua kelompok sel yang berbeda secara morfologis: sel kecil seperti kumparan dan sel besar seperti tongkat (Gambar 1). Petanda dari sel-sel yang berasal dari darah menstrual di permukaan dapat dihitung dengan analisis sitometrik. Sel-sel ini positif untuk CD13, CD29, CD44, CD54, CD55, CD59, CD73, CD90, dan CD105, yang menunjukkan bahwa sel yang mengalami proliferasi dan propagasi mengekspresikan petanda-petanda sel di permukaan. Sel-sel yang berasal dari darah menstrual tidak mengekspresikan petanda jalur hematopoietik, seperti CD34 ataupun antigen monosit-makrofag
26
seperi CD14 (petanda untuk makrofag dan sel dendritik), dan CD45 (leukocyte common antigen). Kurangnya ekspresi CD14, CD34, atau CD45 menunjukkan bahwa sel ini bukanlah sel hematopoietik. Sel-sel ini juga tidak mengekspresikan CD31 (PECAM-1), CD50, c-kit, dan CD133. Populasi sel ini positif untuk HLAABC, namun tidak untuk HLA-DR. hampir semua sel yang berasal dari endometrium berasal dari mesensimal atau stromal. Stem sel endometrium Agar epitel dan stroma dapat diperbaharui pada setiap siklus menstruasi, diperlukan peranan sel progenitor yang kontinu untuk membangun kembali endometrium yang rusak. Sel stem yang terdapat di s.basalis dipercaya sebagai sumber sel progenitor yang selanjutnya akan berkembang menjadi beberapa tipe sel yang spesifik, seperti epitel, stroma, dan vaskular. Sel stem ini dianggap mencetuskan regenerasi endometrium yang cepat. Namun, belum ada bukti penelitian langsung untuk mengkonfirmasi hipotesis ini, hingga tahun 2004. Pada tahun itu, terdapat 2 laporan dari laboratorium yang berbeda, yang mendukung hipotesis bahwa sel stem berperan penting dalam pembaharuan endometrium. Endometrium manusia mengandung sejumlah kecil sel stem epitel dan stroma yang bertanggung jawab terhadap regenerasi kelenjar endometrium dan stroma. Sel-sel ini memiliki kemampuan klonogenisitas yang tinggi. Konsisten dengan konsep ini, sejumlah kecil sel epitel (0.22%) dan sel stroma (1.25%) akan mengawali koloni dan mencetuskan potensi proliferatif yang sangat tinggi in vitro. Sel-sel ini terdiri dari sel stem progenitor yang akan berkembang membentuk endometrium pada tiap siklus menstruasi. Regenerasi endometrium dari sel stem multipoten yang berasal dari sumsum tulang baru-baru ini ditemukan pada resipien transplantasi sumsum tulang. Sel epitel dan stroma endometriumyang berasal dari donor dapat terdeteksi dalam sampel endometriumdari resipien sumsum tulang. Secara histologis, sel ini merupakan sel epitel dan stroma, yang mengekspresikan berbagai petanda diferensasi sel endometrium. Temuan ini menunjukkan bahwa sumsum tulang merupakan sumber sel stem endometrium ekstra uterus. Selain itu, temuan ini juga menunjukkan bahwa mobilisasi sel stem yang berasal dari sumsum tulang merupakan proses fisiologis yang normal.
27
Menariknya, sel transplan sumsum tulang yang berasal dari donor pria ditemukan pdalam endometrium dari resipien tikus perempuan. Dan meskipun jarang, selsel ini berdiferensiasi menjadi sel stroma dan sel epitel. Sel stem
endometriumberasal dari sel stem yang ditemukan pada pria dan wanita. Barubaru ini, sebuah penelitian menunjukkan bahwa sel progenitor endotel yang berasal dari transplan sumsum tulang juga berperan dalam formasi pembuluh darah baru di dalam endometrium. Repopulasi endometrium dengan sel stem yang berasal dari sumsum tulang sangat penting dalam fisiologi endometriumyang normal dan merupakan alasan untuk tingginya tingkat kegagalan histerektomi konservatif, seperti ablasi atau reseksi endometrium. Regenerasi endometrium mungkin tidak komplit pada wanita dengan cadangan sel stem yang sedikit atau dengan gangguan perekrutan sel stem setelah cedera. Hal ini menunjukkan prognosis yang buruk, seperti sindroma Asherman.
Struktur endometrium Darah menstrual mengandung sel atau jaringan dari lapisan fungsional endometrium. Lapisan ini terbentuk setelah akhir masa menstruasi. Proliferasi diinduksi oleh progesteron (fase proliferasi dari siklus menstruasi), dan selanjutnya terjadi peningkatan kadar progesteron dari corpus luteum (fase sekretori). Tidak adanya progesteron menyebabkan konstriksi arteri yang menyuplai darah ke lapisan fungsional, sehingga sel di dalam lapisan ini mengalami iskemia dan mati. Hal ini menyebabkan terjadinya menstruasi. Sebaliknya, lapisan basal, di dekat myometrium dan di bawah lapisan fungsional, tidak mengalami peluruhan selama siklus menstruasi. Secara histologis, endometrium fungsional terdiri dari selapis epitel kolumnar yang berada di atas lapisan jaringan ikat. Lapisan jaringan ikat ini memiliki ketebalan yang bervariasi sesuai dengan pengaruh hormonal stroma. Kelenjar uterus tubular sederhana mencapai dasar stroma melalui permukaan endometrium, yang juga
mendapatkan banyak darah dari arteri spiralis.
28
Anda mungkin juga menyukai
- Siklus MenstruasiDokumen5 halamanSiklus MenstruasiAgus Syaefuddin Zuhri100% (3)
- Biosintesis HormonDokumen20 halamanBiosintesis HormonDina taufia100% (1)
- Anatomi Histologi Sistem Reproduksi PriaDokumen8 halamanAnatomi Histologi Sistem Reproduksi PriaAlifia Nurdani DarmawanBelum ada peringkat
- Makalah Perkembangan Reproduksi WanitaDokumen8 halamanMakalah Perkembangan Reproduksi WanitaFika_nBelum ada peringkat
- Plasenta Dan Membran JaninDokumen52 halamanPlasenta Dan Membran JaninNurmailis Selayan100% (1)
- Anatomi Embriologi HepatobilierDokumen25 halamanAnatomi Embriologi HepatobilierPutri AvriliaBelum ada peringkat
- FISIOLOGI UrogenitalDokumen9 halamanFISIOLOGI UrogenitalHarishal Aryaputra100% (1)
- Histologi Sistem Reproduksi Pada WanitaDokumen2 halamanHistologi Sistem Reproduksi Pada WanitaRobby AkbarBelum ada peringkat
- Mekanisme MenstruasiDokumen11 halamanMekanisme MenstruasiTia PanjaitanBelum ada peringkat
- Absorbsi ProteinDokumen2 halamanAbsorbsi ProteinHasya KinasihBelum ada peringkat
- RPS - Embriologi Sistem ReproduksiDokumen31 halamanRPS - Embriologi Sistem ReproduksiLucky Resa SantosoBelum ada peringkat
- ImplantasiDokumen2 halamanImplantasiAluna SagitaBelum ada peringkat
- Fisiologi MenstruasiDokumen34 halamanFisiologi Menstruasialfinludica100% (1)
- Biosintesis Sekresi Dan Mekanisme Kerja HormonDokumen26 halamanBiosintesis Sekresi Dan Mekanisme Kerja HormonHafsah RiyantiBelum ada peringkat
- Toxoplasmosis Pada KehamilanDokumen10 halamanToxoplasmosis Pada KehamilanFungky AnthonyBelum ada peringkat
- Anatomi Dan Histologi Sistem Reproduksi WanitaDokumen12 halamanAnatomi Dan Histologi Sistem Reproduksi WanitasariBelum ada peringkat
- Fungsi Organ Reproduksi WanitaDokumen14 halamanFungsi Organ Reproduksi WanitaWahyu KuntetzBelum ada peringkat
- Fisiologi Siklus MenstruasiDokumen2 halamanFisiologi Siklus MenstruasiRahmatullahPertiwiBelum ada peringkat
- Histologi Organ Reproduksi PriaDokumen21 halamanHistologi Organ Reproduksi PriaNatanael FernandoBelum ada peringkat
- Patofisiologi Pre EklamsiDokumen7 halamanPatofisiologi Pre EklamsiGus Indra SudewaBelum ada peringkat
- Ruang Lingkup GinekologiDokumen5 halamanRuang Lingkup GinekologiMarwa NafishaBelum ada peringkat
- Hormon PlasentaDokumen3 halamanHormon Plasentaciciksherly100% (3)
- Makalah Imunologi ReproduksiDokumen25 halamanMakalah Imunologi Reproduksiaisyah shaumanurBelum ada peringkat
- Makalah GonorrheaDokumen14 halamanMakalah GonorrheaSinta Chinatsu100% (1)
- Sindrom NefrotikDokumen24 halamanSindrom NefrotikRizki Diah AnggraeniBelum ada peringkat
- Estrogen Dan ProgesteronDokumen21 halamanEstrogen Dan Progesteronn u r m a100% (3)
- Siklus Hidup OvariumDokumen20 halamanSiklus Hidup OvariumHasanalitaBelum ada peringkat
- Hubungan Stres Dengan Siklus Menstruasi Yang Tidak Teratus Pada MahasiswiDokumen30 halamanHubungan Stres Dengan Siklus Menstruasi Yang Tidak Teratus Pada MahasiswiadintaBelum ada peringkat
- Pertumbuhan Janin TerhambatDokumen7 halamanPertumbuhan Janin TerhambatCempaka Kusuma DewiBelum ada peringkat
- Poros Hormonal Sistem ReproduksiDokumen19 halamanPoros Hormonal Sistem ReproduksiDelva Aruna BabyshopBelum ada peringkat
- Fertilisasi, Nidasi Dan PlasentasiDokumen29 halamanFertilisasi, Nidasi Dan Plasentasilailatut toriqohBelum ada peringkat
- SIFAT Urin (Fisiologi)Dokumen2 halamanSIFAT Urin (Fisiologi)atikadwitama100% (3)
- JantungDokumen18 halamanJantungVicky Adi ZulfikarBelum ada peringkat
- Histologi Sistem Reproduksi WanitaDokumen6 halamanHistologi Sistem Reproduksi WanitaAnna Rahmania SariBelum ada peringkat
- Hormon Reproduksi Pria (Tugas Jadi)Dokumen16 halamanHormon Reproduksi Pria (Tugas Jadi)Noe RaBelum ada peringkat
- Faktor Yang Mempengaruhi Siklus HaidDokumen10 halamanFaktor Yang Mempengaruhi Siklus HaidShin Soo RiBelum ada peringkat
- Sistem Saraf Simpatik, Parasimpatik, Dan Mekanisme Gerak ReflekDokumen10 halamanSistem Saraf Simpatik, Parasimpatik, Dan Mekanisme Gerak ReflekTendo SoujiBelum ada peringkat
- Embriologi GenetaliaDokumen27 halamanEmbriologi GenetaliaHartini Sri UtamiBelum ada peringkat
- Laporan Praktikum Biokimia Klinis HemoglobinDokumen13 halamanLaporan Praktikum Biokimia Klinis HemoglobineunfieBelum ada peringkat
- Makalah Teratologi - Kelompok 4 - Penyakit Karena Teratologi-1-1Dokumen64 halamanMakalah Teratologi - Kelompok 4 - Penyakit Karena Teratologi-1-1Putri Zahra S1 2018Belum ada peringkat
- Mekanisme Pembentukan UrineDokumen8 halamanMekanisme Pembentukan UrineRahayu Tri NuritasariBelum ada peringkat
- Fertilisasi, Nidasi & PlasentasiDokumen46 halamanFertilisasi, Nidasi & PlasentasiDwi Fransiska NataliaBelum ada peringkat
- Fisrep Kel 9 (Endokrinologi Kehamilan)Dokumen24 halamanFisrep Kel 9 (Endokrinologi Kehamilan)Raihan FayisBelum ada peringkat
- Histologi Sistem Reproduksi PriaDokumen5 halamanHistologi Sistem Reproduksi Prianailatul fadhila100% (2)
- EmbriologiDokumen49 halamanEmbriologiMaharani SimanjuntakBelum ada peringkat
- Fisiologi Kehamilan PDF UsuDokumen14 halamanFisiologi Kehamilan PDF UsuShahnaz Rizka50% (2)
- Proses BerkemihDokumen1 halamanProses BerkemihWakid AbuBelum ada peringkat
- Embriologi ManusiaDokumen33 halamanEmbriologi ManusiaApanalpan100% (2)
- Siklus MenstruasiDokumen21 halamanSiklus MenstruasiZul Achmad Fauzan Lubis100% (1)
- Sikluks MenstruasiDokumen8 halamanSikluks MenstruasiAliya CantikaBelum ada peringkat
- Hiperplasia EndometriumDokumen22 halamanHiperplasia Endometriumayyash13100% (1)
- Siklus MenstruasiDokumen13 halamanSiklus MenstruasiAlifah Putri MBelum ada peringkat
- Bahan MakalahDokumen20 halamanBahan MakalahLili HapverBelum ada peringkat
- Fisiologi HaidDokumen8 halamanFisiologi Haidnami_yha6397Belum ada peringkat
- Aldo Febriananto Kurniawan 22010112140205 Lap - Kti Bab IIDokumen21 halamanAldo Febriananto Kurniawan 22010112140205 Lap - Kti Bab IIkomang nickoBelum ada peringkat
- Dismenore YDDokumen26 halamanDismenore YDAnonymous pL7Ty4TVqBelum ada peringkat
- Fisiologi MenstruasiDokumen6 halamanFisiologi MenstruasiTiffani Wafi Idlal MBelum ada peringkat
- MenoragiaDokumen17 halamanMenoragiaDanillaHasadaBelum ada peringkat
- Tugas Maternitas 1Dokumen4 halamanTugas Maternitas 1Dewi NovitaBelum ada peringkat
- ASkep GG - MenstruasiDokumen16 halamanASkep GG - MenstruasiErlis SelvianaBelum ada peringkat