Asam Dan Basa Merupakan Dua Golongan Zat Kimia Yang Sangat Penting Dalam Kehidupan Sehari
Diunggah oleh
Kusmana SidikHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Asam Dan Basa Merupakan Dua Golongan Zat Kimia Yang Sangat Penting Dalam Kehidupan Sehari
Diunggah oleh
Kusmana SidikHak Cipta:
Format Tersedia
Asam dan Basa merupakan dua golongan zat kimia yang sangat penting dalam kehidupan
sehari-hari. Berkaitan dengan siIat asam Basa, larutan dikelompokkan dalam tiga golongan,
yaitu bersiIat asam, bersiIat basa, dan bersiIat netral. Asam dan Basa memiliki siIat-siIat yang
berbeda, sehingga dapat kita bisa menentukan siIat suatu larutan. Untuk menentukan suatu
larutan bersiIat asam atau basa, ada beberapa cara. Yang pertama menggunakan indikator
warna, yang akan menunjukkan siIat suatu larutan dengan perubahan warna yang terjadi.
Misalnya Lakmus, akan berwarna merah dalam larutan yang bersiIat asam dan akan berwarna
biru dalam larutan yang bersiIat basa. SiIat asam basa suatu larutan juga dapat ditentukan
dengan mengukur pH-nya. pHmerupakan suatu parameter yang digunakan untuk menyatakan
tingkat keasaman larutan. Larutan asam memiliki pH kurang dari 7, larutan basa memiliki pH
lebih dari 7, sedangkan larutan netral memiliki pH7. pH suatu larutan dapat ditentukan
dengan indikator pH atau dengan pH meter.
Sumber: http://id.shvoong.com/exact-sciences/1884244-teori-asam-basa/#ixzz1bmAkCIxx
Teori Asam-Basa Arrhenius
Sejak berabad-abad yang lalu, pakar kimia mendeIinisikan asam dan basa berdasar siIat
larutannya. Larutan asam memiliki rasa masam dan bersiIat korosiI (merusak logam, marmer,
dan berbagai bahan lain). sedangkan basa berasa agak pahit dan bersiIat kaustik ( licin).
Namun ada beberapa pendapat yang menjelaskan penyebab siIat asam dan basa. Pada tahun
1777, Antoine Laurent Lavoisier (1743-1794) mengemukakan bahwa asam mengandung
unsur oksigen. Davy kemudian menyimpulkan bahwa unsur hidrogenlah yang merupakan
unsur dasar asam. Kemudian tahun 1814 Joseph Louis Gay-Lussac (1778-1850)
menyimpulkan bahwa asam adalah suatu zat yang dapat menetralkan alkali dan kedua
golongan senyawa itu hanya dapat dideIinisikan dalam kaitan satu dengan yang lain.
Namun konsep/pendapat yang cukup memuaskan, dan dapat diterima hingga saat ini
dikemukakan oleh Svante August Arrhenius (1859-1927), yaitu :
O asam
asam adalah zat yang dalam air melepaskan ion H
. dengan kata lain, pembawa siIat asam
adalah ion H
. dan dirumuskan dengan
H
x
Z(aq)---------xH
(aq) Z
x-
(aq)
O basa
basa adalah zat yang dalam air menghasilkan ion hidroksida (OH-). dengan kata lain,
pembawa siIat basa adalah (OH-). dan dirumuskan dengan
M(OH)
x
(aq)---------M
x
(aq)
x
OH
-
(aq)
Sumber: http://id.shvoong.com/exact-sciences/1884244-teori-asam-basa/#ixzz1bmBZCwYU
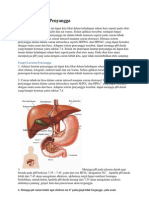
A Latar 8e|akang
Asam dan basa merupakan dua senyawa klmla yang sangaL penLlng dalam kehldupan seharlharl
Secara umum zaLzaL yang berasa masam mengandung asam mlsalnya asam slLraL pada [eruk dan
asam cuka 8asa umumnya mempunyal slfaL llcln dan Lerasa pahlL mlsalnya pada sabun
SeLlap harl klLa menggunakan sabun unLuk memberslhkan badan keLlka sabun mengenal kullL klLa
merasakan kullL men[adl berslh dan segar namun laln halnya [lka yang mengenal kullL adalah
naLrlum hldrokslda maka kullL klLa akan Lerasa pedlh adahal balk sabun maupun naLrlum
hldrokslda merupakan basa Pal lnl dlsebabkan kadar basa yang Lerkandung dalam sabun maslh
dapaL dlLolerlr oleh Lubuh uengan kaLa laln kekuaLan basa yang dlmlllkl oleh sabun leblh rendah
darlpada yang dlmlllkl oleh naLrlum hldrokslda keadaan seperLl lLu berlaku pula unLuk asam 8uah
[eruk yang mengandung slLraL Lldak akan memberlkan efek samplng keLlka klLa makan bahkan akan
menyehaLkan karena buah [eruk mengandung banyak vlLamln C namun [angan sekallkall kallan
menclclpl asam yang LerdapaL dl laboraLorlum LeruLama asam kuaL seperLl asam sulfaL (P2SC4) dan
asam klorlda (Pcl) kedua [enls asam LersebuL [lka kallan sampal menyenLuhnya maka Langan kallan
akan melepuh dan dapaL menyebabkan gaLalgaLal
Alr merupakan elekLrollL sangaL lemah yang Lerlonlsasl men[adl lon P+ dan lon P ualam alr Asam
melepaskan lon P+ sedangkan basa melepaskan lon CP ualam alr asam kuaL dan basa kuaL
Lerlonlsasl seluruhnya Sedangkan asam lemah dan basa lemah hanya Lerlonlsasl sebaglan P
laruLan menyaLakan konsenLrasl P+ dalam laruLan eneLralan asam oleh basa menghasllkan alr
menuruL 88CnS1Lu LCW8? asam merupakan donor proLon (P+) dan basa merupakan aksepLor
proLon (CP)
ul laboraLorlum asam dan basa secara sederhana dapaL dlkenall dengan menggunakan kerLas
lakmus ualam laruLan asam lakmus akan berwarna blru LaruLan asam dan basa merupakan laruLan
elekLrollL sehlngga dldalam alr akan Lerural men[adl lonlonnya Apakah yang menyebabkan suaLu
laruLan berslfaL asam demlklan pula apa penyebab suaLu laruLan berslfaL basa
Anda mungkin juga menyukai
- AsambasaDokumen6 halamanAsambasaAndri PratamaBelum ada peringkat
- Asam BasaDokumen11 halamanAsam BasaAmalia100% (1)
- Uji Praktikum Identifikasi Asam Basa Menggungakan Indikator AlamiDokumen9 halamanUji Praktikum Identifikasi Asam Basa Menggungakan Indikator AlamiRiez ArizBelum ada peringkat
- Asam BasaDokumen11 halamanAsam BasaimahBelum ada peringkat
- Praktikum DMDokumen19 halamanPraktikum DMkesiBelum ada peringkat
- Asam BasaDokumen20 halamanAsam BasaviraandiniBelum ada peringkat
- Materi Asam BasaDokumen5 halamanMateri Asam BasaLisna ButonBelum ada peringkat
- Asam BasaDokumen4 halamanAsam BasamaretjohanesBelum ada peringkat
- Kesetimbangan Asam BasaDokumen18 halamanKesetimbangan Asam BasaAfri LionBelum ada peringkat
- Materi Kimia Kelas Xi .Dokumen27 halamanMateri Kimia Kelas Xi .Tali JagatBelum ada peringkat
- Bab IDokumen10 halamanBab INani HerlinaBelum ada peringkat
- Asam, Basa Dan GaramDokumen10 halamanAsam, Basa Dan GaramBlack MemoriesBelum ada peringkat
- DASAR TEORI TAMBAHAN Sifat Asam Basa Senyawa OrganikDokumen4 halamanDASAR TEORI TAMBAHAN Sifat Asam Basa Senyawa OrganikRizki RaniBelum ada peringkat
- Makalah Kimia Larutan IIDokumen24 halamanMakalah Kimia Larutan IIOliviarBelum ada peringkat
- BAB I Asam Basa KepDokumen17 halamanBAB I Asam Basa KepFifi RiskayaniBelum ada peringkat
- Biokimia TanamanDokumen16 halamanBiokimia TanamanBernardinus Tagaptiam GudagBelum ada peringkat
- MAKALAH Kima Asam Basa Kelompok 2 - Fisika ADokumen16 halamanMAKALAH Kima Asam Basa Kelompok 2 - Fisika Auriteumesikonic 127Belum ada peringkat
- LKPDDokumen15 halamanLKPDMichael JuddayBelum ada peringkat
- Laporan Kimia Rahma OkDokumen13 halamanLaporan Kimia Rahma OkAyati Ika PurnamasariBelum ada peringkat
- Laporan Kimia 14Dokumen5 halamanLaporan Kimia 14SAMUELBelum ada peringkat
- Uji Asam BasaDokumen9 halamanUji Asam BasaAna FizhaBelum ada peringkat
- Larutan Asam Basa PDFDokumen10 halamanLarutan Asam Basa PDFAizah TifaniBelum ada peringkat
- Makalah Asam Dan BasaDokumen21 halamanMakalah Asam Dan BasaIhsan YayankBelum ada peringkat
- Asam BasaDokumen9 halamanAsam BasaNazar KhamimBelum ada peringkat
- X TKJ - Asam Dan BasaDokumen26 halamanX TKJ - Asam Dan BasaDyah Pandu HardaniBelum ada peringkat
- Modul Larutan Asam BasaDokumen4 halamanModul Larutan Asam BasaIrma TiaraBelum ada peringkat
- ProposalDokumen4 halamanProposalresita kurniaBelum ada peringkat
- Asam, Basa Dan GaramDokumen7 halamanAsam, Basa Dan GaramnemanjanoahBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaIrfani SyafriBelum ada peringkat
- Bab 1 Pendahuluan: A. Latar BelakangDokumen13 halamanBab 1 Pendahuluan: A. Latar BelakangAdinansyah RaflyBelum ada peringkat
- Laporan Praktikum Asam & BasaDokumen7 halamanLaporan Praktikum Asam & BasaExcel Alfarietto BiothreeBelum ada peringkat
- Laporan Praktikum KimiaDokumen16 halamanLaporan Praktikum KimiaLaily RizkiyaniBelum ada peringkat
- Laporan Praktikum Kimia Asam BasaDokumen12 halamanLaporan Praktikum Kimia Asam BasaRahmat NovriyandyBelum ada peringkat
- Laporan Praktikum Kimia Asam Dan BasaDokumen14 halamanLaporan Praktikum Kimia Asam Dan BasaputriwahyuBelum ada peringkat
- ASRIANIDokumen8 halamanASRIANIAsrianiBelum ada peringkat
- Asam Dan BasaDokumen24 halamanAsam Dan BasaTony Redzza Saputra100% (1)
- Peta Konsep Asam Basa GaramDokumen11 halamanPeta Konsep Asam Basa GaramDenny SutejoBelum ada peringkat
- Laporan KimiaDokumen10 halamanLaporan KimiaRAFLI ADITYABelum ada peringkat
- Handout Larutan Asam Dan BasaDokumen20 halamanHandout Larutan Asam Dan BasaReny Yulia Andini, S.Pd.Belum ada peringkat
- Bab6 Asam BasaDokumen24 halamanBab6 Asam BasafikriBelum ada peringkat
- Mkalah Kimia Larutan Asam BasaDokumen18 halamanMkalah Kimia Larutan Asam BasaRizky PurnamaBelum ada peringkat
- Makalah Asam Dan BasaDokumen11 halamanMakalah Asam Dan BasasaffalBelum ada peringkat
- Asam BasaDokumen22 halamanAsam BasaEfi Ratna SariBelum ada peringkat
- Makalah Asam Dan BasaDokumen20 halamanMakalah Asam Dan BasaDigitalplusBelum ada peringkat
- Laporan Organik IDokumen12 halamanLaporan Organik IZulkifli i. TuaraBelum ada peringkat
- Landasan Teori Asam-BasaDokumen1 halamanLandasan Teori Asam-Basachindy editaBelum ada peringkat
- Dasar Teori Kimia Asam BasaDokumen17 halamanDasar Teori Kimia Asam BasaAkmal Axcel Akimichi Akzimon100% (1)
- Fungsi Larutan PenyanggaDokumen4 halamanFungsi Larutan PenyanggaNur Desi YaniBelum ada peringkat
- Makalah Asam Dan BasaDokumen21 halamanMakalah Asam Dan BasaDimaz ViggianceBelum ada peringkat
- Larutan AsamDokumen32 halamanLarutan AsamOyaBelum ada peringkat
- LKS 3.9 Asam Basa Plus SoalDokumen18 halamanLKS 3.9 Asam Basa Plus SoalDessy FitrianaBelum ada peringkat
- Jurnal Asam BasaDokumen12 halamanJurnal Asam BasaYulita Amanda88% (34)