PH Campuran Asam Basa
Diunggah oleh
andinJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
PH Campuran Asam Basa
Diunggah oleh
andinHak Cipta:
Format Tersedia
pH CAMPURAN ASAM BASA
Oleh. Warsiti, S.Pd
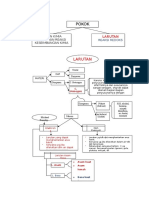
pH CAMPURAN Asam Basa terdiri dari 4 yaitu
1. Campuran asam kuat dan basa kuat.
2. Campuran asam kuat dan basa lemah.
3. Campuran asam lemah dan basa kuat.
4. Campuran asam lemah dan basa lemah.
Uraian diatas pH Campuran tergantung mol sisa dibagi volume campuran.
1. pH Campuran asam kuat dan basa kuat ,membentuk garam dan air, jika yang bersisa asam
kuat maka pHsisa asam kuat yaitu mol sisa per volume campuran. PH asam kuat = [ H+ ]
mol sisa/ volume campuran. Contohnya HCl dan KOH, jika yang sisa basa kuat pOH basa
kuat = [OH]mol sisa/v camp, dimana PH = 14 – POH.
2. H Campuran asam kuat dan basa lemah, contohnya HCl dan NH4OH, jika yang sisa asam kuat
pH asam kuat = [ OH ] mol sisa / volume campuran, jika sisanya basa lemah dihitung dengan
pH penyangga basa lemah dengan garamnya.Jika habis bereaksi dihitung PH hidrolisa basa
lemah.
3. pH Campuran asam lemah dan basa kuat, contohnya CH3COOH dan NaOH.
Jika sisanya asam lemah dihitung PH penyangga asam lemah dan garamnya, tetapi jika yang
sisa basa kuat dihitung pH sisa basa kuat per volume campuran.Jika habis bereaksi dihitung
pHhidrolisa asam lemah.
4. pHCampuran asam lemah dan basa lemah, contohnya CH3COOH dan NH4OH.
Jika sisanya asam lemah maupun basa lemah dihitung pH asam lemah per volume
campuran,maupun pOH sisa basa lemah per volume campuran. Jika habis bereaksi dihitung pH
hidrolisa total.
𝑝𝐻 + 𝑝𝑂𝐻 = 14 ⟹ 𝑝𝐻 = 14 − 𝑝𝑂𝐻
RUMUS –RUMUS pH CAMPURAN
pH Asam kuat dan basa kuat pH-nya = 7
pH asam lemah dan basa lemah, jika sisanya asam lemah pHnya penyangga asam ,
Warsiti, S.Pd,Kimia XI IPA. Page 1
RUMUS – RUMUS ASAM LEMAH DAN BASA LEMAH
Jika Ka diketahui H+ dipengaruhi Ka dan Ma,demikian juga jika Kb diketahui OH- dipengaruhi Kb
dan Mb. Untuk larutan asam dan basa lemah maupun kuat jika diketahui molaritas, volume tidak
𝑗𝑢𝑚𝑙𝑎ℎ 𝑚𝑜𝑙 𝑧𝑎𝑡 𝑡𝑒𝑟𝑖𝑜𝑛𝑖𝑠𝑎𝑠𝑖
mempengaruhi perhitungan. Derajad ionisasi (α ) adalah =
𝑗𝑢𝑚𝑙𝑎ℎ 𝑚𝑜𝑙 𝑧𝑎𝑡 𝑚𝑢𝑙𝑎−𝑚𝑢𝑙𝑎
Harga α asam lemah dan basa lemah 0 < α < 1 , harga Ka menyatakan kekuatan asam makin besar Ka
maka ion H+ makin besar sehingga asam yang dihasilkan makin kuat. Tetapi untuk asam kuat dan
basa kuat besarnya α = 1 atau 100% karena terurai sempurna.
Rumus derajad ionisasi ( α ) adalah
𝐾𝑎 𝐾𝑎
Untuk asam lemah α =√ untuk basa lemah α =√
𝑀𝑎 𝑀𝑎
Reaksi kesetimbangan asam lemah : HA ( aq ) H+ + A-
[𝐻 + ]2 = 𝐾𝑎 . 𝑀𝑎 ⟹ [𝐻 + ] = √𝐾𝑎 . 𝑀𝑎
[𝑂𝐻 − ]2 = 𝐾𝑏 . 𝑀𝑏 ⟹ [𝑂𝐻 − ] = √𝐾𝑏 . 𝑀𝑏
1 1
𝑝𝐻 = − log[𝐻 + ] = − log 𝐾𝑎 − log 𝑀𝑎
2 2
1 1
𝑝𝑂𝐻 = − log[𝑂𝐻 − ] = − 2 log 𝐾𝑏 − 2 log 𝑀𝑏
Keterangan: Ma : Konsentrasi asam sisa,Mb : Konsentrasi basa sisa,Ka : Tetapan
kesetimbangan asam lemah, Kb : tetapan kesetimbangan basa lemah, Mg : Konsentrasi basa sisa per
volume campuran.
Kerjakan soal berikut !
1. Hitung PH dari HCOOH yang α = 10% sebanyak 4,4 gram dalam 100ml ?
Warsiti, S.Pd,Kimia XI IPA. Page 2
PENYANGGA/BUFFER/DAPAR/PENAHAN
Jika campuran asam lemah dan basa kuat sisanya asam lemah maka masuk PH penyangga
Contoh soal as lmh CH3COOH dan bs kuat NaOH, Ka = Kb =10-5 Tentukan pH
Persamaan reaksi :
CH3COOH + NaOH CH3COONa + H2O
Asam lmh basa lmh Garam Air
100ml;0,1M 100ml;0,05M
V.M = n
Mula2 : 0,010 mol ~ 0,005mol
Bereaksi : 0,005mol ~ 0,005mol ~ 0,005mol~ 0,005mol
Sisa : 0,005mol ~ 0,005mol ~ 0,005mol
[𝑚𝑜𝑙 𝑠𝑖𝑠𝑎] 0,005 𝑚𝑜𝑙
Ma = [𝑣𝑜𝑙𝑢𝑚𝑒 𝑐𝑎𝑚𝑝]
= = 0,005mol = 5. 10-3 /2.10-1 = 2,5. 10-2mol/l
0,2𝐿
Mg = 2,5.10-2 mol/L Berikut Rumus PENYANGGA ASAM
𝑀𝑎 𝑀𝑎 𝑀𝑎
[𝐻 + ] = 𝐾𝑎 . ⟹ 𝑝𝐻 = − log[𝐻 + ] = − log 𝐾𝑎. 𝑀𝑔 = − log 𝐾𝑎 − 𝑙𝑜𝑔 𝑀𝑔
𝑀𝑔
Jika campuran basa lemah dan asam kuat sisanya basa lemah maka masuk Ph penyangga
𝑀𝑏 𝑀𝑏 𝑀𝑏
[𝑂𝐻 − ] = 𝐾𝑏 . ⟹ 𝑝𝑂𝐻 = − log[𝑂𝐻 − ] = − log 𝐾𝑏. = − log 𝐾𝑏 − 𝑙𝑜𝑔
𝑀𝑔 𝑀𝑔 𝑀𝑔
Jadi, 𝑝𝐻 + 𝑝𝑂𝐻 = 14 ⟹ 𝑝𝐻 = 14 − 𝑝𝑂𝐻
HIDROLISIS
Peristiwa bereaksinya suatu zat dengan air disebut hidrolisis. HIDROLISIS dibagi tiga yaitu
1. Garam tak terhidrolisis berasal dari asam kuat dan basa kuat, ex. NaCl,K2SO4.
2. Garam terhidrolisis sebagian berasal dari asam lemah dan basa kuat, ex. CH3COONa
Garam terhidrolisis sebagian berasal dari basa lemah dan asam kuat, ex. NH4Cl
Warsiti, S.Pd,Kimia XI IPA. Page 3
3. Garam terhidrolisis total beasal dari asam lemah dan basa lemah, ex.CH3COONH4.
Jika tidak ada sisa baik asam lemah maupun basa kuat maka masuk pH hidrolisa asam contoh
CH3COOH dan NaOH membentuk CH3COONa. Demikian juga untuk basa lemah dan asam kuat
contohnya NH4OH dan HCl.
𝐾𝑤 .𝑀𝑔 𝐾𝑤 .𝑀𝑔
[𝑂𝐻 − ] = √ dan [𝐻 + ] = √
𝐾𝑎 𝐾𝑏
TETAPAN HIDROLISIS ( Kh )
𝐾𝑤 𝐾𝑤
Rumus : Kh = atau Kh = ket,Kw : tetapan kesetimbangan air,Ka : tetapan
𝐾𝑎 𝐾𝑏
ionisasi asam lemah dan Kb : tetapan ionisasi basa lemah.
Jika asam lemah dan basa lemah masuk hidrolisa total
𝐾𝑎 .𝐾𝑤
[𝐻 + ] = √
𝐾𝑏
jika harga Ka < Kb, larutan bersifat basa, Ka > Kb larutan bersifat asam dan Ka
=Kb larutan bersifat netral.
Contoh Soal.1. Tentukan pH campuran 100 ml CH3COOH 0,1M dengan 100 ml NaOH 0,2 jika Ka = Kb
= 10-5m?
Jawab : CH3COOH + NaOH CH3COONa + H2O
Mula- mula : 0,01mol 0,02mol
Bereaksi : 0,01mol 0,01mol 0,01mol 0,01mol
Sisa : habis 0,01mol 0,01mol 0,01mol
Volume campuran = 200ml = 0,2L
[𝑁𝑎𝑂𝐻 𝑠𝑖𝑠𝑎] 0,01
Sisanya basa kuat ( NaOH) = [𝑉𝑜𝑙𝑢𝑚𝑒 𝐶𝑎𝑚𝑝𝑢𝑟𝑎𝑛]
= 0,2
= 0,05𝑀
Berarti masuk POH basa kuat = POH = -log [𝑂𝐻 − ] = - log 5 . 10−2 = 2 - log 5
pH = 14 - 2 + log 5 = 12 + log 5
LATIHAN SOAL pH Campuran
Warsiti, S.Pd,Kimia XI IPA. Page 4
1. Hitung Ph dari 200ml NH4OH 0,1M dengan 100ml HCl 0,1M jika Kb = Ka = 10−5?
2. Hitung PH dari 100ml HCOOH 0,2M dengan 100ml KOH 0,1M jika Kb = Ka = 10−5?
3. Hitung PH dari 100ml NH4OH 0,2M dengan 200ml HCl 0,1M jika Kb = Ka = 10−5?
4. Hitung PH dari 200ml NH4OH 0,1M dengan 100ml HCl 0,1M jika Kb = Ka = 10−5?
5. Hitung Ph dari100mnl NH4OH 1M dengan 100ml HCl 0,5M jika Kb = Ka = 10−5?
6. Hitung PH dari 200ml NH4OH 0,1M dengan 100ml HCl 0,1M jika Kb = Ka = 10−5?
7. Hitung PH dari 100ml NH4OH 0,1M dengan 100ml C3H7COOH 0,2M jika Kb = Ka = 10−5?
8. Hitung PH dari 100ml C2H5COOH 0,1M dengan 100ml NaOH 0,1M jika Kb = Ka 10−5?
9. Hitung PH dari 200ml NH4OH 0,1M dengan 100ml H2SO4 0,1M jika Kb = Ka = 10−5?
10. Hitung PH dari 100ml C2H5COOH 0,1M dengan 200ml KOH 0,05M jika Kb = Ka = 10−5?
Selamat Mengerjakan yang benar
Warsiti, S.Pd,Kimia XI IPA. Page 5
Anda mungkin juga menyukai
- Soal Sulit Asam BasaDokumen4 halamanSoal Sulit Asam Basasri0% (1)
- Cara Menghitung PH Dan POH Larutan Penyangga Buffer Asam Dan BasaDokumen3 halamanCara Menghitung PH Dan POH Larutan Penyangga Buffer Asam Dan BasaBenih Intan Sejati100% (1)
- Kesetimbangan Ion Ion DLM Larutan Kls XiDokumen26 halamanKesetimbangan Ion Ion DLM Larutan Kls XiMarina Ivana Mumpel100% (1)
- C Menghitung PH Larutan PenyanggaDokumen2 halamanC Menghitung PH Larutan PenyanggafitriBelum ada peringkat
- Soal Dan Jawaban Osn Kimia TK Nasional Tahun 2010Dokumen18 halamanSoal Dan Jawaban Osn Kimia TK Nasional Tahun 2010_aldiawanBelum ada peringkat
- Contoh Peristiwa Hidrolisis Dalam Kehidupan SehariDokumen1 halamanContoh Peristiwa Hidrolisis Dalam Kehidupan SehariKhusana NBelum ada peringkat
- Air Kristal UN 2013Dokumen17 halamanAir Kristal UN 2013Kukuh KhumairoBelum ada peringkat
- Laporan KImia Trayek PHDokumen7 halamanLaporan KImia Trayek PHAzmie RBelum ada peringkat
- Laporan PHDokumen6 halamanLaporan PHFaisal ArsyadBelum ada peringkat
- KIM Halaman 108Dokumen2 halamanKIM Halaman 108Taufik Ardistyo WiradarmoBelum ada peringkat
- Kimia Bab 19 Latihan Soal Reaksi Adisi, Subtitusi & EliminasiDokumen2 halamanKimia Bab 19 Latihan Soal Reaksi Adisi, Subtitusi & EliminasiLia lylBelum ada peringkat
- Soal TesDokumen4 halamanSoal TeshamdanBelum ada peringkat
- Contoh Soal Laju ReaksiDokumen6 halamanContoh Soal Laju ReaksiYusi Andayani Lubis0% (1)
- Kpulan SoalDokumen38 halamanKpulan SoalZurriyatun Thoyibah100% (1)
- PembahasanDokumen2 halamanPembahasanRichoco ChannelBelum ada peringkat
- Sifat Fisik LarutanDokumen52 halamanSifat Fisik LarutanAllysa Pratiwi PutriBelum ada peringkat
- Larutan PenyanggaDokumen13 halamanLarutan PenyanggaIvanaBelum ada peringkat
- Soal-Soal Materi TermokimiaDokumen7 halamanSoal-Soal Materi TermokimiaCarles SimangunsongBelum ada peringkat
- Asam Basa 2-E (Kekuatan Asam Basa & PH) - Bahas SoalDokumen3 halamanAsam Basa 2-E (Kekuatan Asam Basa & PH) - Bahas SoalkhazbiikaBelum ada peringkat
- Bahan Ajar Hk. Hess & Energi IkatanDokumen17 halamanBahan Ajar Hk. Hess & Energi IkatanelfaBelum ada peringkat
- Tes DiagnostikDokumen6 halamanTes Diagnostikyurianti lamaya50% (2)
- Modul Kimia GabDokumen64 halamanModul Kimia GabAnin Nur AlfiyatinBelum ada peringkat
- Rumus Penyangga Dan HidrolisisDokumen2 halamanRumus Penyangga Dan HidrolisisNita Yunita100% (1)
- Laporan Praktikum Kimia PHDokumen7 halamanLaporan Praktikum Kimia PHEvy Setia OktavianiBelum ada peringkat
- Contoh Soal LAJU REAKSI RevisiDokumen8 halamanContoh Soal LAJU REAKSI Revisiulyanur khairunnufus100% (1)
- LAPORAN HASIL PRAKTIKUM Pergeseran Kesetimbangan KimiaDokumen10 halamanLAPORAN HASIL PRAKTIKUM Pergeseran Kesetimbangan KimiaAprilio BudimanBelum ada peringkat
- Bab 7 Kesetimbangan KimiaDokumen28 halamanBab 7 Kesetimbangan KimiaMalik LamendoBelum ada peringkat
- Latihan Soal Stoikiometri Campuran Dan Kemurnian ZatDokumen2 halamanLatihan Soal Stoikiometri Campuran Dan Kemurnian ZatRizki FajrulBelum ada peringkat
- MEMPERKIRAKAN PH LARUTAN DENGAN BEBERAPA INDIKATORDokumen9 halamanMEMPERKIRAKAN PH LARUTAN DENGAN BEBERAPA INDIKATORaisyah farah adillahBelum ada peringkat
- Larutan PenyanggaDokumen27 halamanLarutan PenyanggaDaniatul FitriBelum ada peringkat
- Bahan Pelajaran Kimia Sem 2 Kelas 10Dokumen21 halamanBahan Pelajaran Kimia Sem 2 Kelas 10Fendy FendyBelum ada peringkat
- PH Asam Dan BasaDokumen7 halamanPH Asam Dan Basaaidil fitrisyahBelum ada peringkat
- Gelombang Intensitas BunyiDokumen10 halamanGelombang Intensitas BunyiPhiephiyFitriaBelum ada peringkat
- Ulangan Harian Ke-4 Xi Mipa KesetimbanganDokumen3 halamanUlangan Harian Ke-4 Xi Mipa Kesetimbangan,sxjBelum ada peringkat
- Percobaan Reaksi Eksoterm Dan EndotermDokumen9 halamanPercobaan Reaksi Eksoterm Dan EndotermAsra AfrizonBelum ada peringkat
- Bahan AjarDokumen16 halamanBahan AjarZaini AjaBelum ada peringkat
- Bentuk MolekulDokumen41 halamanBentuk Molekuljayadi haddadBelum ada peringkat
- LKPD Laju Reaksi Faktor Katalis Kelas XIDokumen11 halamanLKPD Laju Reaksi Faktor Katalis Kelas XIMohamad AndriantoBelum ada peringkat
- Modul 4 Kesetimbangan KimiaDokumen12 halamanModul 4 Kesetimbangan Kimiarizky kadhafiBelum ada peringkat
- StoikiometriDokumen13 halamanStoikiometriKaratatchi YaguraBelum ada peringkat
- Remedial KimiaaaaaaaaaaaaaaaaaDokumen4 halamanRemedial Kimiaaaaaaaaaaaaaaaaafanny rahmadani100% (1)
- Kimia 3Dokumen12 halamanKimia 3RisaRinggalihBelum ada peringkat
- Praktikum Menghitung Kalor ReaksiDokumen4 halamanPraktikum Menghitung Kalor ReaksiJawad Shahab100% (1)
- Energi IkatanDokumen3 halamanEnergi Ikatanlusiana setiawatiBelum ada peringkat
- Kelarutan Dan Hasil Kali KelarutanDokumen11 halamanKelarutan Dan Hasil Kali KelarutanRiko AngBelum ada peringkat
- Contoh Soal 1Dokumen6 halamanContoh Soal 1Sanre Dina TambunanBelum ada peringkat
- Stoikiometri Larutan Kls XiDokumen18 halamanStoikiometri Larutan Kls XiMAliAkbarBelum ada peringkat
- Persiapan Soal Titrasi Asam CukaDokumen6 halamanPersiapan Soal Titrasi Asam CukaGusty DyanoBelum ada peringkat
- Soal TermokimiaDokumen5 halamanSoal TermokimiaMegiHarvendaBelum ada peringkat
- Mengidentifikasi Senyawa KarbonDokumen8 halamanMengidentifikasi Senyawa KarbonSeptianing TyasBelum ada peringkat
- Soal Tentang Stokiometri 1Dokumen6 halamanSoal Tentang Stokiometri 1WidyaBelum ada peringkat
- Ringkasan Asam Basa, Buffer, Soal Dan PembahasanDokumen17 halamanRingkasan Asam Basa, Buffer, Soal Dan PembahasanSilitonga16Belum ada peringkat
- Konsep Laju ReaksiDokumen14 halamanKonsep Laju ReaksiEdii SupartawanBelum ada peringkat
- BAB 2 Hukum HessDokumen34 halamanBAB 2 Hukum HessAndhika Dwi HendrayanaBelum ada peringkat
- PH Campuran Asam BasaDokumen5 halamanPH Campuran Asam Basaلقمان عبدالله50% (2)
- Buffer Dan HidrolisisDokumen21 halamanBuffer Dan Hidrolisisanon_754506071Belum ada peringkat
- Materi Pert. 3 PH Asam Lemah, Basa Lemah PDFDokumen13 halamanMateri Pert. 3 PH Asam Lemah, Basa Lemah PDFdwinomoBelum ada peringkat
- Laporan BufferDokumen20 halamanLaporan BufferaristawidyaBelum ada peringkat
- Larutan, Kul, 4b 2Dokumen89 halamanLarutan, Kul, 4b 2Dicky HantaturiBelum ada peringkat
- PH LarutanDokumen12 halamanPH LarutanNURWIDAYANTIBelum ada peringkat
- Toksikologi: Intoksikasi Karbon MonoksidaDokumen15 halamanToksikologi: Intoksikasi Karbon MonoksidaandinBelum ada peringkat
- Laporan RespirasiDokumen13 halamanLaporan RespirasiandinBelum ada peringkat
- Masa Food GatheringDokumen6 halamanMasa Food GatheringandinBelum ada peringkat
- Rangkuman ElektrolisisDokumen5 halamanRangkuman Elektrolisisandin100% (1)
- Laporan Biologi Perendaman Tulang Pada HCLDokumen5 halamanLaporan Biologi Perendaman Tulang Pada HCLandin0% (1)
- Dribbling Sepak BolaDokumen4 halamanDribbling Sepak BolaandinBelum ada peringkat
- Bab 1 Antara Kolonialisme Dan ImperialismeDokumen78 halamanBab 1 Antara Kolonialisme Dan ImperialismeandinBelum ada peringkat