Rumus Penyangga Dan Hidrolisis
Diunggah oleh
Nita YunitaDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Rumus Penyangga Dan Hidrolisis
Diunggah oleh
Nita YunitaHak Cipta:
Format Tersedia
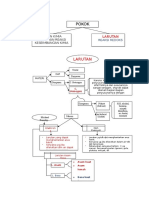
PENURUNAN RUMUS (H+) DAN (OH-) LARUTAN PENYANGGA
1. Campuran asam lemah dengan basa konjugatnya (misalnya CH3COOH dengan
CH3COONa )
CH3COONa CH3COO- +Na+ (terurai sempurna)
dan
CH3COOH CH3COO- + H+
Ka = (CH3COO- ) (H+ ) / (CH3COOH - CH3COO- )
CH3COO- menambah CH3COO- , maka:
Ka = (CH3COO- + CH3COO- ) (H+ ) / (CH3COOH - CH3COO- )
Konsentrasi CH3COO- sangat kecil, sehingga diabaikan.
Jadi, H+ = Ka. CH3COOH / CH3COO- = Ka
asam
garam
2. Campuran basa lemah dengan asam konjugatnya (misalnya NH4OH dengan NH4Cl).
NH4Cl NH4+ + Cl- (terurai sempurna)
dan
NH4OH NH4+ + OHKb = (NH4+ ) (OH- ) / (NH4OH - NH4+ )
NH4+ menambah NH4+ , maka:
Kb = (NH4+ + NH4+ ) (OH- ) / (NH4+ - NH4OH)
Konsentrasi NH4+ sangat kecil, sehingga diabaikan.
Jadi, OH- = Kb. NH4OH / NH4+ = Kb
basa
garam
PENURUNAN RUMUS (H+) DAN (OH-) HIDROLISIS GARAM
1. Hidrolisis garam yang berasal dari asam lemah, basa kuat. (misalnya CH3COONa)
CH3COONa CH3COO- +Na+
Na+ tidak terhidrolisis, karena komponen basa kuat.
Hidrolisis
CH3COO- + H2O CH3COOH + OHKh = CH3COOH x OH- / (CH3COO- - CH3COOH)
Karena CH3COOH sangat kecil, maka
H
x
H
Kh = CH3COOH x OH / CH3COO
Kh = (H+)( OH-) x
CH3COOH
/ CH3COO-
Kh = Kw
1
Ka
Kembali ke rumus Kh = CH3COOH x OH- / CH3COOKarena CH3COOH = OH- (mengapa?), maka:
Kh = (OH-)2 / CH3COO- (Kh = )
(OH-)2 =
Kw
x CH3COO- (lanjutkan..)
Ka
2. Hidolisis dari garam yang berasal dari basa lemah, asam kuat. (misalnya NH4Cl)
NH4Cl NH4+ + ClCl- tidak terhidrolisis, karena komponen asam kuat.
Hidrolisis
+
4
NH + H2O NH4OH + H+
Kh = (NH4OH) x (H+) / (NH4+ - NH4OH)
Karena NH4OH sangat kecil, maka:
OH
+
+
Kh = (NH4OH) x (H ) / (NH4 ) x
OH
Kh = (H+)( OH-) x
Kh = Kw
1
Ka
NH 4OH
OH
/ NH4+
Kembali ke rumus Kh = (NH4OH) x (H+) / NH4+ .
Karena (NH4OH) = (H+), maka lanjutkan..
3. Jika garamnya berasal dari asam lemah dan basa lemah. Maka rumus pH nya, cari
sendiri..!
Note:
Jika senyawa garam mengandung basa kuat dan asam lemah, misalnya CH3COONa, maka
pHnya pasti atas tujuh. Demikian juga sebaliknya.
Besarnya pH dari hidrolisis garam tsb tidak terlalu besar atau terlalu kecil (kira-kira
mendekati 5 sampai 9).
Penjelasan di atas tidak sepenuhnya benar. Semoga ada manfaatnya.
Anda mungkin juga menyukai
- Kimia LarutanDokumen43 halamanKimia LarutanRere NarendraBelum ada peringkat
- Kelompok 10 - VOLUME BERDASARKAN KULIT SILINDERDokumen8 halamanKelompok 10 - VOLUME BERDASARKAN KULIT SILINDERREKA FADLIA ELVANTIO 2020Belum ada peringkat
- Cara Menghitung PH Dan POH Larutan Penyangga Buffer Asam Dan BasaDokumen3 halamanCara Menghitung PH Dan POH Larutan Penyangga Buffer Asam Dan BasaBenih Intan Sejati100% (1)
- Penentuan Kadar Asam AsetatDokumen8 halamanPenentuan Kadar Asam AsetatAndreas Simon SugandaBelum ada peringkat
- KimiaDokumen7 halamanKimiaRina PuspitasariBelum ada peringkat
- C Menghitung PH Larutan PenyanggaDokumen2 halamanC Menghitung PH Larutan PenyanggafitriBelum ada peringkat
- Daftar Nama AsamDokumen11 halamanDaftar Nama AsamMuhamadAfifHajiMamatBelum ada peringkat
- Kim LKDokumen6 halamanKim LKChicken InsideBelum ada peringkat
- Laporan Hasil Praktikum KimiaDokumen11 halamanLaporan Hasil Praktikum KimiaYoan Melani0% (1)
- Kimia AnalisaDokumen41 halamanKimia AnalisaDio IrsyadBelum ada peringkat
- Persamaan Ionisasi AirDokumen24 halamanPersamaan Ionisasi AirYogi Selfian MartadinataBelum ada peringkat
- Larutan PenyanggaDokumen7 halamanLarutan Penyanggaika guniartiBelum ada peringkat
- Kekuatan Relatif Asam Dan BasaDokumen3 halamanKekuatan Relatif Asam Dan Basacrownclown69100% (1)
- AsamDokumen9 halamanAsamAris MBelum ada peringkat
- Menentukan Konsentrasi Asam Asetat Dalam Cuka DapurDokumen9 halamanMenentukan Konsentrasi Asam Asetat Dalam Cuka DapurHariadi100% (1)
- Buku Kimia Organik 1Dokumen14 halamanBuku Kimia Organik 1Queen ARMYBelum ada peringkat
- Laporan Praktikum Kimia DasarDokumen21 halamanLaporan Praktikum Kimia DasarCAsalsabila F MBelum ada peringkat
- Modul Kurva TitrasiDokumen6 halamanModul Kurva TitrasiSawabi NursaiwanBelum ada peringkat
- Praktikum Kimia Uji Sifat Koligatif LarutanDokumen8 halamanPraktikum Kimia Uji Sifat Koligatif LarutanJufry CrystianicoBelum ada peringkat
- Ardianto - Contoh Soal Orde Reaksi, Materi Asam Basa Dan RadioaktivitasDokumen21 halamanArdianto - Contoh Soal Orde Reaksi, Materi Asam Basa Dan RadioaktivitasArdi Kun AgueroBelum ada peringkat
- Senyawa HidratDokumen2 halamanSenyawa HidratPenggemmar AgitaBelum ada peringkat
- 9.materi AjarDokumen10 halaman9.materi Ajardeti_chem7899Belum ada peringkat
- Tugas 1 Senyawa Organik MonofungsiDokumen4 halamanTugas 1 Senyawa Organik MonofungsiNita AbeliaBelum ada peringkat
- Laporan Praktikkum KimiaDokumen11 halamanLaporan Praktikkum KimiaRiniiBelum ada peringkat
- LKS Potensial SelDokumen6 halamanLKS Potensial Selyunita hamsariBelum ada peringkat
- Laporan Praktikum KimiaDokumen8 halamanLaporan Praktikum Kimiaandriyanysah0% (1)
- Soal Latihan EnergetikaDokumen1 halamanSoal Latihan EnergetikaFatma BadewiBelum ada peringkat
- 02 Tugas Essay (Kelompok 2) (Off A) - Kesetimbangan KimiaDokumen8 halaman02 Tugas Essay (Kelompok 2) (Off A) - Kesetimbangan KimiaLina Nachin TimanoyoBelum ada peringkat
- Soal-Soal Kesetimbangan KimiaDokumen2 halamanSoal-Soal Kesetimbangan KimiayuriantiBelum ada peringkat
- Reaksi Ke Dalam AnionDokumen37 halamanReaksi Ke Dalam AnionDamacasta Ardeliapta EdivtaputriBelum ada peringkat
- Indikator Dan Trayek Perubahan WarnaDokumen5 halamanIndikator Dan Trayek Perubahan WarnaHaris Setiawan100% (1)
- Tata Nama SenyawaDokumen3 halamanTata Nama SenyawaVisti RestuBelum ada peringkat
- Soal Ikatan Kimia Kel.4aDokumen15 halamanSoal Ikatan Kimia Kel.4aLathifah RamadhaniBelum ada peringkat
- Aldehid Dan KetonDokumen23 halamanAldehid Dan KetonVeisy Dianty LengkeyBelum ada peringkat
- Hukum RaoultDokumen4 halamanHukum RaoultAlmer SudhiartaBelum ada peringkat
- 6.kesetimbangan KimiaDokumen36 halaman6.kesetimbangan KimiashasaBelum ada peringkat
- Laporan PHDokumen6 halamanLaporan PHFaisal ArsyadBelum ada peringkat
- Laporan Hasil Praktikum Laju Reaksi 2Dokumen3 halamanLaporan Hasil Praktikum Laju Reaksi 2Kurt DelacruzBelum ada peringkat
- Tugas Pendahuluan Perc 3Dokumen1 halamanTugas Pendahuluan Perc 3Khairun NisaBelum ada peringkat
- Sma Negeri 1 Yogyakarta: Ah Istimewa Yogyakarta Dinas Pendidikan, Pemuda, Dan OlahragaDokumen12 halamanSma Negeri 1 Yogyakarta: Ah Istimewa Yogyakarta Dinas Pendidikan, Pemuda, Dan Olahragaansay wBelum ada peringkat
- Perc.1 - Laporan Kimia Dasar IIDokumen15 halamanPerc.1 - Laporan Kimia Dasar IILingga Endar WijayaBelum ada peringkat
- 2-SOAL LATIHAN Kesetimbangan KimiaDokumen2 halaman2-SOAL LATIHAN Kesetimbangan KimiaRicky HuBelum ada peringkat
- Senyawa Kompleks Dan Tata Nama Senyawa KompleksDokumen11 halamanSenyawa Kompleks Dan Tata Nama Senyawa KompleksMa'arif A. SyafiiBelum ada peringkat
- Oksidasi AlkoholDokumen7 halamanOksidasi Alkoholaldillah_putriBelum ada peringkat
- SISTEM PERIODIK UnsurDokumen24 halamanSISTEM PERIODIK UnsurNopita AdriyantiBelum ada peringkat
- Sifat Koligatif LarutanDokumen16 halamanSifat Koligatif LarutanKafitaBelum ada peringkat
- Pengertian Aluminium - HyamnDokumen5 halamanPengertian Aluminium - Hyamnindra purnamaBelum ada peringkat
- Laporan Praktikum Faktor - Faktor Laju ReaksiDokumen25 halamanLaporan Praktikum Faktor - Faktor Laju ReaksiFaishol MuhammadBelum ada peringkat
- Laporan Praktikum KimiaDokumen6 halamanLaporan Praktikum KimiaaufaBelum ada peringkat
- Hidrolisis Garam 1Dokumen4 halamanHidrolisis Garam 1CHakun 1999Belum ada peringkat
- Kimia 3Dokumen12 halamanKimia 3RisaRinggalihBelum ada peringkat
- Sifat AlkunaDokumen5 halamanSifat AlkunaVina ErfinaBelum ada peringkat
- Hidrolisis Sistem BufferDokumen23 halamanHidrolisis Sistem BufferErsalina NidiantiBelum ada peringkat
- Modul HidrolisisDokumen7 halamanModul HidrolisisAminah Uswatun HasanahBelum ada peringkat
- Hidrolisis GaramDokumen11 halamanHidrolisis GaramRetri AtikaBelum ada peringkat
- Asam Dan Basa - 1Dokumen45 halamanAsam Dan Basa - 1dedybaru8888Belum ada peringkat
- Kesetimbangan Asam BasaDokumen10 halamanKesetimbangan Asam BasaWiri Resky AmaliaBelum ada peringkat
- Pengayaan KIMIA - Larutan Penyangga (Alfina Nurpiana 11 MIPA 3)Dokumen23 halamanPengayaan KIMIA - Larutan Penyangga (Alfina Nurpiana 11 MIPA 3)Alfina NurpianaBelum ada peringkat
- MODUL Larutan Penyangga MamahDokumen7 halamanMODUL Larutan Penyangga Mamahfadhila anjaniBelum ada peringkat
- Soal UlanganDokumen1 halamanSoal UlanganNita YunitaBelum ada peringkat
- MGM DataDokumen1 halamanMGM DataNita YunitaBelum ada peringkat
- Senin 11 April 3 Selasa 12 April 3 Rabu 13 April 4.5 Kamis 14 April 4.5 Jumat 15 April 4.5 Sabtu 16 AprilDokumen197 halamanSenin 11 April 3 Selasa 12 April 3 Rabu 13 April 4.5 Kamis 14 April 4.5 Jumat 15 April 4.5 Sabtu 16 AprilNita YunitaBelum ada peringkat
- SOAL LATIHAN TermokimiaDokumen2 halamanSOAL LATIHAN TermokimiaNita YunitaBelum ada peringkat
- Ulangan Kelas X. Kimia 10 SoalDokumen3 halamanUlangan Kelas X. Kimia 10 SoalNita YunitaBelum ada peringkat
- Soal Kimia Kelas X STOIKIOMETRIDokumen3 halamanSoal Kimia Kelas X STOIKIOMETRINita YunitaBelum ada peringkat
- LEMBAR KERJA SISWA Pereaksi PembatasDokumen1 halamanLEMBAR KERJA SISWA Pereaksi PembatasNita YunitaBelum ada peringkat
- Lks Penyangga - Nita Yunita - SPDDokumen2 halamanLks Penyangga - Nita Yunita - SPDNita Yunita100% (1)
- LEMBAR KERJA SISWA Pereaksi PembatasDokumen1 halamanLEMBAR KERJA SISWA Pereaksi PembatasNita YunitaBelum ada peringkat
- Ulangan Harian Kimia Kelas X Miaa 10Dokumen3 halamanUlangan Harian Kimia Kelas X Miaa 10Nita YunitaBelum ada peringkat
- Booklet - Beasiswa LPDP Bismillah Goal PDFDokumen77 halamanBooklet - Beasiswa LPDP Bismillah Goal PDFAyu Sajida Da'ad Arini100% (1)
- (Nita) Angket Penilaian Diri, Csob Oleh Tutor, Tutor Oleh CsobDokumen14 halaman(Nita) Angket Penilaian Diri, Csob Oleh Tutor, Tutor Oleh CsobNita YunitaBelum ada peringkat
- Face Recog Perbedaan Face Detection Dan Face RecognitionDokumen2 halamanFace Recog Perbedaan Face Detection Dan Face RecognitionNita YunitaBelum ada peringkat
- ProfileDokumen16 halamanProfileNita YunitaBelum ada peringkat
- 1207148160Dokumen13 halaman1207148160Nita YunitaBelum ada peringkat
- Lingkungan HijauDokumen1 halamanLingkungan HijauNita YunitaBelum ada peringkat
- 1.a. Permendiknas No. 22 Th. 2006 Standar IsiDokumen2 halaman1.a. Permendiknas No. 22 Th. 2006 Standar IsiSumantri NdutBelum ada peringkat
- Kajian MasalahDokumen5 halamanKajian MasalahNita YunitaBelum ada peringkat