Skrip Atk
Diunggah oleh
Email Tugas0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
35 tayangan5 halamanJudul Asli
skrip atk
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
35 tayangan5 halamanSkrip Atk
Diunggah oleh
Email TugasHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 5
Assalamualaikum warahmatullahi wabarakatuh
Selamat pagi profesor chandra dan teman-teman semua.
Perkenalkan nama saya Hanifa Nabila perwakilan dari kelompok
2 yang akan mempresentasikan materi hari ini, yaitu enthalpi
changes for phase transitions.
Tujuan dari mempelajari materi ini adalah
1. Agar dapat memperkirakan panas fusi dan panas vaporisasi
dengan menggunakan rumus empiris, atau melihat dari tabel
referensi
2. Agar dapat memperkirakan nilai panas vaporisasi
menggunakan rumus clausius clapeyron atau plot othmer
3. Agar dapat menghitung perubahan entalpi dari susbstansi
termasuk transisi fase
Ada beberapa bentuk perubahan entalpi. Yang pertama
adalah heat of fusion yang disertai perubahan fase dari padat
ke cair. Selanjutnya ada heat of vaporization, yang disertai
perubahan fase dari cair ke uap, Heat of condensation yaitu
perubahan fase dari uap ke cair, dan heat of sublimation
dengan perubahan fase dari padat ke gas.
Dalam menghitung entalpi, dapat dilihat bahwa heat
capacity berhenti pada titik transisi fase. Perubahan entalpi
pada transisi fase disebut latent heat changes.
Ini adalah grafik perubahan entalpi air pada 1 atmosfer.
Sumbu x menunjukkan temperatur dan sumbu y menunjukan
perubahan entalpi.
Selanjutnya adalah heat of fusion. Heat of fusion atau panas
peleburan tidak dapat diperkirakan dengan akurat. Panas fusi
untuk beberapa elemen dan senyawa dapat diperkirakan
sebagai berikut. Delta h fusi per delta h tf bernilai konstan
dimana delta hf adalah molar heat of fusion dalam satuan
kalori per gram mol dan tf adalah titik lebur dengan satuan
k.
Untuk elemen bernilai 2-3, untuk senyawa anorganik
bernilai 5-7, dan untuk senyawa organik bernilai 9-11.
Berikutnya adalah heat of vaporization. Ada 3 cara untuk
memperkirakan nilai perubahan entalpi dengan akurat, yaitu
dengan persamaan clausius clapeyron, persamaan chen, dan
persamaan watson.
Pertama adalah persamaan clapeyron. Persamaan clapeyron
adalah sebuah hubungan termodinamika antara kemiringan
dari kurva tekanan uap dengan panas molar uap, yang dapat
dituliskan sebagai berikut.
Rumusnya dibaca
Untuk gas non ideal, dapat menggunakan rumus sebagai
berikut 4.13
Jika Vl diabaikan pada perbandingan Vg dan hukum gas
ideal berlaku pada uap, maka nilai vg adalah sebagai berikut.
Nilai vg ini kemudian di substitusi ke persamaan 4.12
sehingga rumus clausius clapeyron dapat dituliskan sebagai
berikut (baca di pptnya).
Yang kedua adalah persamaan chen
Berikut ini adalah persamaan chen, dimana Tb adalah titik
didih normal liquid dalam satuan Kelvin, dan pc adalah
tekanan kritis di atmosfer
Dan yang ketiga adalah persamaan watson. Persamaan ini
dihitung dengan menggunakan entalpi penguapan pada titik
didih normal. Berikut adalah persamaan watson, dimana
delta Hv2 adalah panas penguapan dari cairan murni pada
T2 dan delta Hv1 adalah panas penguapan dari cairan yang
sama pada T1
Berikut adalah contoh soal perhitungan panas penguapan
dari persamaan clausius clapeyron.
Baca soalnya
Data tekanan dari asam isobutirat adalah sebagai berikut.
Dapat dilihat dari data ditabel bahwa tidak ada data untuk
suhu 200, sehingga digunakan temperatur 179,8 dan 217
derajat celcius.
Karena nilai delta hv pada rentang suhu pendek, maka
nilainya dapat ditemukan yaitu 45.483 joule/gram mol pada
200 derajat C
Selanjutnya ada plot substansi referensi
Ada 2 metode untuk menentukan kalor penguapan molal
pada berbagai temperatur melalui perbandingan antara delta
h v dari cairan yang tidak diketahui dan dengan cairan yang
diketahui. Adapun cara-cara tersebut yaitu :
1. Duhring plot
Suhu dari senyawa yang dicari diplot dengan temperatur
dari suhu cairan yang diketahui pada tekanan uap yang
sama.
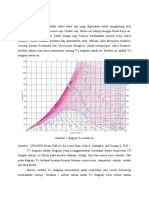
2. Othmer plot
Pada dasarnya, plot othmer memiliki konsep yang sama
dengan duhring plot. Tetapi, yang diplot adalah logaritma
dari tekanan uap kedua senyawa pada temperatur yang
sama. Dapat dilihat pada gambar ini. Plot dari log 10 pa
dilawankan dengan log 10 p ref pada temperatur yang
sama, menghasilkan sebuah garis lurus pada rentang suhu
yang luas.
Untuk mengetahui bagaimana cara kerja othmer plot
dalam menentukan kalor penguapan dari senyawa A,
persamaan clapeyron dapat diaplikasikan pada setiap
substansi dan terbentuklah rasio sebagai berikut
Dengan menggunakan nilai tekanan uap pada temperatur
yang sama, nilai slope dari othmer plot dapat ditemukan
Selain itu, untuk menghitung nilai dari kalor penguapan,
dapat menggunakan persamaan berikut.
Persamaan ini bekerja dengan efektif dan menghasilkan
garis lurus melalui titik pca = 1 dan tca=1
Berikut ini adalah Contoh soal menggunakan othmer plot.
Baca soalnya
Kurang 1 soal
Contoh soal berikutnya adalah berapakah nilai perubhana
entalpi dari 1kg air dari es pada suhu 0 derajat celcius
menjadi uap pada suhu 120 derajat celicus dan 100 kilo
pascal?
Pada soal ini, yang akan digunakana adalah delta hf dan
delta hv untuk perhitungan perubahan entalpi overall.
Gambar ini menunjukkan 2 jalan berbeda untuk
menghitung delta h. Jalan yang akan dipilih adalah A-B-
C-D-E dengan data delta hf dan delta hc yg tertera pada
slide berikut, demikian pula dengan persamaan kapasitas
kalor yang akan digunakan. Dari semua data dan
persamaan yang ada, nilai delta h overall dapat dihitung
hingga ditemukan hasil 3048 J/gram.
Anda mungkin juga menyukai
- Kimia AnalitikDokumen3 halamanKimia AnalitikElfa NofiaBelum ada peringkat
- Permasalahan 1Dokumen14 halamanPermasalahan 1Nanda Mas'ulaBelum ada peringkat
- 11suhu Dan KalorDokumen16 halaman11suhu Dan KalorDhilah Harfadhilah FakhirahBelum ada peringkat
- Kelompok 1 Kelas ADokumen8 halamanKelompok 1 Kelas Aahmad faisal rosidiBelum ada peringkat
- Tugas Makalah FisikaDokumen19 halamanTugas Makalah FisikaayamBelum ada peringkat
- Modul XI Semua, (Fisika), MetaDokumen22 halamanModul XI Semua, (Fisika), MetaJilbabku IbadahkuBelum ada peringkat
- Gas & Titik NolDokumen14 halamanGas & Titik NolTheresiya D. TandiBelum ada peringkat
- Gas & Titik Nol AbsolutDokumen17 halamanGas & Titik Nol Absolutsuci50% (2)
- Gas Dan Titik Nol AbsolutDokumen25 halamanGas Dan Titik Nol AbsolutSay UlalaBelum ada peringkat
- Suhu Dan Temometer TeksDokumen8 halamanSuhu Dan Temometer TeksJuang Hayon89Belum ada peringkat
- Chapter03 en IdDokumen56 halamanChapter03 en IdAngga QurniawanBelum ada peringkat
- Suhu Dan KalorDokumen29 halamanSuhu Dan KalorHendrik AlfarisiBelum ada peringkat
- Modul 4 SPT1 Siklus Rankine, Tabel UapDokumen30 halamanModul 4 SPT1 Siklus Rankine, Tabel UapBANTUAN LOGIN100% (1)
- Entalpi Dan EntropiDokumen10 halamanEntalpi Dan EntropiRahmad Hidayat Boli100% (1)
- 11suhu Dan KalorDokumen15 halaman11suhu Dan KalorIntan Cahyani SariBelum ada peringkat
- Bab I Suhu Dan Kalor Standar Kompetensi: Kompetensi DasarDokumen22 halamanBab I Suhu Dan Kalor Standar Kompetensi: Kompetensi DasarAndrizalBelum ada peringkat
- Komposisi MigasDokumen53 halamanKomposisi MigasAsnieBelum ada peringkat
- Suhu Dan KalorDokumen12 halamanSuhu Dan KalorAkwila TampubolonBelum ada peringkat
- Suhu Dan Kalor 11Dokumen14 halamanSuhu Dan Kalor 11MASGOENBelum ada peringkat
- Modul 8 KB 1Dokumen14 halamanModul 8 KB 1nurulaida1818Belum ada peringkat
- Siklus RankineDokumen23 halamanSiklus RankineZainal Arifin BGBelum ada peringkat
- SuhuDokumen32 halamanSuhuFIRMAN AL FATIRBelum ada peringkat
- Termodinamika Sifat Uap AirDokumen9 halamanTermodinamika Sifat Uap Airraden_aditiya39100% (1)
- Bab 4 Panas LatenDokumen2 halamanBab 4 Panas LatenDewi mustikaBelum ada peringkat
- Suhu Dan KalorDokumen48 halamanSuhu Dan KalorSuburA.NugrohoBelum ada peringkat
- Perpindahan PanasDokumen16 halamanPerpindahan PanasJun MahardikaBelum ada peringkat
- 03 Perpindahan Panas KonveksiDokumen34 halaman03 Perpindahan Panas Konveksitekkim12Belum ada peringkat
- Materi TermodinamikaDokumen22 halamanMateri TermodinamikaRiyanBelum ada peringkat
- Modul 4 SPT1 Siklus Rankine, Tabel Uap (Orisinil)Dokumen34 halamanModul 4 SPT1 Siklus Rankine, Tabel Uap (Orisinil)Muhammad Dzakwan 'Afif NasutionBelum ada peringkat
- TERMOFISIKADokumen14 halamanTERMOFISIKAErry MaRiany0% (1)
- Siklus RankineDokumen19 halamanSiklus RankineAlexanderTassya100% (1)
- HukumDasarTermodinamika DarDokumen21 halamanHukumDasarTermodinamika DarNang PoDolBelum ada peringkat
- TERMODINAMIKADokumen21 halamanTERMODINAMIKALia Simanullang15Belum ada peringkat
- Acara V Entalpi Penguapan EterDokumen10 halamanAcara V Entalpi Penguapan EterRizki Amalia PBelum ada peringkat
- Hukum TermodinamikaDokumen13 halamanHukum TermodinamikaRiska MaryatiBelum ada peringkat
- Siklus RankineDokumen4 halamanSiklus Rankinehina raya100% (1)
- Riview 4, Shafa Frida Takarina, 3332200083Dokumen3 halamanRiview 4, Shafa Frida Takarina, 3332200083muhammad zidan abdillahBelum ada peringkat
- Treybal, Robert E. (1) - Bab Vii. Operasi Humidifikasi - Kurva Tekanan Uap - MZDokumen19 halamanTreybal, Robert E. (1) - Bab Vii. Operasi Humidifikasi - Kurva Tekanan Uap - MZamaliaBelum ada peringkat
- Penentuan Berat Molekul Berdasarkan Massa Jenis GasDokumen14 halamanPenentuan Berat Molekul Berdasarkan Massa Jenis GasChi Chachi ChanBelum ada peringkat
- Thermodynamic PembangkitDokumen27 halamanThermodynamic PembangkitSiti Marwah SyarifBelum ada peringkat
- Bab 1 AtkinsDokumen20 halamanBab 1 AtkinsBerliana Dwi SeptianiBelum ada peringkat
- Tugas Prakfis Lanjut Termometer Gas Volume KonstanDokumen5 halamanTugas Prakfis Lanjut Termometer Gas Volume KonstanAlfira AnandaBelum ada peringkat
- Thermo 2 CicaDokumen17 halamanThermo 2 CicaNur AzisahBelum ada peringkat
- GEOTERMODINAMIKADokumen3 halamanGEOTERMODINAMIKAVic Hanya ButarBelum ada peringkat
- ScriptDokumen8 halamanScriptAnnisa Rizka PratiwiBelum ada peringkat
- 0212075901-22-MSN 212-2013-Kw3a-03-Pertemuan 3 Properti Zat Murni Dan Karakteristik Gas IdealDokumen6 halaman0212075901-22-MSN 212-2013-Kw3a-03-Pertemuan 3 Properti Zat Murni Dan Karakteristik Gas IdealpermonoBelum ada peringkat
- KimiaDokumen11 halamanKimiaWindaBelum ada peringkat
- Makalah Fisika (Suhu & Kalor)Dokumen12 halamanMakalah Fisika (Suhu & Kalor)Rifa HayyuniBelum ada peringkat
- Tugas Statistik Yuanita Versitina - A24119008Dokumen5 halamanTugas Statistik Yuanita Versitina - A24119008Yuanita VeristinaBelum ada peringkat
- Materi Dan Tugas Fisika Tugas Ke 3Dokumen16 halamanMateri Dan Tugas Fisika Tugas Ke 3ervinna paneBelum ada peringkat
- Dasar Dasar AliranDokumen49 halamanDasar Dasar Alirandeny_herinBelum ada peringkat
- MAKALAH Hukum II TermodinamikaDokumen11 halamanMAKALAH Hukum II Termodinamikairadelina100% (1)
- Materi Fiisika KalorDokumen8 halamanMateri Fiisika Kalorhadifah suaibBelum ada peringkat
- Humidifikasi Dan DehumidifikasiDokumen8 halamanHumidifikasi Dan DehumidifikasiHana NurdinaBelum ada peringkat
- Materi Kuliah PP2Dokumen25 halamanMateri Kuliah PP2MultazamBelum ada peringkat
- Pertanyaan Amonium Nitrat (Roihan)Dokumen1 halamanPertanyaan Amonium Nitrat (Roihan)Email TugasBelum ada peringkat
- Balasan Surat Permohonan Izin - 120921Dokumen1 halamanBalasan Surat Permohonan Izin - 120921Email TugasBelum ada peringkat
- Skrip AtkDokumen5 halamanSkrip AtkEmail TugasBelum ada peringkat
- Skrip Atk 2Dokumen1 halamanSkrip Atk 2Email TugasBelum ada peringkat