Struktur Atom Karbon dan Senyawa Hidrokarbon
Diunggah oleh
shiddiq aryantoDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Struktur Atom Karbon dan Senyawa Hidrokarbon
Diunggah oleh
shiddiq aryantoHak Cipta:
Format Tersedia
Modul Kimia Kelas XI KD 3.
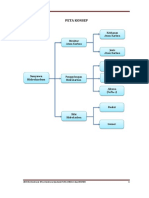
PETA KONSEP
Kekhasan
Atom Karbon
Struktur
Atom Karbon
Jenis
Atom Karbon
Alkana
(CnH2n+2)
Senyawa Penggolongan Alkena
Hidrokarbon Hidrokarbon (CnH2n)
Alkuna
(CnH2n-2)
Reaksi
Sifat
Hidrokarbon
Isomer
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 6
Modul Kimia Kelas XI KD 3.1
KEGIATAN PEMBELAJARAN 1
KEKHASAN ATOM KARBON DAN STRUKTUR ATOM KARBON
A. Tujuan Pembelajaran
Setelah mempelajari modul kegiatan pembelajaran 1 ini kalian diharapkan mampu
menganalisis kekhasan atom karbon dan struktur atom karbon.
B. Uraian Materi
Salah satu rumpun senyawa yang melimpah di alam adalah senyawa karbon. Senyawa
ini tersusun atas atom karbon dan atom-atom lain yang terikat pada atom karbon,
seperti hidrogen, oksigen, nitrogen, dan atom karbon itu sendiri. Salah satu senyawa
karbon paling sederhana adalah hidrokarbon. Hidrokarbon banyak digunakan
sebagai komponen utama minyak bumi dan gas alam.
Tentu tidak asing lagi bagi kalian penggunaan gas elpiji untuk keperluan masak di
rumah tangga seperti tampak pada gambar berikut.
Gambar 1. Tabung gas LPG
Lalu apakah kekhasan dari atom karbon? Bagaimanakah atom karbon membentuk
senyawa hidrokarbon? Bagaimanakah menggolongkan senyawa hidrokarbon? Mari
simak penjelasan berikut ini.
1. Kekhasan Atom Karbon
a. Atom karbon membentuk empat ikatan kovalen
Atom karbon (C) merupakan pemeran utama dalam mempelajari hidrokarbon.
Atom C ini memiliki karakteristik yang khas dibanding atom lainnya.
Karakteristik itu adalah kemampuannya membentuk rantai C yang panjang.
Mengapa bisa? Perhatikan konfigurasi atom C berikut !
6C : 1s2 2s2 2p2, dari konfigurasi elektronnya dapat dinyatakan elektron
valensinya = 4
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 8
Modul Kimia Kelas XI KD 3.1
Peristiwa ini disebabkan atom C mempunyai empat elektron valensi yang
dapat berikatan kovalen dengan atom sejenis atau atom lain.
b. Atom karbon membentuk ikatan jenuh maupun tak jenuh
Atom karbon dapat berikatan dengan atom karbon lain membentuk rantai
karbon dengan iktan tunggal, ikatan rangkap dua atau ikatan rangkap tiga.
Gambar 2. Beberapa jenis ikatan kovalen pada atom C
c. Atom karbon membentuk rantai terbuka maupun tertutup
Atom C dapat berikatan dengan atom C lain (sejenis), bahkan dapat
membentuk rantai atom atom C baik alifatik (terbuka: lurus dan bercabang)
maupun siklik (tertutup).
Gambar 3. Rantai karbon: (1) rantai lurus; (2) rantai cabang;
(3) rantai tertutup; (4) jaring
2. Struktur Atom Karbon
Berdasarkan kemampuan atom karbon yang dapat berikatan dengan atom karbon
lain, jenis atom karbon dikelompokkan menjadi empat, yaitu atom karbon primer,
sekunder, tersier, dan kuartener. Istilah ini didasarkan pada jumlah atom karbon
yang terikat pada atom karbon tertentu.
a. Atom karbon primer
Atom karbon primer (C primer) adalah atom-atom karbon yang mengikat satu
atom karbon lain.
Contoh: Perhatikan senyawa berikut!
Dalam struktur senyawa hidrokarbon tersebut, coba kalian tentukan ada
berapa buah atom C primer dan beri tanda!
Mari kita perhatikan struktur senyawa karbon di atas!
Senyawa tersebut terdiri dari enam buah atom C, atom karbon yang berikatan
dengan satu atom karbon lain ada empat buah, yang ditandai dengan struktur
dalam senyawa berupa –CH3, seperti tampak pada gmbar berikut.
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 9
Modul Kimia Kelas XI KD 3.1
b. Atom karbon sekunder
Atom karbon sekunder (atom C sekunder) adalah atom-atom karbon yang
mengikat dua atom karbon tetangga.
Contoh: Perhatikan atom C yang ditandai pada senyawa berikut.
Atom C yang ditandai pada senyawa di samping merupakan atom C
sekunder, karena diapit oleh dua atom C yang lain.
c. Atom karbon tersier
Atom karbon tersier (atom C tersier) adalah atom-atom karbon yang
mengikat tiga atom karbon tetangga.
Contoh: Coba perhatikan senyawa di atas, adakah atom C tersiernya?
Ada ternyata! Jadi, senyawa di samping memiliki 1 atom C tersier. Lihat! Dia
diapit oleh tiga atom C lain.
d. Atom karbon kuarterner
Atom karbon kuartener (dilambangkan dengan 40) adalah atom-atom karbon
yang mengikat empat atom karbon tetangga.
Contoh: Perhatikan senyawa ini, bisakah kalian menemukan atom C kuartener?
Atom C kuarterner diapit oleh empat atom C lain.
Senyawa di atas ternyata hanya memiliki satu atom C kuartener yaitu yang di
beri tanda lingkaran.
C. Rangkuman
1. Kekhasan atom karbon adalah
- mampu membentuk 4 ikatan kovalen baik tunggal, rangkap 2, rangkap 3
dengan atom C atau atom lain.
- mampu membentuk rantai karbon baik terbuka atau tertutup.
2. Senyawa hidrokarbon adalah senyawa yang mengandung unsur C dan H. Contoh:
alkana, alkena, dan alkuna.
3. Berdasarkan kedudukan atom C dalam rantai karbon dapat dkelompokkan
menjadi atom C primer, atom C sekunder, atom C tersier dan atom C kuartener.
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 10
Modul Kimia Kelas XI KD 3.1
D. Penugasan Mandiri
Jawablah soal-soal berikut!
1. Tuliskan kekhasan atom karbon sehingga mampu membentuk senyawa karbon
yang jumlahnya sangat banyak di alam
2. Atom karbon dapat membentuk rantai karbon rantai terbuka maupun rantai
tertutup, gambarkan contoh senyawa karbon rantai terbuka dan rantai lurus.
3. Dari struktur senyawa karbon berikut :
a. tentukan atom C nomor berapa saja yang termasuk atom C primer, sekunder,
tersier dan kuarterner!
b. berapa jumlah masing-masing atom C primer, sekunder, tersier dan
kuarterner?
E. Latihan Soal
Jawablah soal-soal latihan berikut dengan jujur tanpa melihat kunci jawaban!
1. Senyawa hidrokarbon adalah senyawa yang molekulnya terdiri dari ....
A. atom karbon dan molekul air
B. atom karbon dan atom hidrogen
C. atom C, H, O, dan N
D. atom C, O , N, dan sedikit P, S, Cl
E. atom karbon dan atom-atom nonlogam
2. Gas hasil pembakaran sempurna senyawa hidrokarbon adalah ....
A. C
B. O2
C. CO
D. H2
E. CO2
3. Atom karbon mempunyai ke khasan. Pernyataan yang tepat mengenai kekhasan
atom karbon adalah…
A. Karbon mempunyai 4 elektron valensi yang mampu membentuk ikatan
kovalen
B. Kabon mempunyai ukuran relative besar sehingga mampu mengikat semua
unsur
C. Karbon mempunyai 6 elektron valensi sehingga mampu mengikat 6 atom lain
D. Karbon dapat dibuat manusia
E. Karbon dapat membentuk ikatan ion dari keempat electron terluarnya
4. Pasangan zat di bawah ini yang merupakan golongan senyawa hidrokarbon
adalah…
A. C2H6 dan C12H22O11
B. CH4 dan C2H4
C. C2H4 dan C6H12O6
D. CO2 dan H2O
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 11
Modul Kimia Kelas XI KD 3.1
E. CH4 dan CO2
5. Diberikan gambar struktur berikut:
Atom C primer, sekunder, tersier, & kuartener ditunjukkan oleh nomor …..
A. 6, 5, 2, 3
B. 1, 7, 3, 2
C. 10, 9, 5, 3
D. 8, 3, 6, 7
E. 4, 2, 3, 7
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 12
Modul Kimia Kelas XI KD 3.1
Kunci dan Pembahasan Soal Latihan
No Kunci Pembahasan
Jawaban
1. B Senyawa hidrokarbon adalah senyawa karbon yang hanya terdiri
dari atom C dan H
2. E Bila senyawa hidrokarbon dibakar sempurna akan dihasilkan gas
CO2 dan uap air
3. A Karbon mempunyai nomor atom 6 dengan electron valensi 4,
sehingga mampu membentuk empat ikatan kovalen dan dapat
membentuk rantai yang panjang
4. A • Atom C primer adalah atom C yang berikatan dengan satu
atom C lain
• Atom C sekunder adalah atom C yang berikatan dengan dua
atom C lain
• Atom C tersier adalah atom C yang berikatan dengan tiga
atom C lain
• Atom C kuarterner adalah atom C yang berikatan dengan
empat atom C lain
5. B Hidrokarbon adalah senyawa yang terdiri dari atom karbon dan
Hidrogen, sedangkan turunan hidrokarbon berasal dari karbon ,
hIdrogen dan atom lain seperti O
• adalah hidrokarbon dan turunan hidrokarbon
• hidrokarbon dan hidrokarbon
• hidrokarbon dan turunan hidrokarbon
• bukan hidrokarbon dan bukan hidrokarbon
• hidrokarbon dan bukan hidrokarbon
Pedoman Penskoran
Cocokkanlah jawaban kalian dengan Kunci Jawaban yang terdapat di bagian akhir
modul ini. Hitunglah jawaban yang benar. Kemudian, gunakan rumus berikut untuk
mengetahui tingkat penguasaan kalian terhadap materi Kegiatan Belajar 1.
𝐽𝑢𝑚𝑙𝑎ℎ 𝑆𝑘𝑜𝑟 𝑃𝑒𝑟𝑜𝑙𝑒ℎ𝑎𝑛
Nilai = x 100 %
𝐽𝑢𝑚𝑙𝑎ℎ 𝑆𝑘𝑜𝑟 𝑀𝑎𝑘𝑠𝑖𝑚𝑢𝑚
Konversi tingkat penguasaan:
90 - 100% = baik sekali
80 - 89% = baik
70 - 79% = cukup
< 70% = kurang
Apabila mencapai tingkat penguasaan 80% atau lebih, kalian dapat meneruskan
dengan Kegiatan Belajar 2. Bagus! Jika masih di bawah 80%, kalain harus mengulangi
materi Kegiatan Belajar 1, terutama bagian yang belum dikuasai.
@2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 13
Anda mungkin juga menyukai
- Laporan Akar MonokotilDokumen14 halamanLaporan Akar MonokotilswandanaBelum ada peringkat
- Kisi-Kisi Uts Kls XiDokumen6 halamanKisi-Kisi Uts Kls XiMaya MudaBelum ada peringkat
- Laporan PenelitianDokumen2 halamanLaporan PenelitianikhaBelum ada peringkat
- STOIKIOMETRI LARUTANDokumen12 halamanSTOIKIOMETRI LARUTANWidya PutriBelum ada peringkat
- 1Dokumen11 halaman1ChininMessayaBelum ada peringkat
- SoalDokumen17 halamanSoalpujiBelum ada peringkat
- Tahapan Siklus Krebs RingkasDokumen2 halamanTahapan Siklus Krebs RingkasDema SentosaBelum ada peringkat
- UJIAN KIMIA KELAS XI SEMESTER GANJIL 2017Dokumen1 halamanUJIAN KIMIA KELAS XI SEMESTER GANJIL 2017HendriSetiawanBelum ada peringkat
- SenyawaDokumen5 halamanSenyawaNabila FitrianiBelum ada peringkat
- Rangkuman Transpotasi Zat Pada SelDokumen5 halamanRangkuman Transpotasi Zat Pada SelIndah PermatasariBelum ada peringkat
- IDENTIFIKASI UNSUR C, H, DAN ODokumen4 halamanIDENTIFIKASI UNSUR C, H, DAN Osfa2608100% (1)
- PP KimiaDokumen12 halamanPP Kimiacharlie basompeBelum ada peringkat
- singkat berikut ini memenuhi kriteria kurang dari dan menggunakan kata kunci utama dari dokumen yaitu "Argon" dan "Gas MuliaDokumen9 halamansingkat berikut ini memenuhi kriteria kurang dari dan menggunakan kata kunci utama dari dokumen yaitu "Argon" dan "Gas MuliaTyaFattyaBelum ada peringkat
- 8..fluida DinamisDokumen24 halaman8..fluida DinamisEva JatiBelum ada peringkat
- Soal KUIS SDDokumen4 halamanSoal KUIS SDrizkaBelum ada peringkat
- Kecenderungan Atom Mencapai KestabilanDokumen9 halamanKecenderungan Atom Mencapai KestabilanEka WibyatnaBelum ada peringkat
- Arus SearahDokumen26 halamanArus SearahMansur Haris100% (4)
- POST TEST OSK KIMIADokumen14 halamanPOST TEST OSK KIMIAHESTI FITRI100% (1)
- Seutas Kawat Memiliki Luas Penampang 5 Mm2 Ditarik Dengan Gaya Sebesar 4 N Sehingga Panjang Kawat Itu Bertambah Dari 60 CM Menjadi 61 CMDokumen3 halamanSeutas Kawat Memiliki Luas Penampang 5 Mm2 Ditarik Dengan Gaya Sebesar 4 N Sehingga Panjang Kawat Itu Bertambah Dari 60 CM Menjadi 61 CMEkka Adja Dech100% (1)
- Soal Utbk KimiaDokumen5 halamanSoal Utbk KimiaAnnisa MahmudaBelum ada peringkat
- Logam AlkaliDokumen13 halamanLogam AlkaliArmy Adi100% (1)
- ID Pengaruh Latar Belakang Sosial Ekonomi oDokumen1 halamanID Pengaruh Latar Belakang Sosial Ekonomi obaekhyunBelum ada peringkat
- LKS Otot & SendiDokumen2 halamanLKS Otot & SendiGek MasBelum ada peringkat
- Percobaan Kisi DifraksiDokumen4 halamanPercobaan Kisi Difraksielvikaa31Belum ada peringkat
- Resensi Ghost Girl (WON MI JEONG 31)Dokumen4 halamanResensi Ghost Girl (WON MI JEONG 31)Muhammad RamdhanBelum ada peringkat
- Bahasa FarhanDokumen11 halamanBahasa FarhanFauzan BariqBelum ada peringkat
- ION KOMPLEKSDokumen16 halamanION KOMPLEKSyumikotakahashiBelum ada peringkat
- MODULDokumen21 halamanMODULZurfiah Haris ArfiBelum ada peringkat
- Bank Soal Kelas XI - KoloidDokumen16 halamanBank Soal Kelas XI - KoloiddhinaranidhBelum ada peringkat
- FLUIDA DINAMISDokumen21 halamanFLUIDA DINAMISErlina AbeliaBelum ada peringkat
- T04 - Isomer HeptenaDokumen5 halamanT04 - Isomer HeptenaainiiiBelum ada peringkat
- Pembahasan Soal Simak UI Kimia 2010 Kode - 605Dokumen4 halamanPembahasan Soal Simak UI Kimia 2010 Kode - 605SheilaBelum ada peringkat
- Soal Un SBMPTN FisikaDokumen8 halamanSoal Un SBMPTN FisikaSyamsuryadi AdheBelum ada peringkat
- Bab 1 Hidrokarbon Dan Minyak BumiDokumen34 halamanBab 1 Hidrokarbon Dan Minyak BumiLilik Retno WilliantiBelum ada peringkat
- LKS Redoks 3Dokumen5 halamanLKS Redoks 3NaNa NasRawati100% (1)
- 5 6181571585309147220Dokumen16 halaman5 6181571585309147220FredrikBelum ada peringkat
- MAKALAH FISIKaaDokumen16 halamanMAKALAH FISIKaaSulaikha Quratul'AiniBelum ada peringkat
- Lingkaran: D. Hubungan Dua LingkaranDokumen12 halamanLingkaran: D. Hubungan Dua LingkaranMarcel khairanBelum ada peringkat
- Alkali TanahDokumen6 halamanAlkali TanahHadi WahyuBelum ada peringkat
- Xi Mipa 3Dokumen8 halamanXi Mipa 3dinda putriBelum ada peringkat
- 6500 - Teks Eksplanasi Sosial - XI AK 1Dokumen14 halaman6500 - Teks Eksplanasi Sosial - XI AK 1Fitri Nuur AlimahBelum ada peringkat
- Hidrolisis GaramDokumen7 halamanHidrolisis GaramYuke DjuliantiBelum ada peringkat
- Klasifikasi BasidiomycotaDokumen6 halamanKlasifikasi BasidiomycotaHidayatunNaziyahBelum ada peringkat
- Osk Kimia2013Dokumen13 halamanOsk Kimia2013Hanim SuhartiniBelum ada peringkat
- Proposal Hari Bumi BaruDokumen8 halamanProposal Hari Bumi Baruandini dwgBelum ada peringkat
- Gol 6 FixDokumen42 halamanGol 6 FixAgri PahleviBelum ada peringkat
- RASIO TRIGONOMETRIDokumen16 halamanRASIO TRIGONOMETRIDhana SaputraBelum ada peringkat
- F2LDokumen60 halamanF2LName TapaoBelum ada peringkat
- Pasang Surut Air LautDokumen2 halamanPasang Surut Air LautdiahBelum ada peringkat
- TANDA ATOMDokumen2 halamanTANDA ATOMKarina 7735Belum ada peringkat
- Polimer: Struktur, Sifat dan Kegunaan MakromolekulDokumen6 halamanPolimer: Struktur, Sifat dan Kegunaan MakromolekulDeadly BladeBelum ada peringkat
- FisikaDokumen19 halamanFisikanadiartha91Belum ada peringkat
- Asam Karboksilat, Kuliah KO IDokumen28 halamanAsam Karboksilat, Kuliah KO INuklir Energi Massa DepanBelum ada peringkat
- ALKUNADokumen11 halamanALKUNAjea yaumulBelum ada peringkat
- Hidrolisis GaramDokumen10 halamanHidrolisis GaramBeatriks Faustina Sura LegaBelum ada peringkat
- DAMPAK PEMBAKARANDokumen5 halamanDAMPAK PEMBAKARANSri Agustini HidayantiBelum ada peringkat
- Mind Map Sistem Koordinasi, Reproduksi Dan Imun Aura - 2008076089Dokumen3 halamanMind Map Sistem Koordinasi, Reproduksi Dan Imun Aura - 2008076089Aura KuBelum ada peringkat
- STRUKTUR KARBONDokumen26 halamanSTRUKTUR KARBONDiyan SugiyartoBelum ada peringkat
- Materi Final (Senyawa Hidrokarbon)Dokumen28 halamanMateri Final (Senyawa Hidrokarbon)Naswa salsabillahBelum ada peringkat
- Senyawa Hidrokarbon Kimia XIDokumen35 halamanSenyawa Hidrokarbon Kimia XINaukoko KasmirBelum ada peringkat
- Essay Rani NewDokumen4 halamanEssay Rani Newshiddiq aryantoBelum ada peringkat
- Essay Rani NewDokumen4 halamanEssay Rani Newshiddiq aryantoBelum ada peringkat
- Rekapitulasi Daftar Pelanggaran Tata TertibDokumen5 halamanRekapitulasi Daftar Pelanggaran Tata Tertibshiddiq aryanto100% (1)
- Perda Pempov Sumselno. 3 Tahun 2009Dokumen9 halamanPerda Pempov Sumselno. 3 Tahun 2009rika sasmitaBelum ada peringkat
- Kelas 3 Akidah AkhlakDokumen4 halamanKelas 3 Akidah Akhlakshiddiq aryantoBelum ada peringkat
- Rekapitulasi Daftar Pelanggaran Tata Tertib-1Dokumen3 halamanRekapitulasi Daftar Pelanggaran Tata Tertib-1shiddiq aryanto100% (1)
- Kalpend 2223Dokumen5 halamanKalpend 2223shiddiq aryantoBelum ada peringkat
- Ips Kelas 7-1Dokumen5 halamanIps Kelas 7-1shiddiq aryantoBelum ada peringkat
- Berita Acara Rapat Dewan GuruDokumen4 halamanBerita Acara Rapat Dewan Gurushiddiq aryantoBelum ada peringkat
- KEMENTERIAN AGAMA PROVINSI SUMATERA SELATAN MUSYAWARAH KERJA KEPALA MADRASAHDokumen3 halamanKEMENTERIAN AGAMA PROVINSI SUMATERA SELATAN MUSYAWARAH KERJA KEPALA MADRASAHshiddiq aryantoBelum ada peringkat
- REKAPITULASI KEHADIRANDokumen43 halamanREKAPITULASI KEHADIRANshiddiq aryantoBelum ada peringkat
- REKAPITULASI KEHADIRANDokumen43 halamanREKAPITULASI KEHADIRANshiddiq aryantoBelum ada peringkat
- Rekapitulasi Daftar Absensi Siswa Madrasah Aliyah Assalam Al-Islamy TAHUN 2022Dokumen2 halamanRekapitulasi Daftar Absensi Siswa Madrasah Aliyah Assalam Al-Islamy TAHUN 2022shiddiq aryantoBelum ada peringkat
- A.3. Hasil Supervisi Kamad & Resume Hasil Supervisi - 2021Dokumen15 halamanA.3. Hasil Supervisi Kamad & Resume Hasil Supervisi - 2021shiddiq aryantoBelum ada peringkat
- Supervisi GuruDokumen17 halamanSupervisi Gurushiddiq aryantoBelum ada peringkat
- BERITA MADRASAHDokumen4 halamanBERITA MADRASAHshiddiq aryantoBelum ada peringkat
- Rekapitulasi Hasil Supervisi Guru Madrasah Aliyah Assalam Al-Islamy TAHUN 2023 A. Kegiatan Supervisi Guru Oleh Kepala MadrasahDokumen10 halamanRekapitulasi Hasil Supervisi Guru Madrasah Aliyah Assalam Al-Islamy TAHUN 2023 A. Kegiatan Supervisi Guru Oleh Kepala Madrasahshiddiq aryantoBelum ada peringkat
- Jumlah Skor Perolehan KetercapaianDokumen15 halamanJumlah Skor Perolehan Ketercapaianshiddiq aryantoBelum ada peringkat
- KELAS 1 - IPS (Edited by Shiddiq)Dokumen3 halamanKELAS 1 - IPS (Edited by Shiddiq)shiddiq aryantoBelum ada peringkat
- Bahaya Bullying dan Upaya PencegahannyaDokumen2 halamanBahaya Bullying dan Upaya Pencegahannyashiddiq aryantoBelum ada peringkat
- KELAS 2 - IPA (Edited by Shiddiq)Dokumen3 halamanKELAS 2 - IPA (Edited by Shiddiq)shiddiq aryantoBelum ada peringkat
- SMK Cerdas CermatDokumen8 halamanSMK Cerdas Cermatshiddiq aryantoBelum ada peringkat
- KELAS 1 - SKI (Edited by Shiddiq)Dokumen3 halamanKELAS 1 - SKI (Edited by Shiddiq)shiddiq aryantoBelum ada peringkat
- BEBANDokumen3 halamanBEBANshiddiq aryantoBelum ada peringkat
- Story TellingDokumen3 halamanStory Tellingshiddiq aryantoBelum ada peringkat
- Kisi MTK Kelas 5 Semester GenapDokumen2 halamanKisi MTK Kelas 5 Semester Genapshiddiq aryantoBelum ada peringkat
- Resume Hasil Pertemuan RapatDokumen1 halamanResume Hasil Pertemuan RapatRasyid ChannelBelum ada peringkat
- KEJUARAAN PENCAK SILAT SUNGAI LILIN 2022Dokumen1 halamanKEJUARAAN PENCAK SILAT SUNGAI LILIN 2022shiddiq aryantoBelum ada peringkat
- A.7 Pembagian Tugas Jam Ngajar 2021-2022Dokumen30 halamanA.7 Pembagian Tugas Jam Ngajar 2021-2022shiddiq aryantoBelum ada peringkat
- Pembagian Tugas GuruDokumen3 halamanPembagian Tugas Gurushiddiq aryantoBelum ada peringkat