Uraian Materi OK
Diunggah oleh
Nailil MunawarahDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Uraian Materi OK
Diunggah oleh
Nailil MunawarahHak Cipta:
Format Tersedia
Standar Kompetensi
Mendeskripsikan sifat-sifat larutan, metode pengukuran serta terapannya.
Kompetensi Dasar
Mendeskripsikan penurunan tekanan uap, kenaikan titik didih, penurunan titik
beku larutan, dan tekanan osmotik termasuk sifat koligatif
Indikator
Menghitung konsentrasi suatu larutan (Kemolaran, kemolalan, dan fraksi mol)
Menjelaskan pengertian sifat koligatif larutan non elektrolit (hukum Raoulth) dan
larutan elektrolit
Materi
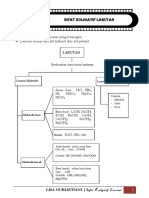
A. SATUAN KONSENTRASI
1. KEMOLARAN = M
Menyatakan jumlah mol zat terlarut dalam satu liter larutan
n n = mol zat terlarut
M = ----- V = volume larutan ( L )
V
2. KEMOLALAN = m
Menyatakan jumlah mol zat terlarut dalam satu kg pelarut
gr X 1000 n = mol zat terlarut
m = ---------------------- p = massa zat pelarut ( kg )
Mr Pelarut
3. FRAKSI MOL = X
Menyatakan jumlah mol zat terlarut dalam satu mol larutan
nA nA = mol zat terlarut
XA = ------------ dan XA + XB = 1 nB = mol zat pelarut
nA + nB
Bahan Ajar Kimia Kelas XII Semester 1 (Andrico Pratama, S. Pd) 1
Contoh
Sebanyak 6 gram urea ( Mr 60 ) dilarutkan dalam 90 gram air.
Tentukanlah :
Kemolalannya
Fraksi Molnya
Jawab :
Kemolalan urea = = 1.1111 molal
Fraksi mol urea = = = 0,02
Larutan glukosa ( Mr 180 ) dengan kadar 18% dengan massa jenis 1,04
Hitunglah :
a. Kemolalannya
b. Molaritas urea
Jawab :
a. Kemolalan urea = x= 1,22 molal
b. Molaritas urea = = = 1,04 molar
Latihan
Sebanyak 11,7gram NaCl ( 58,5 gram/mol ) dilarutkan dalam 100 gram air
(= 1 ). Hitunglah kemolaran, kemolalan dan fraksi mol larutan itu !
Sebanyak 500 mL larutan urea, CO(NH2)2 kadar 20% ( C=12, O=16, N=14, H=1 ) (= 1 ).
Hitunglah kemolaran, kemolalan dan fraksi mol larutan itu !
Larutan NaCl 20% (= 1,2 ). Hitunglah kemolalan dan fraksi mol larutan itu !
( Na=23, Cl=35,5 )
Sebanyak 200 mL larutan asam sulfat pekat 49% dengan massa jenis 1,4 kg/L.
Kemudian diencerkan dengan sampai volumenya menjadi 500 mL Hitunglah
molalitas, molaritas dan fraksi mol asam sulfat tersebut ( H=1, S=32, O=16 )
Bahan Ajar Kimia Kelas XII Semester 1 (Andrico Pratama, S. Pd) 2
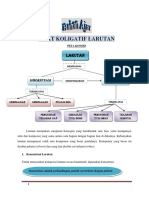
PENGERTIAN DAN JENIS SIFAT KOLIGATIF LARUTAN
A. Pengantar
Nelayan mengawetkan ikan menggunakan es batu. Sejumlah garam ditambahkan
pada es batu agar suhunya menjadi lebih rendah. Demikian juga pedagang es tung-
tung keliling menggunakan es batu yang dicampur garam . Mengapa suhu es batu
yang dicampur garam menjadi lebih rendah? Itulah lah salah satu contoh sifat
koligatif larutan. Nah pada hari ini kita akan menjelajahi segala sesuatu tentang sifat
koligatif larutan.
B. Apakah sifat koligatif larutan itu?
Perhatikan gambar dibawah ini!
Dari gambar diatas apa yang dapat ananda simpulkan? Coba ananda perhatikan
larutan urea, glukosa, dan sukrosa tersebut, ketiga larutan itu memiliki sifat koligatif
larutan yang sama. Bagaimanakah jenis dan ukuran partikel zat terlarutnya?
Kemudian, bagaimana jumlah partikel zat terlarutnya?
Jadi apakah sebenarnya yang dikatakan dengan sifat koligatif larutan?
Jenis partikel zat terlarut………………………………………………………(Sama/ berbeda)
Ukuran partikel zat terlarut……………………………………………………(sama/ berbeda)
Jumlah Partikel zat terlarut……………………………………………………(sama/ berbeda)
Sifat koligatif larutan adalah sifat larutan yang tidak bergantung pada ……………
dan ………….tetapi hanya bergantung pada………………… dalam larutan.
Sifat koligatif larutan dapat dibedakan menjadi 2 macam yaitu:
1. Sifat Koligatif larutan non elektrolit
2. Sifat koligatif larutan elektrolit
Bahan Ajar Kimia Kelas XII Semester 1 (Andrico Pratama, S. Pd) 3
C. Sifat- sifat apa saja yang merupakan sifat koligatif?
Pembentukan larutan (Zat terlarut + zat pelarut) hanya sedikit pengaruhnya
terhadap sifat kimia zat terlarut. Akan tetapi, jika zat terlarut tadi dicampur dengan
pelarutnya untuk membentuk larutan , sifat fisisnya akan berubah drastis.
Perhatikan grafik diagram fase cair berikut!
P A B C D
1 atm
= pelarut
Cair
= larutan
Padat E
= Titik beku larutan
Gas =Titik beku pelarut
F = Titik didih pelarut
T(oC) = Titik didih larutan
= Tekanan uap larutan
∆Tf ∆Tb
= Tekanan uap pelarut
Dari diagram fase diatas pelarut (air) ditunjukkan oleh garis biasa, sedangkan untuk
larutan ditunjukkan dengan garis tebal. Apa yang dapat ananda amati dari diagram
tersebut?
Coba ananda bandingkan tekanan uap pelarut ( Titik E) dengan tekanan uap larutan
(Titik F)
Coba ananda bandingkan titik didih pelarut ( Titik C) dengan titik didih larutan (Titik
D)
Coba ananda bandingkan titik beku pelarut ( Titik B) dengan titik beku larutan (Titik
A)
Nah dari diagram diatas, maka dapat kita tarik kesimpulan tentang sifat- sifat dari sifat
koligatif
…………………………………………………………………………………
…………………………………………………………………………………
………………………………………………………………………………...
Selain dari ketiga sifat koligatif diatas ada lagi sifat koligatif yang lain yaitu Tekanan
Osmotik. Kenapa tekanan osmotik tersebut, termasuk sifat koligatif larutan?
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
………………………………………………………………………………………………….
Bahan Ajar Kimia Kelas XII Semester 1 (Andrico Pratama, S. Pd) 4
D. Sifat koligatif larutan non elektrolit dan elektrolit
Kedua larutan dibawah ini memiliki konsentrasi yang sama
Keterangan
Molekul Gula
Ion Na
Ion Cl
(a) Larutan Gula (b) Larutan Garam (NaCl)
Gambar (a) : 4 molekul gula larut dalam air membentuk 4 partikel terlarut
Gambar (b): 4 molekul garam larut dalam air membentuk 8 partikel terlarut
Coba ananda perhatikan gambar diatas!
Sifat Koligatif larutan non elektrolit adalah………………..............
……………………………………………………………………………………………………
………………………………………………………………………………………..…….….
…………………………………………………………………………………………………
Sifat Koligatif larutan Elektrolit adalah………………......................
…………………………………………………………………………………………………
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Bahan Ajar Kimia Kelas XII Semester 1 (Andrico Pratama, S. Pd) 5
Anda mungkin juga menyukai
- Modul 5 Sifat KoligatifDokumen11 halamanModul 5 Sifat KoligatifAhmad Rizalul Fikri RamadhanBelum ada peringkat
- Modul Kimia Kelas XiiDokumen117 halamanModul Kimia Kelas XiiAulia Bathari anjaniBelum ada peringkat
- Sifat Koligatif LarutanDokumen23 halamanSifat Koligatif LarutanDomino RepBelum ada peringkat
- Perangkat 1595825370Dokumen35 halamanPerangkat 1595825370NdahBelum ada peringkat
- Media PPT Sifat Koligatif Larutan)Dokumen18 halamanMedia PPT Sifat Koligatif Larutan)Nailil MunawarahBelum ada peringkat
- LKPD Sifat KoligatifDokumen23 halamanLKPD Sifat KoligatifNur Arifah Sri DiniBelum ada peringkat
- Bab 1 Koligatif PDFDokumen26 halamanBab 1 Koligatif PDFThee MerryBelum ada peringkat
- Kimia AsyikDokumen50 halamanKimia AsyikVHM01Belum ada peringkat
- KkimiaDokumen17 halamanKkimiakarina ameliaBelum ada peringkat
- Modul Kimia-Xii-Ganjil PDFDokumen100 halamanModul Kimia-Xii-Ganjil PDFRosana JesikaBelum ada peringkat
- Bahan Ajar Sifat KoligatifDokumen9 halamanBahan Ajar Sifat KoligatifvivianBelum ada peringkat
- LKS 01 Koligatif LarutanDokumen2 halamanLKS 01 Koligatif LarutanMeylianaBelum ada peringkat
- 5 Larutan PDFDokumen64 halaman5 Larutan PDFJeny Ferdiana LiemBelum ada peringkat
- Sifat Koligatif LarutanDokumen13 halamanSifat Koligatif Larutandewi anggrajeniBelum ada peringkat
- Sifat Koligatif Larutan: XT + XP 1Dokumen3 halamanSifat Koligatif Larutan: XT + XP 1priyaBelum ada peringkat
- KIMIAAAAADokumen8 halamanKIMIAAAAAFarrah AzizaBelum ada peringkat
- 5 LarutanDokumen64 halaman5 LarutanFabianadif HardiputraBelum ada peringkat
- Bab 1 Sifat-Sifat Koligatif Larutan A7Dokumen58 halamanBab 1 Sifat-Sifat Koligatif Larutan A7cyqxh6zzdmBelum ada peringkat
- Sifat Koligatif Elektrolit Dan Non ElektrolitDokumen22 halamanSifat Koligatif Elektrolit Dan Non ElektrolitMelati sukmaBelum ada peringkat
- LarutanDokumen21 halamanLarutanMaro MendoncaBelum ada peringkat
- Soal Sifat Koligatif Larutan Buku EsisDokumen33 halamanSoal Sifat Koligatif Larutan Buku Esisumauu umauuBelum ada peringkat
- Bab 1 Sifat-Sifat Koligatif LarutanDokumen30 halamanBab 1 Sifat-Sifat Koligatif Larutanmuhammar sulthanBelum ada peringkat
- Diktat KF LarutanDokumen15 halamanDiktat KF LarutanBakry AzizBelum ada peringkat
- Sifat Koligatif LarutanDokumen22 halamanSifat Koligatif LarutanUntuk ViuBelum ada peringkat
- Kelompok 2 KimdasDokumen34 halamanKelompok 2 Kimdasblue seaBelum ada peringkat
- Kimia DasarDokumen32 halamanKimia DasarMustaqim TaqimBelum ada peringkat
- Sifat Koligatif LarutanDokumen13 halamanSifat Koligatif LarutanArissBelum ada peringkat
- LarutanDokumen22 halamanLarutanDika Virga Saputra100% (1)
- LKS Kd. 1.1 - 26101007Dokumen20 halamanLKS Kd. 1.1 - 26101007Gst Md PilihBelum ada peringkat
- Sifat Koligatif LarutanDokumen25 halamanSifat Koligatif LarutanAnonymous ZwkjFokJNCBelum ada peringkat
- SIFAT - KOLIGATIF - LARUTAN OkDokumen12 halamanSIFAT - KOLIGATIF - LARUTAN OknamdaBelum ada peringkat
- Sifat-Sifat Fisis LarutanDokumen35 halamanSifat-Sifat Fisis LarutanChintia Devi PenditBelum ada peringkat
- Kimia XII GDokumen97 halamanKimia XII GDahvia Arisma Widiastini100% (1)
- Sifat Koligatif LarutanDokumen5 halamanSifat Koligatif LarutanRiskiBelum ada peringkat
- KimiaDokumen14 halamanKimiaWilmar Ghatan Al-RifqiBelum ada peringkat
- Sifat Koligatif LarutanDokumen7 halamanSifat Koligatif LarutanNensi MarianaBelum ada peringkat
- Sifat Koligatif LarutanDokumen19 halamanSifat Koligatif LarutanAfriani AfidahBelum ada peringkat
- Latihan Sifat Koligatif Penurunan Titik Beku Dan Kenaikan Titik DidihDokumen14 halamanLatihan Sifat Koligatif Penurunan Titik Beku Dan Kenaikan Titik DidihMarcellino LeopatriaBelum ada peringkat
- Panduan Kimia Sifat Koligatif Larutan 2012Dokumen13 halamanPanduan Kimia Sifat Koligatif Larutan 2012Semangat PagiBelum ada peringkat
- Sifat Koligatif Dan RedoksDokumen46 halamanSifat Koligatif Dan RedoksMuntiyatulChoiroSafitriBelum ada peringkat
- Modul Sifat Koligatif LarutanDokumen15 halamanModul Sifat Koligatif LarutanBintang AdinataBelum ada peringkat
- Tugas Mandiri Kimia-Merangkum 4Dokumen15 halamanTugas Mandiri Kimia-Merangkum 4Ayu Nurul HayyuBelum ada peringkat
- Materi Kimia Kls 12 by Michael HendrikoDokumen78 halamanMateri Kimia Kls 12 by Michael HendrikoNita RisdianitaBelum ada peringkat
- LKPD Sifat KoligatifDokumen4 halamanLKPD Sifat KoligatifMuhammad Adnan PBelum ada peringkat
- Bab 1 Sifat KoligatisDokumen34 halamanBab 1 Sifat KoligatisBintang SaputraBelum ada peringkat
- Kimia Sifat Koligatif LDokumen22 halamanKimia Sifat Koligatif LMerlin Pentury-LainsamputtyBelum ada peringkat
- 02 Bab 1Dokumen20 halaman02 Bab 1lijunkiBelum ada peringkat
- Sifatkoligatiflarutan 130107025039 Phpapp02Dokumen34 halamanSifatkoligatiflarutan 130107025039 Phpapp02horale88Belum ada peringkat
- KoligatifDokumen18 halamanKoligatifIkmalBelum ada peringkat
- TTTDokumen8 halamanTTTZaini AjaBelum ada peringkat
- Modul Sifat Koligatif LarutanDokumen20 halamanModul Sifat Koligatif LarutanDarel HazelaBelum ada peringkat
- Gugus Fungsi 2Dokumen7 halamanGugus Fungsi 2Nailil MunawarahBelum ada peringkat
- LKS OkDokumen4 halamanLKS OkNailil MunawarahBelum ada peringkat
- Pengolah KataDokumen8 halamanPengolah KataNailil MunawarahBelum ada peringkat
- FlowchartDokumen17 halamanFlowchartNailil MunawarahBelum ada peringkat