Modul 2
Diunggah oleh
Fitria Latifah0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
6 tayangan7 halamanMODUL 2
Judul Asli
MODUL 2
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniMODUL 2
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
6 tayangan7 halamanModul 2
Diunggah oleh
Fitria LatifahMODUL 2
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 7
LK 1: Lembar Kerja Belajar Mandiri Modul 2
Judul Modul Ikatan Kimia
Judul Kegiatan Belajar (KB) 1. Ikatan Ion
2. Ikatan Kovalen
3. Gaya antar Molekul
4. Pengaruh Struktur Molekul terhadap
Sifat Zat
No Butir Refleksi Respon/Jawaban
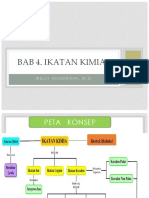
1 Daftar peta konsep KB 1. IKATAN ION
(istilah dan definisi) di 1. Ikatan kimia dapat didefenisikan sebagai gaya
modul ini yang menyebabkan sekumpulan atom yang
sama atau berbeda menjadi satu kesatuan
dengan perilaku yang sama, memiliki tingkat
energi lebih rendah dan lebih stabil
dibandingkan dengan atom-atomnya.
2. Ikatan ion terbentuk karena transfer elektron
secara penuh dari suatu atom ke atom lain
3. Ikatan kovalen terbentuk karena penggunaan
bersama beberapa pasang elektron oleh
beberapa atom. terbentuk dari atom atom yang
mempunyai afinitas elektron yang besar (non
logam).
4. Ikatan logam, terjadi antar atom-atom logam.
5. Ikatan hidrogen, interaksi antar atom hidrogen
dalam ikatan polar dengan atom yang
elektronegatif seperti O, N, F.
6. Gaya Vander Waals merupakan gaya antar
molekul (gaya dipol-dipol, gaya yang terjadi
antara molekul molekul polar
7. Gaya dipol-dipol terinduksi, gaya yang terjadi
antara suatu ion dengan suatu molekul
polardangayadispersi(terjadipadamolekulnonpol
ar),
8. Duplet adalah 1 pasang atau 2 elektron valensi
9. Oktet adalah 4 pasang atau 8 elektron valensi.
10. Energi kisi didefinisikan sebagai energi yang
dibutuhkan untuk memisahkan satu mol
senyawa ion padat menjadi ion ionnya dalam
fasa gas (Jespersen, et al., 2012; Chang, 2010).
11. Siklus Born-Haber adalah menghubungkan
energy kisi senyawa ion dengan energi ionisasi,
afinitas elektron, dan sifat-sifat atom dan
molekul lainnya.
KB 2. IKATAN KOVALEN
1. Ikatan kovalen menurut Gilbert Lewisterjadi
dengan cara membentuk pasangan elektron
hasil sumbangan dari masing-masing atom
yang berikatan.
2. Elektron Valensi adalah electron yang
digunakan untuk berikatan.
3. Struktur Lewis adalah struktur yang
digunakan untuk menggambarkan senyawa
kovalen.
4. Elektron non ikatan atau pasangan elektron
bebas (lone pairs) adalah pasangan elektron
valensi yang tidak terlibat dalam pembentukan
ikatan kovalen.
5. Pasangan elektron ikatan (bond pairs) adalah
pasangan yang digunakan bersama dalam
ikatan.
6. Bond order adalah jumlah pasangan elektron
yang dibagikan oleh pasangan elektron terikat
(Siberberg, 2010)
7. Ikatan tunggal atau orde ikatan 1 yaitu dua
atom yang berikatan melalui sepasang elektron.
8. Ikatan rangkap yaitu ikatan yang terbentuk jika
dua atom menggunakan dua atau lebih
pasangan elektron secara bersama-sama
9. Ikatan rangkap dua (orde ikatan 2) yaitu
ikatan antara dua atom yang mengunakan
bersama dua pasang elektron.
10. Ikatan rangkap tiga (orde ikatan 3) yaitu
ikatan antara dua atom yang mengunakan
bersama tiga pasang elektron.
11. Energi ikatan (entalpi ikatan atau kekuatan
ikatan) adalah energi yang dibutuhkan untuk
mengatasi tarikan ini dan didefinisikan sebagai
perubahan entalpi standar untuk memutuskan
ikatan dalam 1 mol molekul gas (Silberberg,
2010)
12. Panjang ikatan didefinisikan sebagai jarak
antar inti dari dua atom yang berikatan secara
kovalen dalam suatu molekul.
13. Elektronegativitas adalah ukuran
kemampuan atom untuk menarik elektron
dalam ikatan kimia.
14. adalah perbedaan elektronegativitas untuk
menentukan karakterikatan (ionik, kovalen
polar, kovalen nonpolar).
15. Ikatan kovalen polar yaitu kemampuan atom
untuk menarik elektron ke arahnya dalam
ikatan kimia; atom dari elektronegatifitas
berbeda.
16. Ikatan kovalen nonpolar yaitu kedua atom
memiliki elektronegatifitas yang sama.
17. Muatan formal suatu atom adalah jumlah
elektron valensi dalam atom bebas dikurangi
jumlah elektron yang dimiliki oleh atom
tersebut didalam struktur Lewis (Chang, 2010).
18. Hibrida resonansi adalah satu spesies
molekuler, bukan satu resonansi terbentuk
sesaat dan resonansi lainnya selanjutnya
(Silberberg, 2010).
19. Struktur resonansi adalah salah satu dari dua
atau lebih struktur Lewis untuk satu molekul
yang tidak dapat dinyatakan secara tepat
dengan hanya menggunakan satu struktur
Lewis saja (Chang, 2010).
20. Ikatan kovalen koordinat adalah jenis ikatan
di mana kedua elektron dari pasangan bersama
berasal dari salah satu dari dua atom.
21. Geometri molekul merupakan susunan atom
dalam bentuk tiga dimensi dalam suatu
molekul.
22. Model VSEPR/Valency Shell Electron Pair
Repulsion/Tolakan Pasangan Elektron Kulit
Valensi, didasarkan pada gagasan pasangan
elektron atau kelompok pasangan elektron di
kulit valensi masing –masing atom menolak
atom lain dan akan memposisikan diri mereka
sedemikian rupasehingga mereka terpisah
sejauh mungkin untuk meminimalkan tolakan.
(Jespersen, et al, 2012 ; Chang, 2010,
Silberberg, 2010)
23. Domain elektron adalah ruang yang ditempati
oleh sekelompok elektron di kulit valensi atom.
24. Atom Pusat adalah atom yang terikat pada
lebih dari satu atom lain.
25. Teori Ikatan Valensi / Valence Bond Theory
(VBT), teori yang memandang hanya elektron
kulit valensi yang terlibat dalam pembentukan
ikatan.
26. MOT / Molecular Orbital Theory/ Teori
Orbital Mulekul, menjelaskan tingkat energi
molekuler dan sifat terkait.
27. Ikatan Sigma () adalah hasil tumpang tindih
orbital- orbital s-s, s-p dan p-p yang segaris,
memiliki pertindihan lebih besar, sehingga
ikatannya lebih kuat.
28. Ikatan pi ( ) adalah orbital – orbital p-p yang
sejajar, ikatan lemah karena pertindihannya
kecil.
29. Orbital hibrida(hybrid orbital)yaitu orbital atom
yang diperoleh ketika dua atau lebih orbital
yang tidak setara pada atom yang sama
bergabung untuk bersiap-siap membentuk
ikatan kovalen.
30. Hibridisasi (hybridization) adalah istilah yang
digunakan untuk pencampuran orbital-orbital
atom (atom pusat) untuk menghasilkan
sekumpulan orbital hibrida.
KB 3. GAYA ANTAR MOLEKUL
1. Gaya antarmolekul (intermolecular forces)
adalah gaya tarik diantara molekul molekul.
2. Gaya Intramolekul adalah ikatan kimia yang
mengikat atom satu sama lain dalam molekul.
3. Gaya dipol-dipol merupakan gaya yang
bekerja antara molekul-mlekul polar, yaitu
antara molekul-molekul yang memiliki momen
dipol.
4. Gaya dispersi merupakan Interaksi tarik-
menarik antara ion dan dipol terinduksi
disebut interaksi ion-dipol terinduksi, dan
interaksi tarik-menarik antara molekul polar
dan dipol terinduksi disebut interaksi dipol-
dipol terinduksi.
5. Gaya ion-dipol adalah hasil interaksi
elektrostatik antara ion (bisa kation atau anion)
dan muatan parsial pada suatu molekul polar
6. Dipol terinduksi adalah dipol yang dihasilkan
dalam atom (atau molekul) (Chang, 2010).
7. Gaya dispersi London (atau hanya gaya
London atau gaya dispersi) adalah atraksi
dipol-dipol sesaat.
8. Keterpolaran (polarizability) adalah
kemudahan terganggunya distribusi elektron
dalam suatu atom atau molekul (Chang, 2010).
9. Ikatan hidrogenadalahgayatarikantarmolekul
yang terjadiantara atom hidrogen yang
terikatdengan atom sangatelektronegatif (N, O,
atau F).
KB 4. PENGARUH STRUKTUR MOLEKUL
TERHADAP SIFAT ZAT
1. Cairan mempunyai kepadatan yang tinggi dan
mengambil bentuk wadahnya karena atom atau
molekul yang menyusunnya bebas mengalir
2. Padatan memiliki bentuk yang pasti karena,
berbeda dengan cairan atau gas, molekul atau
atom yang menyusun padatan tetap pada
tempatnya
3. Kompresibilitas suatu zat adalah ukuran
kemampuannya untuk dipaksa menjadi volume
yang lebih kecil.
4. Ketegangan permukaan adalah energi yang
dibutuhkan untuk menambah luas permukaan
dengan satuan J/m2 (Silberberg, 2010).
5. Kapilaritas adalah munculnya cairan melalui
ruang sempit melawan tarikan gravitasi.
6. Kohesi merupakan tarikan antar molekul
sejenis.
7. Adhesi, adalah daya tarik antara molekul yang
berbeda.
8. Viskositas adalah hambatan cairan mengalir.
9. Kristal ionik adalah padatan yang unit
kompositnya satuan formula, senyawa
disusun berdasarkan kation dan anion netral
elektrik terkecil.
10. Kristal kovalen adalah padatan yang atomnya
disatukan dalam jaringan tiga dimensi yang
luas seluruhnya oleh ikatan kovalen.
11. Kristal molekuler adalah padatan yang unit
kompositnya adalah molekul.
12. Kristal logam adalah padatan yang paling
sederhana karena setiap titik kisi dalam
kristal ditempati oleh atom dari logam yang
sama.
13. Kapasitas panas adalah ukuran dari panas
yang diserap oleh suatu zat untuk kenaikan
suhu tertentu.
14. Padatan kristalin adalah padatan yang
terdiri dari atom, ion, atau molekul yang
memiliki susunan memanjang berurutan dalam
rentang yang panjang.
15. Padatan amorf adalah partikel yang
konstituennya tersusun secara acak dan tidak
memiliki struktur jangka panjang yang teratur.
2 Daftar materi yang sulit KB 1. Ikatan Ion
dipahami di modul ini 1. Hubungan energi elektrostatik dengan energi
kisi.
2. Pengaruh muatan ion.
3. Siklus Born Harber.
KB 2. Ikatan Kovalen
1. Kerapatan elektron pada ikatan kovalen.
2. Keelektronegatifan unsur-unsur skala penting.
3. Geometri molekul dan model VSEPR.
KB 3. Gaya Antar Molekul
1. Gaya Van Der Waals.
2. Gaya Dipol-dipol.
3. Gaya Dispersi.
KB 4. Pengaruh Struktur Molekul Terhadap
Sifat Zat
1. Padatan Amorf.
3 Daftar materi yang KB 1. Ikatan Ion
sering mengalami 1. Energi Kisi.
miskonsepsi KB 2. Ikatan Kovalen
1. Kepolaran ikatan
2. Menentukan muatan formal
3. Resonansi
KB 3. Gaya Antar Molekul
1. Interaksi Gaya Dipol-dipol pada kristal dan cair.
2. Pengaruh bentuk molekul pada Gaya dispersi.
KB 4. Pengaruh Struktur Molekul Terhadap
Sifat Zat
4. Viskositas.
Struktur
Lewis
Pembentukan
Ikatan Ion
Ikatan
Ion Energi
Siklus
Born-
Anda mungkin juga menyukai
- Makalah Ikatan KimiaDokumen7 halamanMakalah Ikatan KimiaStevanus Anggianto Buttu MasarrangBelum ada peringkat
- LK 1 - Modul 2 Profesional Irwan AprayadiDokumen5 halamanLK 1 - Modul 2 Profesional Irwan AprayadiIrwan Aprayadi SyakiraBelum ada peringkat
- LK 0.1 Modul 2 Ikatan KimiaDokumen7 halamanLK 0.1 Modul 2 Ikatan Kimiaintan pratiwiBelum ada peringkat
- LK 01-Modul 2-Nyanyak MistiaDokumen7 halamanLK 01-Modul 2-Nyanyak MistiaHasNa YushaaBelum ada peringkat
- LK 1 - Modul 2Dokumen3 halamanLK 1 - Modul 2heri padliBelum ada peringkat
- LK 0.1 Modul 2 - Profesional - UlfaNurvinaDokumen4 halamanLK 0.1 Modul 2 - Profesional - UlfaNurvinaUlfa NurvinaBelum ada peringkat
- LK 0.1 Modul 2 Kurnia - Ikatan KimiaDokumen6 halamanLK 0.1 Modul 2 Kurnia - Ikatan KimiaFenis Fitria DewiBelum ada peringkat
- LK 0 Ikatan KimiaDokumen6 halamanLK 0 Ikatan Kimiachairi yanaBelum ada peringkat
- LK 0.1 Lembar Kerja Belajar Mandiri Profesional 2Dokumen9 halamanLK 0.1 Lembar Kerja Belajar Mandiri Profesional 2Rina TyasningBelum ada peringkat
- Benaziria LK 1 Modul 2Dokumen2 halamanBenaziria LK 1 Modul 2BenaziriaBelum ada peringkat
- LK 0.1-Modul 2Dokumen4 halamanLK 0.1-Modul 2Bu GuruBelum ada peringkat
- LK 1 Modul 2 NewDokumen4 halamanLK 1 Modul 2 NewAgus SanzdingerBelum ada peringkat
- Ade MaryaUlfah LK MODUL 2Dokumen7 halamanAde MaryaUlfah LK MODUL 2ade marya ulfahBelum ada peringkat
- LK 0.1 Modul 2 ProfesionalDokumen4 halamanLK 0.1 Modul 2 ProfesionalAlfa Dina PrianotoBelum ada peringkat
- LK 1 Modul 2 Profesional-Ikatan KimiaDokumen5 halamanLK 1 Modul 2 Profesional-Ikatan KimiaRomian SiregarBelum ada peringkat
- LK 0.1 Modul 2 Kimia Eli SofiatiDokumen4 halamanLK 0.1 Modul 2 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK 01 Modul 2 ProfesionalDokumen5 halamanLK 01 Modul 2 ProfesionalMega JanjuBelum ada peringkat
- Ade Laporan Praktikum Ikatan Kimia-2 PDFDokumen20 halamanAde Laporan Praktikum Ikatan Kimia-2 PDFRaihan100% (1)
- Rangkuman Ikatan KimiaDokumen2 halamanRangkuman Ikatan KimiaMuhammad AsyrfBelum ada peringkat
- Ikatan Kimia TerlokalisasiDokumen25 halamanIkatan Kimia TerlokalisasiTwenny GamingBelum ada peringkat
- Ikatan Kovalen Berdasarkan Teori Orbital 12Dokumen12 halamanIkatan Kovalen Berdasarkan Teori Orbital 12IntanBelum ada peringkat
- BAB I Bab II IKDokumen90 halamanBAB I Bab II IKAnonymous 7QmWqQBelum ada peringkat
- Kelompok 7 - PPT PBL-2Dokumen17 halamanKelompok 7 - PPT PBL-2Elenn DanestraBelum ada peringkat
- IKATAN KIMIA Nur Camalia Hasibuan.-CompressedDokumen13 halamanIKATAN KIMIA Nur Camalia Hasibuan.-CompressedNur CamaliaBelum ada peringkat
- Resume Ikatan KimiaDokumen10 halamanResume Ikatan KimiaAmeeBelum ada peringkat
- Laporan Ikatan Kimia Nur Aqil FachriDokumen15 halamanLaporan Ikatan Kimia Nur Aqil FachrifnuraqilfachriBelum ada peringkat
- LK1-Modul 2 ProfesionalDokumen6 halamanLK1-Modul 2 ProfesionalHasNa YushaaBelum ada peringkat
- Ikatan Kimia-Kelompok 3Dokumen12 halamanIkatan Kimia-Kelompok 3nidaul hasanahBelum ada peringkat
- Minggu 3 Kimiawi Kehidupan 2023-2024Dokumen32 halamanMinggu 3 Kimiawi Kehidupan 2023-2024bej zchBelum ada peringkat
- Kelompok 7 - PPT PBL-2Dokumen17 halamanKelompok 7 - PPT PBL-2Elenn DanestraBelum ada peringkat
- Atom Dan Ikatan AtomDokumen3 halamanAtom Dan Ikatan AtomJihan SahdaBelum ada peringkat
- LK 0.1 Modul 2Dokumen13 halamanLK 0.1 Modul 2ibenk pelipurlaraBelum ada peringkat
- Bentuk MolekulDokumen14 halamanBentuk MolekulAditya Rizky F.Belum ada peringkat
- E-Modul Ikatan Ion (JAKSON SUMITRO SIMAMORA) FIXDokumen24 halamanE-Modul Ikatan Ion (JAKSON SUMITRO SIMAMORA) FIXNellyBelum ada peringkat
- Tugas Akhir Artikel Fisika Material - Delsy Desmarlin Raja LadoDokumen7 halamanTugas Akhir Artikel Fisika Material - Delsy Desmarlin Raja LadoDelsy Desmarlin Raja Lado delsydesmarlin.2020Belum ada peringkat
- Albroston SetiawanDokumen19 halamanAlbroston SetiawanLeoni SiraitBelum ada peringkat
- LK 01 Modul 2Dokumen15 halamanLK 01 Modul 2Syarif SuhermanBelum ada peringkat
- Kel 5 Makalah Ikatan KimiaDokumen13 halamanKel 5 Makalah Ikatan KimiaWulan MollyBelum ada peringkat
- Sumber VBT MotDokumen3 halamanSumber VBT MotFiraSyafira100% (1)
- BAHANDokumen25 halamanBAHANsilviaawdBelum ada peringkat
- Ikatan Kimia FixxDokumen26 halamanIkatan Kimia FixxIncut MincutBelum ada peringkat
- Rangkuman Fisdas Pertemuan 2Dokumen8 halamanRangkuman Fisdas Pertemuan 2Alfiya RahmaBelum ada peringkat
- Kel.2 - Ikatan Kovalen Dan Non KovalenDokumen19 halamanKel.2 - Ikatan Kovalen Dan Non Kovalenkiya zalovhaBelum ada peringkat
- Makalah Ikatan KimiaDokumen28 halamanMakalah Ikatan KimiaKhusnul Khotimah Hino 'cralisher75% (4)
- Resume - Ikatan Kimia - Siti AmirohDokumen10 halamanResume - Ikatan Kimia - Siti AmirohAmeeBelum ada peringkat
- Tugas Terstruktur P.2 BDokumen3 halamanTugas Terstruktur P.2 BNindia PuteriBelum ada peringkat
- Kelompok 3 - PPT Ikatan Kimia Dan IsomerDokumen22 halamanKelompok 3 - PPT Ikatan Kimia Dan IsomerarrieepBelum ada peringkat
- LK Belajar Mandiri - Modul 2 Profesional - IKE PDFDokumen5 halamanLK Belajar Mandiri - Modul 2 Profesional - IKE PDFIKE YUSRIANTIBelum ada peringkat
- Tugas Kimia Organik 1Dokumen22 halamanTugas Kimia Organik 1akbarBelum ada peringkat
- Ikatan KimiaDokumen11 halamanIkatan KimiaRexsa AlBelum ada peringkat
- Kimia AnfisDokumen77 halamanKimia AnfisFebrinto KarlosBelum ada peringkat
- Materi 2 Ikatan KimiaDokumen3 halamanMateri 2 Ikatan KimiaWindah WulandariBelum ada peringkat
- Struktur Molekul KimiaDokumen10 halamanStruktur Molekul KimiaTri HasaniaBelum ada peringkat
- Bab 6 Ikatan KimiaDokumen30 halamanBab 6 Ikatan Kimiaalfi nur azizahBelum ada peringkat
- LP Ikatan 2Dokumen39 halamanLP Ikatan 2Mujtahidah ShabirBelum ada peringkat
- Teori Ikatan Valensi Dan Teori Orbital MolekulDokumen4 halamanTeori Ikatan Valensi Dan Teori Orbital MolekulTildisBelum ada peringkat
- Ikatan Kimia-1Dokumen23 halamanIkatan Kimia-1Galib WahabBelum ada peringkat
- Fitrianingsih-60500120008-Ikatan Kimia PDFDokumen22 halamanFitrianingsih-60500120008-Ikatan Kimia PDFRaihanBelum ada peringkat
- Gaya IkatDokumen9 halamanGaya IkatRendi SetiawanBelum ada peringkat
- Penilaian1 AmrahDokumen7 halamanPenilaian1 AmrahFitria LatifahBelum ada peringkat
- LKPD3penurunan Titik Beku-AmrahDokumen4 halamanLKPD3penurunan Titik Beku-AmrahFitria LatifahBelum ada peringkat
- RPP1KonsentrasiSKL Amrah DikonversiDokumen8 halamanRPP1KonsentrasiSKL Amrah DikonversiFitria LatifahBelum ada peringkat
- Lkpd1 Konsentrasi AmrahDokumen5 halamanLkpd1 Konsentrasi AmrahFitria LatifahBelum ada peringkat
- Rpp3 SKL AmrahDokumen9 halamanRpp3 SKL AmrahFitria LatifahBelum ada peringkat
- LKPD2kenaikan Titik Didih-AmrahDokumen7 halamanLKPD2kenaikan Titik Didih-AmrahFitria LatifahBelum ada peringkat
- LK 1: Lembar Kerja Belajar Mandiri Modul 1: No Butir Refleksi Respon/ Jawaban KB 1: Perkembangan Teori AtomDokumen6 halamanLK 1: Lembar Kerja Belajar Mandiri Modul 1: No Butir Refleksi Respon/ Jawaban KB 1: Perkembangan Teori AtomFitria LatifahBelum ada peringkat
- RPP2SifatKoligatifLarutan AmrahDokumen7 halamanRPP2SifatKoligatifLarutan AmrahFitria LatifahBelum ada peringkat
- Rencana Pelaksanaan Pembelajaran (RPP) A. IdentitasDokumen16 halamanRencana Pelaksanaan Pembelajaran (RPP) A. IdentitasFitria LatifahBelum ada peringkat
- LK 1.1 - Modul 3 - Amrah MutiahDokumen6 halamanLK 1.1 - Modul 3 - Amrah MutiahFitria LatifahBelum ada peringkat
- A. Kompetensi Inti (KI)Dokumen28 halamanA. Kompetensi Inti (KI)Fitria LatifahBelum ada peringkat
- LKPD Struktur Atom Yg BaikDokumen88 halamanLKPD Struktur Atom Yg BaikFitria LatifahBelum ada peringkat
- Modul 5 Larutan Dan Sistem KoloidDokumen26 halamanModul 5 Larutan Dan Sistem KoloidFitria LatifahBelum ada peringkat
- RPP 3.1 FixDokumen10 halamanRPP 3.1 FixFitria LatifahBelum ada peringkat
- 5 6257859258277167233Dokumen8 halaman5 6257859258277167233Fitria LatifahBelum ada peringkat
- LKPD PJBL PemcampDokumen6 halamanLKPD PJBL PemcampFitria LatifahBelum ada peringkat
- LK. 2.1 Eksplorasi Alternatif SolusiDokumen5 halamanLK. 2.1 Eksplorasi Alternatif SolusiFitria LatifahBelum ada peringkat
- RPP Pemisahan CampuranDokumen13 halamanRPP Pemisahan CampuranFitria LatifahBelum ada peringkat