Uts Kimia
Diunggah oleh
tim5 trenggalek0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
6 tayangan2 halamanJudul Asli
UTS KIMIA
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
6 tayangan2 halamanUts Kimia
Diunggah oleh
tim5 trenggalekHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
Yusuf Reza Abimanyu
NIM : 202205010579
UTS KIMIA
1. Soal-soal Rumus Empiris
Anggap massa molekul = 100 gr, sehingga massa C = 70,58 gr , massa H = 5,93 gr ,
massa O = 23,49 gr
mol C = massa C/massa molar C mol H = massa H/massa molar
H
mol C = 70,58 gr/(12 gr/mol) mol H = 5,93 gr/(1 gr/mol)
mol C = 5,8817 mol mol H = 5,93 mol
mol O = massa O/massa molar O
mol O = 23,49/(16 gr/mol)
mol O = 1,4681 mol
Perbandingan jumlah mol juga menyatakan perbandingan jumlah atom, maka
perbandingan jumlah mol dapat digunakan untuk menentukan rumus empiris.
mol C : mol H : mol O = atom C : atom H : atom O = 5,8817 : 5,93 : 1,4681
Karena perbandingan harus berupa bilangan bulat sederhana, maka bagi tiga
bilangan tersebut dengan bilangan terkecil, yaitu 1,4681. Sehingga
perbandingannya menjadi:
4,0063 : 4,0392 : 1.
Perbedaan angka di belakang koma pada desimal kedua dapat diabaikan, sehingga
menjadi 4 : 4 : 1. Sehingga rumus Empirisnya adalah C₄H₄O.
Rumus molekul dapat diketahui dengan mengalikan masing-masing jumlah atom
pada tiap unsur pada rumus empiris dengan hasil bagi antara Mr molekul dengan
Mr rumus empirisnya.
Mr C₄H₄O = 12 x 4 + 4 + 16 = 68.
Mr molekul = 136
Maka:
Mr molekul/Mr C₄H₄O = 136/68 = 2
Perbedaan angka di belakang koma pada desimal kedua dapat diabaikan, sehingga
hasilnya adalah 2.
Sehingga didapat rumus molekulnya adalah C₈H₈O₂
Jadi, rumus empiris molekul metil benzoat adalah C₄H₄O dan rumus molekulnya
adalah C₈H₈O₂
2. Soal Konsentrasi Larutan
a.)massa Zn(NO₃)₂ = 12,8 gram
Ralat : p = 1,107 gr/mL jika volume = 1 Liter = 1000 mL maka,
massa Zn(NO₃)₂ = 1,107 x 1000
massa Zn(NO₃)₂ = 1107 gram
% massa Zn(NO₃)₂ = x 100%
% massa Zn(NO₃)₂ = 0,01156 x 100%
% massa Zn(NO₃)₂ = 1,156 %
b.) Mr Zn(NO₃)₂ = 189
n Zn(NO₃)₂ = massa/Mr
n Zn(NO₃)₂ = 12.8/189
n Zn(NO₃)₂ = 0,06772486772486772486772486772487
n Zn(NO₃)₂ = 0,0677 mol
M Zn(NO₃)₂ = n/v
M Zn(NO₃)₂ = 0,677/1
M Zn(NO₃)₂ = 0,0677 M
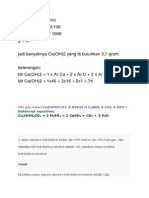
3. Soal Koligatif Larutan
Anda mungkin juga menyukai
- Stoikiometri Dan Reaksi KimiaDokumen49 halamanStoikiometri Dan Reaksi KimiaTor ToteBelum ada peringkat
- Kimia Dasar 20160922 - Stoikiometri PDFDokumen27 halamanKimia Dasar 20160922 - Stoikiometri PDFAli Baba AsrilBelum ada peringkat
- Rumus Empiris Dan Rumus MolekulDokumen5 halamanRumus Empiris Dan Rumus MolekulIka YudiswastikaBelum ada peringkat
- Rumus EmpirisDokumen45 halamanRumus EmpirisAde Ilham Khaled100% (1)
- Menentukan Rumus Empiris ZatDokumen7 halamanMenentukan Rumus Empiris ZatHIMAMIA FKIP UNIBBelum ada peringkat
- Rumus Empiris Dan Rumus MolekulDokumen5 halamanRumus Empiris Dan Rumus MolekulRiana GermanottaBelum ada peringkat
- Contoh Soal Dan Pembahasan Konsep Mol Dan Stoikiometri SenyawaDokumen16 halamanContoh Soal Dan Pembahasan Konsep Mol Dan Stoikiometri SenyawaAldy NugrahaBelum ada peringkat
- Rumus Molekul Dan Rumus EmpirisDokumen10 halamanRumus Molekul Dan Rumus EmpirisJoni BiwarnoBelum ada peringkat
- STOIKIOMETRI Part2Dokumen5 halamanSTOIKIOMETRI Part2IRHAM MUHAMMAD ZAKYBelum ada peringkat
- StoikiometriDokumen39 halamanStoikiometriAfriani AfidahBelum ada peringkat
- Stokiometri TLMDokumen54 halamanStokiometri TLMPurnama EkasariBelum ada peringkat
- Bab 3. StoikiometriDokumen61 halamanBab 3. StoikiometriHendra Saputra100% (1)
- Pengertian Kimia Tugas HabibDokumen7 halamanPengertian Kimia Tugas Habibmuhammad habibBelum ada peringkat
- StoikiometriDokumen32 halamanStoikiometriFajar Rivani100% (1)
- Kimia Bab 2Dokumen17 halamanKimia Bab 2Putri Chairany ITIBelum ada peringkat
- Modul 2 (Kimia Dasar 1) Pengenalan Kimia Dasar 1 Bagian 2Dokumen15 halamanModul 2 (Kimia Dasar 1) Pengenalan Kimia Dasar 1 Bagian 2Ichvan PranataBelum ada peringkat
- Hubungan-Massa-dengan-Reaksi-Kimia-bagian-2Dokumen14 halamanHubungan-Massa-dengan-Reaksi-Kimia-bagian-2Fathya Rizka SalsabillaBelum ada peringkat
- KimdasDokumen11 halamanKimdasRezky Kusi SintaBelum ada peringkat
- Bab3 Senyawa KimiaDokumen22 halamanBab3 Senyawa KimiaTri AgustinaBelum ada peringkat
- Maateri Dan Soal Rumus Molekul Dan Rumus EmpirisDokumen3 halamanMaateri Dan Soal Rumus Molekul Dan Rumus EmpirisNastiti PutriBelum ada peringkat
- Stoikiometri 2 PDFDokumen42 halamanStoikiometri 2 PDFGunawan KristiyantoBelum ada peringkat
- STOIKIOMETRI EditDokumen29 halamanSTOIKIOMETRI EditKevin KomedienBelum ada peringkat
- Konsep Mol Dan Perhitungan Soal KimiaDokumen10 halamanKonsep Mol Dan Perhitungan Soal KimiaIhenArchBelum ada peringkat
- StoikiometriDokumen18 halamanStoikiometriab6ix HwiBelum ada peringkat
- Modul 2 Kimia PDFDokumen15 halamanModul 2 Kimia PDFAfif NurhalimBelum ada peringkat
- Materi Kimdas PresentasiDokumen9 halamanMateri Kimdas PresentasiRika AgustinBelum ada peringkat
- Latihan Soal Stoikiometri1Dokumen22 halamanLatihan Soal Stoikiometri1Desita AndarestiBelum ada peringkat
- Stoikiometri 2Dokumen25 halamanStoikiometri 2DARSO SEPTIANBelum ada peringkat
- STOIKIOMETRIDokumen37 halamanSTOIKIOMETRIZulkifli MakuBelum ada peringkat
- Pembahasan Soal To Kimia 23Dokumen6 halamanPembahasan Soal To Kimia 23Qiowo PertamaBelum ada peringkat
- Stoikiometri 1Dokumen18 halamanStoikiometri 1SuhartinBelum ada peringkat
- Rumus Kimia Dan Komposisi Stoikiometri UcokDokumen20 halamanRumus Kimia Dan Komposisi Stoikiometri UcokEdDie EndraBelum ada peringkat
- STOIKIOMETRIDokumen24 halamanSTOIKIOMETRIRahmadania Putri MahildaBelum ada peringkat
- Konsep Mol by Tri GPS M.PDDokumen4 halamanKonsep Mol by Tri GPS M.PDTRI GOESEMA PUTRA M.PdBelum ada peringkat
- Rumus Empiris Dan Rumus MolekulDokumen22 halamanRumus Empiris Dan Rumus MolekulYeSi YStri Hdyti CatMafisBelum ada peringkat
- Rumus EmpirisDokumen20 halamanRumus EmpirisribasdBelum ada peringkat
- Konsep MOL, Rumus Empiris, Rumus Molekul - Pengertian Dan Contoh SoalDokumen17 halamanKonsep MOL, Rumus Empiris, Rumus Molekul - Pengertian Dan Contoh SoalRiandi Kartiko0% (1)
- Rumus Empiris Molekul - ModulDokumen2 halamanRumus Empiris Molekul - ModulSuyanta SuyantaBelum ada peringkat
- Konsep MolDokumen15 halamanKonsep MolYulira PratiwiBelum ada peringkat
- Konsep Mol Dan PerhitunganDokumen13 halamanKonsep Mol Dan PerhitunganSyarafina DirindaBelum ada peringkat
- LKPD Stoikiometri BaruDokumen9 halamanLKPD Stoikiometri BaruHARTATYBelum ada peringkat
- Dokumen (4) .Docx 543Dokumen5 halamanDokumen (4) .Docx 543Andira SapitriBelum ada peringkat
- Atom, Molekul Dan Rumus KimiaDokumen22 halamanAtom, Molekul Dan Rumus KimiasilvyfebryBelum ada peringkat
- STOIKIOMETRI1Dokumen20 halamanSTOIKIOMETRI1Siska SariBelum ada peringkat
- S Tokio MetriDokumen13 halamanS Tokio MetriKeke Rieske FannyBelum ada peringkat
- Percobaan 3Dokumen19 halamanPercobaan 3RadenNajmiBelum ada peringkat
- Bab 8. Rumus Empiris OlDokumen3 halamanBab 8. Rumus Empiris OlLina AndrianiBelum ada peringkat
- STOIKIOMETRI1Dokumen19 halamanSTOIKIOMETRI1ital tato0% (1)
- Rumus Empiris Dan Molekul PDFDokumen10 halamanRumus Empiris Dan Molekul PDFNovia Anatasya0% (1)
- Soal StoikiometriDokumen68 halamanSoal StoikiometriSahril SangajiBelum ada peringkat
- Kimdas 5Dokumen2 halamanKimdas 5muthiaBelum ada peringkat
- Rumus MolekulDokumen9 halamanRumus MolekulasmaBelum ada peringkat
- Bab II STOIKIOMETRIDokumen19 halamanBab II STOIKIOMETRIfahril abdjanBelum ada peringkat
- 3584 2.stoikiometriDokumen31 halaman3584 2.stoikiometriDewi Ashri OktavianiBelum ada peringkat
- Rumus Empiris Dan Rumus MolekulDokumen7 halamanRumus Empiris Dan Rumus MolekulHacker TransparanBelum ada peringkat
- Stoikiometri 1Dokumen37 halamanStoikiometri 1Muhammad Katon Al BuchoryBelum ada peringkat
- Rangkuman Materi StoikiometriDokumen5 halamanRangkuman Materi Stoikiometrianon_144274515Belum ada peringkat
- Modul 2 StoikiometriDokumen37 halamanModul 2 StoikiometriBakry AzizBelum ada peringkat
- LKS Rumus Empiris Dan Rumus MolekulDokumen9 halamanLKS Rumus Empiris Dan Rumus MolekulYusafat50% (2)