Tugas Kelompok Kimia 2 Terakhir
Diunggah oleh
Laky Satria0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
7 tayangan8 halamanPresentasi membahas sifat-sifat kimia unsur seperti jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan serta perbedaan sifat logam dan non logam. Sifat-sifat ini memiliki pola berulang sesuai nomor atom dan periode sistem periodik.
Deskripsi Asli:
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniPresentasi membahas sifat-sifat kimia unsur seperti jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan serta perbedaan sifat logam dan non logam. Sifat-sifat ini memiliki pola berulang sesuai nomor atom dan periode sistem periodik.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
7 tayangan8 halamanTugas Kelompok Kimia 2 Terakhir
Diunggah oleh
Laky SatriaPresentasi membahas sifat-sifat kimia unsur seperti jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan serta perbedaan sifat logam dan non logam. Sifat-sifat ini memiliki pola berulang sesuai nomor atom dan periode sistem periodik.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 8
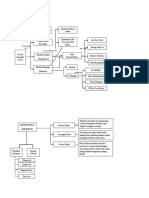
Presentasi Kimia
Materi : Anggota
- Sifat keperiodikan unsur - Laky
- Jari-jari atom - Marsya
- Afinitas electron - Sylvia
- Energi ionisasi - Nelsa
- Keelektronegatifan
- Sifat logam & non logam
SIFAT KEPERIODIKAN UNSUR
Sifat periodik unsur adalah sifat-sifat yang
mempunyai kecenderungan untuk berubah secara
teratur sesuai dengan kenaikan nomor atom, yaitu dari
kiri ke kanan dalam satu periode dan dari atas ke
bawah dalam satu golongan.
Sifat apa saja yang termasuk sifat keperiodikan unsur?
Sifat-sifat keperiodikan unsur antara lain jari-jari atom,
energi ionisasi, afinitas elektron, dan keelektronegatifan
Jari-jari atom
Jari-jari atom adalah jarak dari inti atom ke orbital elektron
terluar yang stabil dalam suatu atom dalam keadaan setimbang.
Jari-jari atom adalah jarak dari inti atom ke kulit terluar
dari atom. Jari-jari atom memiliki hubungan dengan sistem
periodik. Semakin bertambah periode (atau kulit atom),
maka jari-jari atom akan semakin membesar karena kulit yang
dimiliki atom semakin banyak.
Jenis-jenis jari-jari atom
Jari-jari kovalen.
Jari-jari logam.
Jari-jari van der Waals.
AFINITAS
ELEKTRON
Afinitas Elektron yaitu negatif dari perubahan energi yang
terjadi ketika satu elektron diterima oleh atom suatu unsur
dalam keadaan gas.
Afinitas elektron adalah kemampuan unsur untuk menerima
elektron
Bagaimana urutan afinitas elektron?
Semakin ke kanan semakin besar nilai afinitas elektronnya
maka urutan unsur adalah: K - Ca - Mg - Al. Unsur disebalah
kiri memiliki afinitas elektron terbesar yaitu K dan Al
memiliki afinitas elektron terbesar
ENERGI IONISASI
Bagaimana sifat energi ionisasi?
Energi ionisasi adalah energi yang diperlukan untuk
melepaskan elektron terluar suatu atom dalam keadaan gas.
Jika energi ionisasi kecil maka atom mudah melepaskan
elektron. Sebaliknya jika energi ionisasi besar maka atom
sukar melepaskan elektron.
Energi ionisasi (IE) adalah energi yang diperlukan untuk
mengeluarkan elektron dari tiap mol spesies dalam
keadaan gas.
KEELEKTONEGATIFAN
Elektronegativitas atau keelektronegatifan adalah
sebuah sifat kimia menjelaskan kemampuan sebuah
atom untuk menarik elektron menuju dirinya sendiri
pada ikatan kovalen. Konsep elektronegativitas
pertama kali oleh Linus Pauling pada tahun 1932
sebagai bagian dari perkembangan teori ikatan valensi
SIFAT LOGAM DAN NON LOGAM
Sifat logam berhubungan dengan kemampuan suatu
atom melepas elektron atau menjadi bermuatan
positip (membentuk kation). Sedangkan sifat non
logam berhubungan dengan kecenderungan suatu
atom untuk menerima elektron atau menjadi
bermuatan negatif (membentuk anion). semakin
berkurang dan sifat non logam semakin bertambah.
Anda mungkin juga menyukai
- Elektro Af: Kelompok 4Dokumen10 halamanElektro Af: Kelompok 4Rii HyBelum ada peringkat
- Kelimpahan Unsur Di Alam Dan Sifat-Sifat Periodik UnsurDokumen17 halamanKelimpahan Unsur Di Alam Dan Sifat-Sifat Periodik UnsurDewi ShakilaBelum ada peringkat
- Sifat Unsur PeriodikDokumen15 halamanSifat Unsur PeriodikAde TriBelum ada peringkat
- Sifat Unsur KimiaDokumen4 halamanSifat Unsur Kimiadimas alifBelum ada peringkat
- Bab II Sifat-Sifat UnsurDokumen22 halamanBab II Sifat-Sifat UnsurLm PradinotoBelum ada peringkat
- SifatDokumen3 halamanSifatFemmy Yanti ABelum ada peringkat
- Periodisitas Sifat UnsurDokumen7 halamanPeriodisitas Sifat Unsurferrer_madridis7629Belum ada peringkat
- Sifat Periodik UnsurDokumen20 halamanSifat Periodik UnsurSisyeNoyaBelum ada peringkat
- Sifat Periodik2Dokumen26 halamanSifat Periodik2hanzallaodeBelum ada peringkat
- Makalah Unsur PeriodikDokumen9 halamanMakalah Unsur Periodikyogi iyaiyalahBelum ada peringkat
- Sifat Sistem Periodik Unsur KimiaDokumen3 halamanSifat Sistem Periodik Unsur KimiaEka AnjaruriBelum ada peringkat
- Tugas Kimia KLMPK 3 X Mipa 2Dokumen7 halamanTugas Kimia KLMPK 3 X Mipa 2Imeng OktaBelum ada peringkat
- Tgs Kimia Anorganik NOVA LESTARIDokumen15 halamanTgs Kimia Anorganik NOVA LESTARINovaa Farmasi13Belum ada peringkat
- Sifat Sifat AtomDokumen5 halamanSifat Sifat Atomabubakar100% (1)
- Komputasi Kimia (Ikatan Kimia)Dokumen14 halamanKomputasi Kimia (Ikatan Kimia)Erlia NovriyantiBelum ada peringkat
- Makalah Ikatan IonDokumen13 halamanMakalah Ikatan IonWarnet Vast RahaBelum ada peringkat
- Tugas KimiaDokumen18 halamanTugas Kimia「RL」 RoseBelum ada peringkat
- Materi Kimia Sifat Sifat Periodik UnsurDokumen1 halamanMateri Kimia Sifat Sifat Periodik UnsurArchangel SodyBelum ada peringkat
- Makalah Kimia 6Dokumen9 halamanMakalah Kimia 6M Refi Dwi AnantaBelum ada peringkat
- Modul Materi LCCDokumen39 halamanModul Materi LCCalmasriwulandariBelum ada peringkat
- KLP 4 Sistem Periodik UnsurDokumen12 halamanKLP 4 Sistem Periodik UnsurSt. AnisaBelum ada peringkat
- PJJ 7 Sifat-Sifat Periodik UnsurDokumen3 halamanPJJ 7 Sifat-Sifat Periodik UnsurPatri MallisaBelum ada peringkat
- PJJ 7 Sifat-Sifat Periodik UnsurDokumen3 halamanPJJ 7 Sifat-Sifat Periodik UnsurPatri MallisaBelum ada peringkat
- Sifat Periodik UnsurDokumen4 halamanSifat Periodik UnsurYuanita KartikaBelum ada peringkat
- Sifat Periodik UnsurDokumen5 halamanSifat Periodik UnsurIsmi Mu'affifahBelum ada peringkat
- Ikatan Kimia-1Dokumen23 halamanIkatan Kimia-1Galib WahabBelum ada peringkat
- Sifat PeriodikDokumen4 halamanSifat PeriodikNurul Ayu MuliawatiBelum ada peringkat
- Sifat Periodik SDRHNDokumen12 halamanSifat Periodik SDRHNHanindi FajrinaBelum ada peringkat
- Sifat Sifat AtomDokumen19 halamanSifat Sifat AtomLenia W SugiyantoBelum ada peringkat
- Unsur Dan PeriodisitasDokumen42 halamanUnsur Dan Periodisitas21.02ANDI AULIA HUSENGBelum ada peringkat
- KimiaDokumen6 halamanKimiaMuhammad RasyaBelum ada peringkat
- Keperiodikan UnsurDokumen58 halamanKeperiodikan UnsurNur FadiaBelum ada peringkat
- Sifat Keperiodikan UnsurDokumen9 halamanSifat Keperiodikan UnsurRhine ArdiBelum ada peringkat
- Sifat Sifat Unsur PeriodikDokumen5 halamanSifat Sifat Unsur Periodikhrfmartin 45Belum ada peringkat
- Sifat-Sifat PeriodikDokumen11 halamanSifat-Sifat PeriodikPuskesmas RayaBelum ada peringkat
- Media - Presentasi SPUDokumen12 halamanMedia - Presentasi SPUWahyu UswaBelum ada peringkat
- Kimia S, 2 No 3Dokumen1 halamanKimia S, 2 No 3SAHABelum ada peringkat
- Sifat Periodik UnsurDokumen2 halamanSifat Periodik UnsurcherisjavanaBelum ada peringkat
- Energi Ionisasi Dan ElektronegatifitasDokumen4 halamanEnergi Ionisasi Dan ElektronegatifitasSepti GyanaBelum ada peringkat
- Diskusi 2 Kimia Dasar - Ina Saila 043010933Dokumen17 halamanDiskusi 2 Kimia Dasar - Ina Saila 043010933DadanBelum ada peringkat
- Sifat Periodik UnsurDokumen16 halamanSifat Periodik UnsurFriska HilmaBelum ada peringkat
- Struktur AtomDokumen50 halamanStruktur AtomPutri S. DadungBelum ada peringkat
- Jari Jari AtomDokumen3 halamanJari Jari AtomUzumaki ecyBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen49 halamanStruktur Atom Dan Sistem Periodik UnsurFianita SalmaBelum ada peringkat
- Sifat-Sifat Sistem Periodik UnsurDokumen45 halamanSifat-Sifat Sistem Periodik UnsuresmarmangalikBelum ada peringkat
- Baju PorseniDokumen8 halamanBaju Porsenifadil.atj011008Belum ada peringkat
- Ikatan KimiaDokumen31 halamanIkatan KimiaSiti Ayla AzzuraBelum ada peringkat
- Bahan Ajar Sifat Periodik UnsurDokumen8 halamanBahan Ajar Sifat Periodik UnsurFadilla Qinthara ZahraniBelum ada peringkat
- UnsurDokumen2 halamanUnsurSantiago FernandoBelum ada peringkat
- Sifat-Sifat Periodik UnsurDokumen11 halamanSifat-Sifat Periodik UnsurAnggun Teh PamegetBelum ada peringkat
- Kimia Unsur - Sifat-Sifat Periodik UnsurDokumen20 halamanKimia Unsur - Sifat-Sifat Periodik UnsurRipan MalanuaBelum ada peringkat
- 3 - Senyawa Ionik Dan MolekulerDokumen19 halaman3 - Senyawa Ionik Dan MolekulerLaurentius Steven NyotoBelum ada peringkat
- Sifat Periodik UnsurDokumen5 halamanSifat Periodik UnsurAnHiSweettLibradarrIBelum ada peringkat
- Ikatan Kimia Ii Kel 8Dokumen8 halamanIkatan Kimia Ii Kel 8Vina AmeliaBelum ada peringkat
- Sifat Periodik UnsurDokumen9 halamanSifat Periodik UnsurGusdwi DwipaBelum ada peringkat
- Afinitas ElektronDokumen3 halamanAfinitas ElektronLoya Angelita100% (1)
- Kemiripan Dan Sifat Keperiodikan Unsur Dalam Satu GolonganDokumen3 halamanKemiripan Dan Sifat Keperiodikan Unsur Dalam Satu GolonganIsmi Mu'affifahBelum ada peringkat
- Lampiran 3.4 (Sifat Keperiodikan Unsur)Dokumen2 halamanLampiran 3.4 (Sifat Keperiodikan Unsur)msy wulandariBelum ada peringkat
- LPG Dan LNGDokumen3 halamanLPG Dan LNGLaky SatriaBelum ada peringkat
- Lembaga Sosial 1Dokumen3 halamanLembaga Sosial 1Laky SatriaBelum ada peringkat
- Sejarah 2Dokumen12 halamanSejarah 2Laky SatriaBelum ada peringkat
- Sejarah 1Dokumen15 halamanSejarah 1Laky SatriaBelum ada peringkat
- Rundown AcaraDokumen2 halamanRundown AcaraLaky SatriaBelum ada peringkat
- Science Project Title 2Dokumen12 halamanScience Project Title 2Laky SatriaBelum ada peringkat
- Science Project Title 3Dokumen18 halamanScience Project Title 3Laky SatriaBelum ada peringkat
- Rundown Acara (Final)Dokumen8 halamanRundown Acara (Final)Laky SatriaBelum ada peringkat
- Pemahaman Event Organizer Dan Wedding OrganizerDokumen1 halamanPemahaman Event Organizer Dan Wedding OrganizerLaky SatriaBelum ada peringkat