Kimia S, 2 No 3
Diunggah oleh
SAHAJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kimia S, 2 No 3
Diunggah oleh
SAHAHak Cipta:
Format Tersedia
3. a.
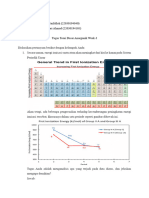
Jari jari atom Jari-jari atom merupakan jarak elaktron terluar ke inti atom dan
menunjukan ukuran suatu atom. Jari-jari atom sukar diukur sehingga
pengukuran jari-jari atom dilakukan dengan cara mengukur jarak inti
antar dua atom yang berikatan sesamanya.
b. Potensial ionisasi/ Jika dalam suatu atom terdapat satu elektron di luar subkulit yang
Energi ionisasi mantab, elektron ini cenderung mudah lepas supaya mempunyai
konfigurasi seperti gas mulia. Namun, untuk melepaskan elektron dari
suatu atom dperlukan energi. Energi yang diperlukan untuk
melepaskan elektron dari suatu atom di namakan energi
ionisasi. Dalam suatu periode semakin banyak elektron dan
proton gaya tarik menarik elektron terluar dengan inti semakin besar
(jari-jari kecil) Akibatnya, elektron sukar lepas sehingga energi untuk
melepas elektron semakin besar. Hal ini berarti energi ionisasi besar.
c. Keelektronegativitas Kelektronegatifan adalah kemampuan suatu atom untuk menarik
elektron dari atom lain. Faktor yang mempengaruhi keelektronegatifan
adalahgaya tarik dari inti terhadap elektron dan jari-jari atom.
Semakin besar energi ionisasi dan afinitas elektron pada tabel periodik
berbanding lurus dengan semakin besarnya keelektronegatifan unsur
d. Afinitas elektron Afinitas elektron ialah energi yang dibebaskan atau yang diserap
apabila suatu atom menerima elektron.
Jika ion negatif yeng terbentuk bersifat stabil, maka proses
penyerapan elektron itu disertai pelepasan energi dan afinitas
elektronnya dinyatakan dengan tanda negative. Akan tetapi jika
ion negative yang terbentuk tidak stabil, maka proses penyerapan
elektron akan membutuhkan energi dan afinitas elektronnya
dinyatakan dengan tanda positif. Jadi, unsur yang mempunyai
afinitas elektron bertanda negatif mempunyai kecenderungan
lebih besar menyerap elektron daripada unsur yang afinitas
elektronnya bertanda positif. Makin negative nilai afinitas
elektron berarti makin besar kecenderungan menyerap elktron.
Anda mungkin juga menyukai
- Tugas Kimia KLMPK 3 X Mipa 2Dokumen7 halamanTugas Kimia KLMPK 3 X Mipa 2Imeng OktaBelum ada peringkat
- Sifat Sifat Unsur PeriodikDokumen5 halamanSifat Sifat Unsur Periodikhrfmartin 45Belum ada peringkat
- Sifat-Sifat Periodik UnsurDokumen11 halamanSifat-Sifat Periodik UnsurAnggun Teh PamegetBelum ada peringkat
- Elektro Af: Kelompok 4Dokumen10 halamanElektro Af: Kelompok 4Rii HyBelum ada peringkat
- Energi Ionisasi FixDokumen4 halamanEnergi Ionisasi FixGufronBelum ada peringkat
- Sifat Unsur PeriodikDokumen15 halamanSifat Unsur PeriodikAde TriBelum ada peringkat
- Sifat PeriodikDokumen4 halamanSifat PeriodikNurul Ayu MuliawatiBelum ada peringkat
- Sifat Periodik UnsurDokumen5 halamanSifat Periodik UnsurAnHiSweettLibradarrIBelum ada peringkat
- Sifat Periodik UnsurDokumen5 halamanSifat Periodik UnsurSri Laras SetiasihBelum ada peringkat
- Hubungan Jari Jari Atom Dengan Sifat Yang LainDokumen1 halamanHubungan Jari Jari Atom Dengan Sifat Yang LainCici ApriliaBelum ada peringkat
- Energi IonisasiDokumen15 halamanEnergi IonisasiSidik SegaragaBelum ada peringkat
- Energi IonisasiDokumen9 halamanEnergi IonisasiMuriaty Muchlis RBelum ada peringkat
- Sifat-Sifat Keperiodikan UnsurDokumen28 halamanSifat-Sifat Keperiodikan UnsurKharidah Is'adBelum ada peringkat
- Sifat Periodik UnsurDokumen20 halamanSifat Periodik UnsurSisyeNoyaBelum ada peringkat
- Tugas Kelompok Kimia 2 TerakhirDokumen8 halamanTugas Kelompok Kimia 2 TerakhirLaky SatriaBelum ada peringkat
- Sifat Keperiodikan Unsur Adalah Sifat-Sifat Yang Berubah Secara Beraturan Sesuai DenganDokumen3 halamanSifat Keperiodikan Unsur Adalah Sifat-Sifat Yang Berubah Secara Beraturan Sesuai Denganhilmi_nUFlBelum ada peringkat
- Sifat Periodik UnsurDokumen4 halamanSifat Periodik UnsurYuanita KartikaBelum ada peringkat
- Energi Ionisasi Dan ElektronegatifitasDokumen4 halamanEnergi Ionisasi Dan ElektronegatifitasSepti GyanaBelum ada peringkat
- Muatan Inti EfektifDokumen8 halamanMuatan Inti EfektifAndiniBelum ada peringkat
- Periodisitas UnsurDokumen31 halamanPeriodisitas UnsurmariadolorosamamutBelum ada peringkat
- Lampiran PPT Sifat Keperiodikan UnsurDokumen28 halamanLampiran PPT Sifat Keperiodikan UnsurKharidah Is'ad50% (2)
- Fisika Radiografi PPT Struktur Atom Kelompok 2Dokumen32 halamanFisika Radiografi PPT Struktur Atom Kelompok 2Ayu Wita SariBelum ada peringkat
- LK 0.1 Modul 2Dokumen13 halamanLK 0.1 Modul 2ibenk pelipurlaraBelum ada peringkat
- Kel 7 - Potensial Ionisasi & ElektronegativitasDokumen13 halamanKel 7 - Potensial Ionisasi & ElektronegativitasSteven NainggolanBelum ada peringkat
- Struktur AtomDokumen50 halamanStruktur AtomPutri S. DadungBelum ada peringkat
- Kelimpahan Unsur Di Alam Dan Sifat-Sifat Periodik UnsurDokumen17 halamanKelimpahan Unsur Di Alam Dan Sifat-Sifat Periodik UnsurDewi ShakilaBelum ada peringkat
- Sifat Sifat AtomDokumen5 halamanSifat Sifat Atomabubakar100% (1)
- Sifat Sistem Periodik Unsur KimiaDokumen3 halamanSifat Sistem Periodik Unsur KimiaEka AnjaruriBelum ada peringkat
- ResumeeeDokumen5 halamanResumeeeWAFIQ AZIZAH RAHIMBelum ada peringkat
- Ikatan Kimia-Kelompok 3Dokumen12 halamanIkatan Kimia-Kelompok 3nidaul hasanahBelum ada peringkat
- Listrik Statis Terjadi Ketika Muatan Listrik PositifDokumen14 halamanListrik Statis Terjadi Ketika Muatan Listrik PositifheldaBelum ada peringkat
- Srihayuni - 20036075 - Resume Minggu 5 - SSADokumen6 halamanSrihayuni - 20036075 - Resume Minggu 5 - SSASrihayuniBelum ada peringkat
- Pengertian Energi Ionisasi AtomDokumen4 halamanPengertian Energi Ionisasi AtomParisBelum ada peringkat
- Sifat-Sifat KeperiodikanDokumen11 halamanSifat-Sifat Keperiodikananandatya almanfalutyBelum ada peringkat
- Afinitas ElektronDokumen3 halamanAfinitas ElektronLoya Angelita100% (1)
- Energi IonisasiDokumen1 halamanEnergi IonisasiNurmutiah SyamsuddinBelum ada peringkat
- Makalah Ikatan IonDokumen13 halamanMakalah Ikatan IonWarnet Vast RahaBelum ada peringkat
- Sifat Sifat AtomDokumen19 halamanSifat Sifat AtomLenia W SugiyantoBelum ada peringkat
- Sifat Sifat PeriodikDokumen5 halamanSifat Sifat PeriodikEsar RezaBelum ada peringkat
- Materi Sifat-Sifat Keperiodikan UnsurDokumen10 halamanMateri Sifat-Sifat Keperiodikan Unsurhana khannaBelum ada peringkat
- Fisika IntiDokumen15 halamanFisika IntimuthoharatunnisaBelum ada peringkat
- Sifat Keperiodikan UnsurDokumen9 halamanSifat Keperiodikan UnsurRhine ArdiBelum ada peringkat
- Materi Pertemuan Ke 6Dokumen25 halamanMateri Pertemuan Ke 6Mega PurwantiBelum ada peringkat
- Interaksi Radiasi Dengan MateriDokumen15 halamanInteraksi Radiasi Dengan MateriIndra Irawan50% (4)
- Afinitas ElektronDokumen6 halamanAfinitas ElektronPutri AzzahraBelum ada peringkat
- Modul Listrik Dan ElektronikaDokumen12 halamanModul Listrik Dan ElektronikaSiti SuparyutiBelum ada peringkat
- Elektron Dalam LogamDokumen20 halamanElektron Dalam LogamTiara HarliantiBelum ada peringkat
- Tugas Kimdas AtomDokumen6 halamanTugas Kimdas AtomRezki Mulyawan92% (13)
- Ikatan KimiaDokumen31 halamanIkatan KimiaSiti Ayla AzzuraBelum ada peringkat
- Listrik Statis Pertemuan Ke 1Dokumen4 halamanListrik Statis Pertemuan Ke 1firdaBelum ada peringkat
- Fisika - Inti - VII - Interaksi Radiasi-Materi-1Dokumen25 halamanFisika - Inti - VII - Interaksi Radiasi-Materi-1LuckyBelum ada peringkat
- Atom Struktur Material KelistrikanDokumen7 halamanAtom Struktur Material KelistrikanBagus dwiBelum ada peringkat
- KLP 4 Sistem Periodik UnsurDokumen12 halamanKLP 4 Sistem Periodik UnsurSt. AnisaBelum ada peringkat
- 040 - Moh Threewahyu Saifulloh - Tugas TDA Week-3 - PKB22Dokumen6 halaman040 - Moh Threewahyu Saifulloh - Tugas TDA Week-3 - PKB22Egi 100PKB22Belum ada peringkat
- Jobsheet 10 Teori Dasar Listrik Otomotif (Atom)Dokumen4 halamanJobsheet 10 Teori Dasar Listrik Otomotif (Atom)dianBelum ada peringkat
- Beberapa Sifat Unsur PeriodikDokumen6 halamanBeberapa Sifat Unsur Periodikilham.anjasBelum ada peringkat
- Tugas A&bDokumen5 halamanTugas A&bKarnita ZaenuddinBelum ada peringkat
- Sifat Keperiodikan UnsurDokumen7 halamanSifat Keperiodikan Unsurika sanjiwaniBelum ada peringkat
- 2 Ikatan KimiaDokumen27 halaman2 Ikatan KimiasherlyjelekBelum ada peringkat
- LAMPIRAN Lembar ObservasiDokumen13 halamanLAMPIRAN Lembar ObservasiSAHABelum ada peringkat
- 4 Askep AnemiaDokumen30 halaman4 Askep AnemiaSAHABelum ada peringkat
- Leaflet GeriatriDokumen2 halamanLeaflet GeriatriSAHABelum ada peringkat
- Inventaris Poli Ginjal HipertensiDokumen1 halamanInventaris Poli Ginjal HipertensiSAHABelum ada peringkat
- Analisis Swot Pada Rumah SakitDokumen11 halamanAnalisis Swot Pada Rumah SakitSAHABelum ada peringkat
- Catatan LP Dan AskepDokumen1 halamanCatatan LP Dan AskepSAHABelum ada peringkat
- Refleksi Kasus Maternitas 1Dokumen2 halamanRefleksi Kasus Maternitas 1SAHABelum ada peringkat
- Contoh Makalah: Asuhan Keperawatan KehamilanDokumen10 halamanContoh Makalah: Asuhan Keperawatan KehamilanSAHABelum ada peringkat
- Vdocs - CZ - lp-1-kdm KEBUTUHAN NYERIDokumen36 halamanVdocs - CZ - lp-1-kdm KEBUTUHAN NYERISAHABelum ada peringkat
- Latihan, Materi Nyeri M SUBANDIDokumen3 halamanLatihan, Materi Nyeri M SUBANDISAHABelum ada peringkat
- Kimia S, 2 No 4Dokumen1 halamanKimia S, 2 No 4SAHABelum ada peringkat
- Tutorial Klinik KDPDokumen3 halamanTutorial Klinik KDPSAHABelum ada peringkat
- Diagnosa Nyeri Dengan SDKIDokumen2 halamanDiagnosa Nyeri Dengan SDKISAHABelum ada peringkat
- Majlis Fatwa Dewan Dawah Pasien StomaDokumen4 halamanMajlis Fatwa Dewan Dawah Pasien StomaSAHABelum ada peringkat
- Selamat Pagi: Sabtu, 09 Februari 2013Dokumen15 halamanSelamat Pagi: Sabtu, 09 Februari 2013SAHABelum ada peringkat
- Asuhan Keperawatan Maternitas Pada Ibu Hamil (Pre Natal)Dokumen12 halamanAsuhan Keperawatan Maternitas Pada Ibu Hamil (Pre Natal)SAHABelum ada peringkat
- Rina Kusuma Wardani: Rabu, 08 Mei 2013Dokumen23 halamanRina Kusuma Wardani: Rabu, 08 Mei 2013SAHABelum ada peringkat
- Medicastore: Kamis, 21 Juni 2012Dokumen8 halamanMedicastore: Kamis, 21 Juni 2012SAHABelum ada peringkat
- Defka's Blog: Halaman Sindikasi MetaDokumen16 halamanDefka's Blog: Halaman Sindikasi MetaSAHABelum ada peringkat
- Asuhan Keperawatan Ibu Hamil Dengan Persalinan Normal Laporan Pendahuluan Persalinan Normal A. DefenisiDokumen15 halamanAsuhan Keperawatan Ibu Hamil Dengan Persalinan Normal Laporan Pendahuluan Persalinan Normal A. DefenisiSAHABelum ada peringkat
- Ringkasan Oa GenuDokumen4 halamanRingkasan Oa GenuSAHABelum ada peringkat
- Sholat Nya Pasien Yang Membawa Kantong NajisDokumen4 halamanSholat Nya Pasien Yang Membawa Kantong NajisSAHABelum ada peringkat
- Teknik Relaksasi Nafas Dalam Terapi Edit WordDokumen147 halamanTeknik Relaksasi Nafas Dalam Terapi Edit WordSAHABelum ada peringkat
- Formulir Penilaian Gadar (Triage)Dokumen3 halamanFormulir Penilaian Gadar (Triage)SAHABelum ada peringkat
- Fraktur Tibia Open FR TibiaDokumen138 halamanFraktur Tibia Open FR TibiaSAHABelum ada peringkat
- Askep Efusi PleuraDokumen20 halamanAskep Efusi PleuraSAHABelum ada peringkat
- Askep Inayah-1 TBCDokumen4 halamanAskep Inayah-1 TBCSAHABelum ada peringkat
- Formulir Penilaian AnakDokumen3 halamanFormulir Penilaian AnakSAHABelum ada peringkat
- Virginia Henderson TeoriDokumen6 halamanVirginia Henderson TeoriSAHABelum ada peringkat
- Askep Thypoid CoverDokumen4 halamanAskep Thypoid CoverSAHABelum ada peringkat