Info Skenario 5
Diunggah oleh
Erikha ChairilHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Info Skenario 5
Diunggah oleh
Erikha ChairilHak Cipta:
Format Tersedia
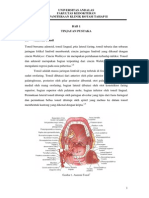
BAB VIII Dasar - Dasar Teknologi DNA Rekombinan
Pengertian Teknologi DNA Rekombinan Secara klasik analisis molekuler protein dan materi lainnya dari kebanyakan organisme ternyata sangat tidak mudah untuk dilakukan karena adanya kesulitan untuk memurnikannya dalam jumlah besar. Namun, sejak tahun 1970-an berkembang suatu teknologi yang dapat diterapkan sebagai pendekatan dalam mengatasi masalah tersebut melalui isolasi dan manipulasi terhadap gen yang bertanggung jawab atas ekspresi protein tertentu atau pembentukan suatu produk. Teknologi yang dikenal sebagai teknologi DNA rekombinan, atau dengan istilah yang lebih populer rekayasa genetika, ini melibatkan upaya perbanyakan gen tertentu di dalam suatu sel yang bukan sel alaminya sehingga sering pula dikatakan sebagai kloning gen. Banyak definisi telah diberikan untuk mendeskripsikan pengertian teknologi DNA rekombinan. Salah satu di antaranya, yang mungkin paling representatif, menyebutkan bahwa teknologi DNA rekombinan adalah pembentukan kombinasi materi genetik yang baru dengan cara penyisipan molekul DNA ke dalam suatu vektor sehingga memungkinkannya untuk terintegrasi dan mengalami perbanyakan di dalam suatu sel organisme lain yang berperan sebagai sel inang. Teknologi DNA rekombinan mempunyai dua segi manfaat. Pertama, dengan mengisolasi dan mempelajari masing-masing gen akan diperoleh pengetahuan tentang fungsi dan mekanisme kontrolnya. Kedua, teknologi ini
memungkinkan diperolehnya produk gen tertentu dalam waktu lebih cepat dan jumlah lebih besar daripada produksi secara konvensional. Pada dasarnya upaya untuk mendapatkan suatu produk yang diinginkan melalui teknologi DNA rekombinan melibatkan beberapa tahapan tertentu (Gambar 9.1). Tahapan-tahapan tersebut adalah isolasi DNA genomik/kromosom yang akan diklon, pemotongan molekul DNA menjadi sejumlah fragmen dengan berbagai ukuran, isolasi DNA vektor, penyisipan fragmen DNA ke dalam vektor untuk menghasilkan molekul DNA rekombinan, transformasi sel inang menggunakan molekul DNA rekombinan, reisolasi molekul DNA rekombinan dari sel inang, dan analisis DNA rekombinan.
Isolasi DNA Isolasi DNA diawali dengan perusakan dan atau pembuangan dinding sel, yang dapat dilakukan baik dengan cara mekanis seperti sonikasi, tekanan tinggi, beku-leleh maupun dengan cara enzimatis seperti pemberian lisozim. Langkah berikutnya adalah lisis sel. Bahan-bahan sel yang relatif lunak dapat dengan mudah diresuspensi di dalam medium bufer nonosmotik, sedangkan bahan-bahan yang lebih kasar perlu diperlakukan dengan deterjen yang kuat seperti triton X100 atau dengan sodium dodesil sulfat (SDS). Pada eukariot langkah ini harus disertai dengan perusakan membran nukleus. Setelah sel mengalami lisis, remukan-remukan sel harus dibuang. Biasanya pembuangan remukan sel dilakukan dengan sentrifugasi. Protein yang tersisa dipresipitasi menggunakan fenol atau pelarut organik seperti kloroform untuk kemudian disentrifugasi dan dihancurkan secara enzimatis dengan proteinase. DNA yang telah dibersihkan dari
protein dan remukan sel masih tercampur dengan RNA sehingga perlu ditambahkan RNAse untuk membersihkan DNA dari RNA. Molekul DNA yang telah diisolasi tersebut kemudian dimurnikan dengan penambahan amonium asetat dan alkohol atau dengan sentrifugasi kerapatan menggunakan CsCl (lihat Bab II). Teknik isolasi DNA tersebut dapat diaplikasikan, baik untuk DNA genomik maupun DNA vektor, khususnya plasmid. Untuk memilih di antara kedua macam molekul DNA ini yang akan diisolasi dapat digunakan dua pendekatan. Pertama, plasmid pada umumnya berada dalam struktur tersier yang sangat kuat atau dikatakan mempunyai bentuk covalently closed circular (CCC), sedangkan DNA kromosom jauh lebih longgar ikatan kedua untainya dan mempunyai nisbah aksial yang sangat tinggi. Perbedaan tersebut menyebabkan DNA plasmid jauh lebih tahan terhadap denaturasi apabila dibandingkan dengan DNA kromosom. Oleh karena itu, aplikasi kondisi denaturasi akan dapat memisahkan DNA plasmid dengan DNA kromosom. Pendekatan kedua didasarkan atas perbedaan daya serap etidium bromid, zat pewarna DNA yang menyisip atau melakukan interkalasi di sela-sela basa molekul DNA. DNA plasmid akan menyerap etidium bromid jauh lebih sedikit daripada jumlah yang diserap oleh DNA kromosom per satuan panjangnya. Dengan demikian, perlakuan menggunakan etidium bromid akan menjadikan kerapatan DNA kromosom lebih tinggi daripada kerapatan DNA plasmid sehingga keduanya dapat dipisahkan melalui sentrifugasi kerapatan.
Enzim Restriksi Tahap kedua dalam kloning gen adalah pemotongan molekul DNA, baik genomik maupun plasmid. Perkembangan teknik pemotongan DNA berawal dari saat ditemukannya sistem restriksi dan modifikasi DNA pada bakteri E. coli, yang berkaitan dengan infeksi virus atau bakteriofag lambda (l). Virus l digunakan untuk menginfeksi dua strain E. coli, yakni strain K dan C. Jika l yang telah menginfeksi strain C diisolasi dari strain tersebut dan kemudian digunakan untuk mereinfeksi strain C, maka akan diperoleh l progeni (keturunan) yang lebih kurang sama banyaknya dengan jumlah yang diperoleh dari infeksi pertama. Dalam hal ini, dikatakan bahwa efficiency of plating (EOP) dari strain C ke strain C adalah 1. Namun, jika l yang diisolasi dari strain C digunakan untuk menginfeksi strain K, maka nilai EOP-nya hanya 10-4. Artinya, hanya ditemukan l progeni sebanyak 1/10.000 kali jumlah yang diinfeksikan. Sementara itu, l yang diisolasi dari strain K mempunyai nilai EOP sebesar 1, baik ketika direinfeksikan pada strain K maupun pada strain C. Hal ini terjadi karena adanya sistem restriksi/modifikasi (r/m) pada strain K. Pada waktu bakteriofag l yang diisolasi dari strain C diinfeksikan ke strain K, molekul DNAnya dirusak oleh enzim endonuklease restriksi yang terdapat di dalam strain K. Di sisi lain, untuk mencegah agar enzim ini tidak merusak DNAnya sendiri, strain K juga mempunyai sistem modifikasi yang akan menyebabkan metilasi beberapa basa pada sejumlah urutan tertentu yang merupakan tempat-tempat pengenalan (recognition sites) bagi enzim restriksi tersebut.
DNA bakteriofag l yang mampu bertahan dari perusakan oleh enzim restriksi pada siklus infeksi pertama akan mengalami modifikasi dan memperoleh kekebalan terhadap enzim restrisksi tersebut. Namun, kekebalan ini tidak diwariskan dan harus dibuat pada setiap akhir putaran replikasi DNA. Dengan demikian, bakteriofag l yang diinfeksikan dari strain K ke strain C dan dikembalikan lagi ke strain K akan menjadi rentan terhadap enzim restriksi. Metilasi hanya terjadi pada salah satu di antara kedua untai molekul DNA. Berlangsungnya metilasi ini demikian cepatnya pada tiap akhir replikasi hingga molekul DNA baru hasil replikasi tidak akan sempat terpotong oleh enzim restriksi. Enzim restriksi dari strain K telah diisolasi dan banyak dipelajari. Selanjutnya, enzim ini dimasukkan ke dalam suatu kelompok enzim yang dinamakan enzim restriksi tipe I. Banyak enzim serupa yang ditemukan kemudian pada berbagai spesies bakteri lainnya. Pada tahun 1970 T.J. Kelly menemukan enzim pertama yang kemudian dimasukkan ke dalam kelompok enzim restriksi lainnya, yaitu enzim restriksi tipe II. Ia mengisolasi enzim tersebut dari bakteri Haemophilus influenzae strain Rd, dan sejak saat itu ditemukan lebih dari 475 enzim restriksi tipe II dari berbagai spesies dan strain bakteri. Semuanya sekarang telah menjadi salah satu komponen utama dalam tata kerja rekayasa genetika. Enzim restriksi tipe II antara lain mempunyai sifat-sifat umum yang penting sebagai berikut: 1. Mengenali urutan tertentu sepanjang empat hingga tujuh pasang basa di dalam molekul DNA
2.
Memotong kedua untai molekul DNA di tempat tertentu pada atau di dekat tempat pengenalannya
3.
Menghasilkan fragmen-fragmen DNA dengan berbagai ukuran dan urutan basa. Sebagian besar enzim restriksi tipe II akan mengenali dan memotong urutan
pengenal yang mempunyai sumbu simetri rotasi. Pemberian nama kepada enzim restriksi mengikuti aturan sebagai berikut. Huruf pertama adalah huruf pertama nama genus bakteri sumber isolasi enzim, sedangkan huruf kedua dan ketiga masing-masing adalah huruf pertama dan kedua nama petunjuk spesies bakteri sumber tersebut. Huruf-huruf tambahan, jika ada, berasal dari nama strain bakteri, dan angka romawi digunakan untuk membedakan enzim yang berbeda tetapi diisolasi dari spesies yang sama. Tempat pemotongan pada kedua untai DNA sering kali terpisah sejauh beberapa pasang basa. Pemotongan DNA dengan tempat pemotongan semacam ini akan menghasilkan fragmen-fragmen dengan ujung 5 yang runcing karena masing-masing untai tunggalnya menjadi tidak sama panjang. Dua fragmen DNA dengan ujung yang runcing akan mudah disambungkan satu sama lain sehingga ujung runcing sering pula disebut sebagai ujung lengket (sticky end) atau ujung kohesif. Hal itu berbeda dengan enzim restriksi seperti Hae III, yang mempunyai tempat pemotongan DNA pada posisi yang sama. Kedua fragmen hasil pemotongannya akan mempunyai ujung 5 yang tumpul karena masing-masing untai tunggalnya sama panjangnya. Fragmen-fragmen DNA dengan ujung tumpul (blunt end) akan sulit untuk disambungkan. Biasanya diperlukan
perlakuan tambahan untuk menyatukan dua fragmen DNA dengan ujung tumpul, misalnya pemberian molekul linker, molekul adaptor, atau penambahan enzim deoksinukleotidil transferase untuk menyintesis untai tunggal homopolimerik 3.
Ligasi Molekul molekul DNA Pemotongan DNA genomik dan DNA vektor menggunakan enzim restriksi harus menghasilkan ujung-ujung potongan yang kompatibel. Artinya, fragmen-fragmen DNA genomik nantinya harus dapat disambungkan (diligasi) dengan DNA vektor yang sudah berbentuk linier. Ada tiga cara yang dapat digunakan untuk meligasi fragmen-fragmen DNA secara in vitro. Pertama, ligasi menggunakan enzim DNA ligase dari bakteri. Kedua, ligasi menggunakan DNA ligase dari sel-sel E. coli yang telah diinfeksi dengan bakteriofag T4 atau lazim disebut sebagai enzim T4 ligase. Jika cara yang pertama hanya dapat digunakan untuk meligasi ujung-ujung lengket, cara yang kedua dapat digunakan baik pada ujung lengket maupun pada ujung tumpul. Sementara itu, cara yang ketiga telah disinggung di atas, yaitu pemberian enzim deoksinukleotidil transferase untuk menyintesis untai tunggal
homopolimerik 3. Dengan untai tunggal semacam ini akan diperoleh ujung lengket buatan, yang selanjutnya dapat diligasi menggunakan DNA ligase. Suhu optimum bagi aktivitas DNA ligase sebenarnya 37C. Akan tetapi, pada suhu ini ikatan hidrogen yang secara alami terbentuk di antara ujung-ujung lengket akan menjadi tidak stabil dan kerusakan akibat panas akan terjadi pada tempat ikatan tersebut. Oleh karena itu, ligasi biasanya dilakukan pada suhu
antara 4 dan 15C dengan waktu inkubasi (reaksi) yang diperpanjang (sering kali hingga semalam). Pada reaksi ligasi antara fragmen-fragmen DNA genomik dan DNA vektor, khususnya plasmid, dapat terjadi peristiwa religasi atau ligasi sendiri sehingga plasmid yang telah dilinierkan dengan enzim restriksi akan menjadi plasmid sirkuler kembali. Hal ini jelas akan menurunkan efisiensi ligasi. Untuk meningkatkan efisiensi ligasi dapat dilakukan beberapa cara, antara lain penggunaan DNA dengan konsentrasi tinggi (lebih dari 100g/ml), perlakuan dengan enzim alkalin fosfatase untuk menghilangkan gugus fosfat dari ujung 5 pada molekul DNA yang telah terpotong, serta pemberian molekul linker, molekul adaptor, atau penambahan enzim deoksinukleotidil transferase untuk menyintesis untai tunggal homopolimerik 3 seperti telah disebutkan di atas.
Transformasi Sel Inang Tahap berikutnya setelah ligasi adalah analisis terhadap hasil pemotongan DNA genomik dan DNA vektor serta analisis hasil ligasi molekul-molekul DNA tersebut. menggunakan teknik elektroforesis (lihat Bab X). Jika hasil elektroforesis menunjukkan bahwa fragmen-fragmen DNA genomik telah terligasi dengan baik pada DNA vektor sehingga terbentuk molekul DNA rekombinan, campuran reaksi ligasi dimasukkan ke dalam sel inang agar dapat diperbanyak dengan cepat. Dengan sendirinya, di dalam campuran reaksi tersebut selain terdapat molekul DNA rekombinan, juga ada sejumlah fragmen DNA genomik dan DNA plasmid yang tidak terligasi satu sama lain. Tahap memasukkan campuran reaksi ligasi ke dalam sel inang ini dinamakan transformasi karena sel
inang diharapkan akan mengalami perubahan sifat tertentu setelah dimasuki molekul DNA rekombinan. Teknik transformasi pertama kali dikembangkan pada tahun 1970 oleh M. Mandel dan A. Higa, yang melakukan transformasi bakteri E. coli. Sebelumnya, transformasi pada beberapa spesies bakteri lainnya yang mempunyai sistem transformasi alami seperti Bacillus subtilis telah dapat dilakukan. Kemampuan transformasi B. subtilis pada waktu itu telah dimanfaatkan untuk mengubah strainstrain auksotrof (tidak dapat tumbuh pada medium minimal) menjadi prototrof (dapat tumbuh pada medium minimal) dengan menggunakan preparasi DNA genomik utuh. Baru beberapa waktu kemudian transformasi dilakukan menggunakan perantara vektor, yang selanjutnya juga dikembangkan pada transformasi E.coli. Hal terpenting yang ditemukan oleh Mandel dan Higa adalah perlakuan kalsium klorid (CaCl2) yang memungkinkan sel-sel E. coli untuk mengambil DNA dari bakteriofag l. Pada tahun 1972 S.N. Cohen dan kawan-kawannya menemukan bahwa sel-sel yang diperlakukan dengan CaCl2 dapat juga mengambil DNA plasmid. Frekuensi transformasi tertinggi akan diperoleh jika sel bakteri dan DNA dicampur di dalam larutan CaCl2 pada suhu 0 hingga 5C. Perlakuan kejut panas antara 37 dan 45C selama lebih kurang satu menit yang diberikan setelah pencampuran DNA dengan larutan CaCl2 tersebut dapat meningkatkan frekuensi transformasi tetapi tidak terlalu esensial. Molekul DNA berukuran besar lebih rendah efisiensi transformasinya daripada molekul DNA kecil.
Mekanisme transformasi belum sepenuhnya dapat dijelaskan. Namun, setidak-tidaknya transformasi melibatkan tahap-tahap berikut ini. Molekul CaCl2 akan menyebabkan sel-sel bakteri membengkak dan membentuk sferoplas yang kehilangan protein periplasmiknya sehingga dinding sel menjadi bocor. DNA yang ditambahkan ke dalam campuran ini akan membentuk kompleks resisten DNase dengan ion-ion Ca2+ yang terikat pada permukaan sel. Kompleks ini kemudian diambil oleh sel selama perlakuan kejut panas diberikan.
Seleksi Transforman dan Seleksi Rekombinan Oleh karena DNA yang dimasukkan ke dalam sel inang bukan hanya DNA rekombinan, maka kita harus melakukan seleksi untuk memilih sel inang transforman yang membawa DNA rekombinan. Selanjutnya, di antara sel-sel transforman yang membawa DNA rekombinan masih harus dilakukan seleksi untuk mendapatkan sel yang DNA rekombinannya membawa fragmen sisipan atau gen yang diinginkan. Cara seleksi sel transforman akan diuraikan lebih rinci pada penjelasan tentang plasmid (lihat Bab XI). Pada dasarnya ada tiga kemungkinan yang dapat terjadi setelah transformasi dilakukan, yaitu (1) sel inang tidak dimasuki DNA apa pun atau berarti transformasi gagal, (2) sel inang dimasuki vektor religasi atau berarti ligasi gagal, dan (3) sel inang dimasuki vektor rekombinan dengan/tanpa fragmen sisipan atau gen yang diinginkan. Untuk membedakan antara kemungkinan pertama dan kedua dilihat perubahan sifat yang terjadi pada sel inang. Jika sel inang memperlihatkan dua sifat marker vektor, maka dapat dipastikan bahwa kemungkinan kedualah yang terjadi. Selanjutnya, untuk
10
membedakan antara kemungkinan kedua dan ketiga dilihat pula perubahan sifat yang terjadi pada sel inang. Jika sel inang hanya memperlihatkan salah satu sifat di antara kedua marker vektor, maka dapat dipastikan bahwa kemungkinan ketigalah yang terjadi. Seleksi sel rekombinan yang membawa fragmen yang diinginkan dilakukan dengan mencari fragmen tersebut menggunakan fragmen pelacak (probe), yang pembuatannya dilakukan secara in vitro menggunakan teknik reaksi polimerisasi berantai atau polymerase chain reaction (PCR). Penjelasan lebih rinci tentang teknik PCR dapat dilihat pada Bab XII. Pelacakan fragmen yang diinginkan antara lain dapat dilakukan melalui cara yang dinamakan hibridisasi koloni (lihat Bab X). Koloni-koloni sel rekombinan ditransfer ke membran nilon, dilisis agar isi selnya keluar, dibersihkan protein dan remukan sel lainnya hingga tinggal tersisa DNAnya saja. Selanjutnya, dilakukan fiksasi DNA dan perendaman di dalam larutan pelacak. Posisi-posisi DNA yang terhibridisasi oleh fragmen pelacak dicocokkan dengan posisi koloni pada kultur awal (master plate). Dengan demikian, kita bisa menentukan koloni-koloni sel rekombinan yang membawa fragmen yang diinginkan.
11
BAB X Vektor Kloning
Pengertian dan Macam-macam Vektor Kloning Pada Bab IX antara lain telah dibicarakan bahwa transformasi sel inang dilakukan menggunakan perantara vektor. Jadi, vektor adalah molekul DNA yang berfungsi sebagai wahana atau kendaraan yang akan membawa suatu fragmen DNA masuk ke dalam sel inang dan memungkinkan terjadinya replikasi dan ekspresi fragmen DNA asing tersebut. Vektor yang dapat digunakan pada sel inang prokariot, khususnya E. coli, adalah plasmid, bakteriofag, kosmid, dan fasmid. Sementara itu, vektor YACs dan YEps dapat digunakan pada khamir. Plasmid Ti, baculovirus, SV40, dan retrovirus merupakan vektor-vektor yang dapat digunakan pada sel eukariot tingkat tinggi.
Plasmid Secara umum plasmid dapat didefinisikan sebagai molekul DNA sirkuler untai ganda di luar kromosom yang dapat melakukan replikasi sendiri. Plasmid tersebar luas di antara organisme prokariot dengan ukuran yang bervariasi dari sekitar 1 kb hingga lebih dari 250 kb (1 kb = 1000 pb). Agar dapat digunakan sebagai vektor kloning, plasmid harus memenuhi syarat-syarat berikut ini: 1. Mempunyai ukuran relatif kecil bila dibandingkan dengan pori dinding sel inang sehingga dapat dengan mudah melintasinya, 2. Mempunyai sekurang-kurangnya dua gen marker yang dapat menandai masuk tidaknya plasmid ke dalam sel inang,
12
3.
Mempunyai tempat pengenalan restriksi sekurang-kurangnya di dalam salah satu marker yang dapat digunakan sebagai tempat penyisipan fragmen DNA, dan
4.
Mempunyai titik awal replikasi (ori) sehingga dapat melakukan replikasi di dalam sel inang. Salah satu contoh plasmid buatan yang banyak digunakan dalam kloning
gen adalah pBR322. Plasmid ini dikonstruksi oleh F. Bolivar dan kawan-kawanya pada tahun 1977. Urutan basa lengkapnya telah ditentukan sehingga baik tempat marker maupun pengenalan restriksinya juga telah diketahui. Sayangnya, tempat pengenalan EcoR I, salah satu enzim restriksi yang sangat umum digunakan, terletak di luar marker. Oleh karena salah satu marker akan menjadi tempat penyisipan fragmen DNA asing, maka EcoR I tidak dapat digunakan untuk memotong pBR322 di tempat penyisipan tersebut. Namun, saat ini telah dikonstruksi derivat-derivat pBR322 yang mempunyai tempat pengenalan EcoR I di dalam marker, misalnya plasmid pBR324 dan pBR325 yang masing-masing mempunyai tempat pengenalan EcoR I di dalam gen struktural kolisin dan di dalam gen resisten kloramfenikol. Misalnya saja kita menyisipkan suatu fragmen DNA pada daerah marker resisten ampisilin dengan memotong daerah ini menggunakan enzim restriksi tertentu selain EcoR I (mengapa harus selain EcoR I?). Plasmid pBR322 yang tersisipi oleh fragmen DNA akan kehilangan sifat resistensinya terhadap ampisilin, tetapi masih mempunyai sifat resistensi terhadap tetrasiklin. Oleh karena itu, ketika plasmid pBR322 rekombinan ini dimasukkan ke dalam sel inangnya, yakni E. coli, bakteri transforman ini tidak mampu tumbuh pada
13
medium yang mengandung ampisilin, tetapi tumbuh pada medium tetrasiklin. Secara alami E. coli tidak mampu tumbuh baik pada medium ampisilin maupun tetrasiklin sehingga sel transforman dapat dengan mudah dibedakan dengan sel nontransforman yang tidak mengandung pBR322 sama sekali. Sementara itu, E. coli transforman yang membawa plasmid pBR322 utuh (religasi) mampu tumbuh pada kedua medium antibiotik tersebut. Jadi, untuk memperoleh sel E. coli transforman yang membawa DNA rekombinan dicari koloni yang hidup di tetrasiklin tetapi mati di ampisilin. Secara teknis pekerjaan ini dilakukan menggunakan transfer koloni atau replica plating (lihat Bab X). Plasmid yang digunakan pada bakteri gram negatif seperti halnya pBR322 tidak dapat digunakan pada bakteri gram positif. Namun, saat ini telah tersedia plasmid untuk kloning pada bakteri gram positif, misalnya pT127 dan pC194, yang dikonstruksi oleh S.D. Erlich pada tahun 1977 dari bakteri Staphylococcus aureus. Demikian juga, telah ditemukan plasmid untuk kloning pada eukariot, khususnya pada khamir, misalnya yeast integrating plasmids (YIps), yeast episomal plasmids (YEps), yeast replicating plasmids (YRps), dan yeast centromere plasmid (YCps).
Bakteriofag Bakteriofag adalah virus yang sel inangnya berupa bakteri. Dengan daur hidupnya yang bersifat litik atau lisogenik bakteriofag dapat digunakan sebagai vektor kloning pada sel inang bakteri. Ada beberapa macam bakteriofag yang biasa digunakan sebagai vektor kloning. Dua di antaranya akan dijelaskan berikut ini.
14
Bakteriofag l Bakteriofag atau fag l merupakan virus kompleks yang menginfeksi bakteri E. coli. Berkat pengetahuan yang memadai tentang fag ini, kita dapat memanfaatkannya sebagai vektor kloning semenjak masa-masa awal
perkembangan rekayasa genetika. DNA l yang diisolasi dari partikel fag ini mempunyai konformasi linier untai ganda dengan panjang 48,5 kb. Namun, masing-masing ujung fosfatnya berupa untai tunggal sepanjang 12 pb yang komplementer satu sama lain sehingga memungkinkan DNA l untuk berubah konformasinya menjadi sirkuler. Dalam bentuk sirkuler, tempat bergabungnya kedua untai tunggal sepanjang 12 pb tersebut dinamakan kos. Seluruh urutan basa DNA l telah diketahui. Secara alami terdapat lebih dari satu tempat pengenalan restriksi untuk setiap enzim restriksi yang biasa digunakan. Oleh karena itu, DNA l tipe alami tidak cocok untuk digunakan sebagai vektor kloning. Akan tetapi, saat ini telah banyak dikonstruksi derivat-derivat DNA l yang memenuhi syarat sebagai vektor kloning. Ada dua macam vektor kloning yang berasal dari DNA l, yaitu vektor insersional, yang dengan mudah dapat disisipi oleh fragmen DNA asing, vektor substitusi, yang untuk membawa fragmen DNA asing harus membuang sebagian atau seluruh urutan basanya yang terdapat di daerah nonesensial dan menggantinya dengan urutan basa fragmen DNA asing tersebut. Di antara kedua macam vektor l tersebut, vektor substitusi lebih banyak digunakan karena kemampuannya untuk membawa fragmen DNA asing hingga 23 kb. Salah satu contohnya adalah vektor WES, yang mempunyai mutasi pada tiga gen esensial, yaitu gen W, E, dan S. Vektor ini hanya dapat digunakan pada sel inang yang
15
dapat menekan mutasi tersebut. Cara substitusi fragmen DNA asing pada daerah nonesensial membutuhkan dua tempat pengenalan restriksi untuk setiap enzim restriksi. Jika suatu enzim restrisksi memotong daerah nonesensial di dua tempat berbeda, maka segmen DNA l di antara kedua tempat tersebut akan dibuang untuk selanjutnya digantikan oleh fragmen DNA asing. Jika pembuangan segmen DNA l tidak diikuti oleh substitusi fragmen DNA asing, maka akan terjadi religasi vektor DNA l yang kehilangan sebagian segmen pada daerah nonesensial. Vektor religasi semacam ini tidak akan mampu bertahan di dalam sel inang. Dengan demikian, ada suatu mekanisme seleksi automatis yang dapat membedakan antara sel inang dengan vektor rekombinan dan sel inang dengan vektor religasi. Bakteriofag l mempunyai dua fase daur hidup, yaitu fase litik dan fase lisogenik. Pada fase litik, transfeksi sel inang (istilah transformasi untuk DNA fag) dimulai dengan masuknya DNA l yang berubah konformasinya menjadi sirkuler dan mengalami replikasi secara independen atau tidak bergantung kepada kromosom sel inang. Setelah replikasi menghasilkan sejumlah salinan DNA l sirkuler, masing-masing DNA ini akan melakukan transkripsi dan translasi membentuk protein kapsid (kepala). Selanjutnya, tiap DNA akan dikemas (packaged) dalam kapsid sehingga dihasilkan partikel l baru yang akan keluar dari sel inang untuk menginfeksi sel inang lainnya. Sementara itu, pada fase lisogenik DNA l akan terintegrasi ke dalam kromosom sel inang sehingga replikasinya bergantung kepada kromosom sel inang. Fase lisogenik tidak menimbulkan lisis pada sel inang. Di dalam medium kultur, sel inang yang mengalami lisis akan membentuk plak (plaque) berupa daerah bening di antara koloni-koloni sel inang yang
16
tumbuh. Oleh karena itu, seleksi vektor rekombinan dapat dilakukan dengan melihat terbentuknya plak tersebut.
Vektor Kloning pada Mamalia Vektor untuk melakukan kloning pada sel-sel mamalia juga dikonstruksi atas dasar genom virus. Salah satu di antaranya yang telah cukup lama dikenal adalah SV40, yang menginfeksi berbagai spesies mamalia. Genom SV40 panjangnya hanya 5,2 kb. Genom ini mengalami kesulitan dalam pengepakan (packaging) sehingga pemanfaatan SV40 untuk mentransfer fragmenfragmen berukuran besar menjadi terbatas. Retrovirus mempunyai genom berupa RNA untai tunggal yang ditranskripsi balik menjadi DNA untai ganda setelah terjadi infeksi. DNA ini kemudian terintegrasi dengan stabil ke dalam genom sel mamalia inang sehingga retrovirus telah digunakan sebagai vektor dalam terapi gen. Retrovirus mempunyai beberapa promoter yang kuat.
17
BAB XI Polymerase Chain Reaction (PCR)
Pengertian dan Kegunaan PCR Pada bagian akhir Bab IX telah disinggung bahwa fragmen pelacak yang diperlukan dalam seleksi rekombinan merupakan molekul DNA untai ganda yang urutan basanya harus komplementer dengan sebagian urutan basa fragmen (gen) yang dilacak. Fragmen pelacak ini dibuat secara in vitro menggunakan teknik PCR. Namun, teknik yang ditemukan oleh Kary Mullis pada tahun 1987 ini, tidak hanya digunakan untuk membuat fragmen pelacak, tetapi secara umum teknik ini merupakan cara untuk menggandakan urutan basa nukleotida tertentu secara in vitro.
Komponen dan Tahapan PCR Penggandaan urutan basa nukleotida berlangsung melalui reaksi polimerisasi yang dilakukan berulang-ulang secara berantai selama beberapa putaran (siklus). Tiap reaksi polimerisasi membutuhkan komponen-komponen sintesis DNA seperti untai DNA yang akan digunakan sebagai cetakan (templat), molekul oligonukleotida untai tunggal dengan ujung 3-OH bebas yang berfungsi sebagai prekursor (primer), sumber basa nukleotida berupa empat macam dNTP (dATP, dGTP, dCTP, dTTP), dan enzim DNA polimerase. DNA templat adalah DNA untai ganda yang membawa urutan basa fragmen atau gen yang akan digandakan. Urutan basa ini disebut juga urutan target (target sequence). Penggandaan urutan target pada dasarnya merupakan akumulasi hasil polimerisasi molekul primer.
18
Primer adalah molekul oligonukleotida untai tunggal yang terdiri atas sekitar 30 basa. Polimerisasi primer dapat berlangsung karena adanya penambahan basa demi basa dari dNTP yang dikatalisasi oleh enzim DNA polimerase. Namun, pada PCR enzim DNA polimerase yang digunakan harus termostabil karena salah satu tahap reaksinya adalah denaturasi untai ganda DNA yang membutuhkan suhu sangat tinggi (sekitar 95C). Salah satu enzim DNA polimerase yang umum digunakan adalah Taq DNA polimerase, yang berasal dari bakteri termofilik Thermus aquaticus. Tiap putaran reaksi PCR terdiri atas tiga tahap, yaitu denaturasi templat, penempelan primer, dan polimerisasi primer, yang masing-masing berlangsung pada suhu lebih kurang 95C, 50C, dan 70C. Pada tahap denaturasi, pasangan untai DNA templat dipisahkan satu sama lain sehingga menjadi untai tunggal. Pada tahap selanjutnya, masing-masing untai tunggal akan ditempeli oleh primer. Jadi, ada dua buah primer yang masing-masing menempel pada untai tunggal DNA templat. Biasanya, kedua primer tersebut dinamakan primer maju (forward primer) dan primer mundur (reverse primer). Setelah menempel pada untai DNA templat, primer mengalami polimerisasi mulai dari tempat penempelannya hingga ujung 5 DNA templat (ingat polimerisasi DNA selalu berjalan dari ujung 5 ke 3 atau berarti dari ujung 3 ke 5 untai templatnya). Dengan demikian, pada akhir putaran reaksi pertama akan diperoleh dua pasang untai DNA jika DNA templat awalnya berupa sepasang untai DNA. Pasangan-pasangan untai DNA yang diperoleh pada suatu akhir putaran reaksi akan menjadi templat pada putaran reaksi berikutnya. Begitu seterusnya hingga pada putaran yang ke n diharapkan akan diperoleh fragmen DNA pendek
19
sebanyak 2n 2n. Fragmen DNA pendek yang dimaksudkan adalah fragmen yang ukurannya sama dengan jarak antara kedua tempat penempelan primer. Fragmen pendek inilah yang merupakan urutan target yang memang dikehendaki untuk digandakan (diamplifikasi). Bisa kita bayangkan seandainya PCR dilakukan dalam 20 putaran saja, maka pada akhir reaksi akan diperoleh fragmen urutan target sebanyak 220 2.20 = 1.048576 40 = 1.048536 ! Jumlah ini masih dengan asumsi bahwa DNA templat awalnya hanya satu untai ganda. Padahal kenyataannya, hampir tidak mungkin DNA templat awal hanya berupa satu untai ganda. Jika DNA templat awal terdiri atas 20 untai ganda saja, maka jumlah tadi tinggal dikalikan 20 menjadi 20.970.720, suatu jumlah yang sangat cukup bila akan digunakan sebagai fragmen pelacak.
Perancangan Primer Tahapan PCR yang paling menentukan adalah penempelan primer. Sepasang primer oligonukleotida (primer maju dan primer mundur) yang akan dipolimerisasi masing-masing harus menempel pada sekuens target, tepatnya pada kedua ujung fragmen yang akan diamplifikasi. Untuk itu urutan basanya harus komplementer atau setidak-tidaknya memiliki homologi cukup tinggi dengan urutan basa kedua daerah ujung fragmen yang akan diamplifikasi itu. Padahal, kita belum mengetahui dengan pasti urutan basa sekuens target. Oleh karena itu, diperlukan cara tertentu untuk merancang urutan basa kedua primer yang akan digunakan.
20
Dasar yang digunakan adalah urutan basa yang diduga mempunyai kemiripan dengan urutan basa sekuens target. Urutan ini adalah urutan serupa dari sejumlah spesies/strain organisme lainnya yang telah diketahui/dipublikasikan. Sebagai contoh, untuk merancang sepasang primer yang diharapkan dapat mengamplifikasi sebagian gen lipase pada isolat Bacillus termofilik tertentu dapat digunakan informasi urutan basa gen lipase dari strain-strain Pseudomonas fluorescens, P. mendocina , dan sebagainya, yang sebelumnya telah diketahui. Urutan-urutan basa fragmen tertentu dari berbagai strain tersebut kemudian dijajarkan dan dicari satu daerah atau lebih yang memperlihatkan homologi tinggi antara satu strain dan lainnya. Daerah ini dinamakan daerah lestari (conserved area). Sebagian/seluruh urutan basa pada daerah lestari inilah yang akan menjadi urutan basa primer. Sebenarnya, daerah lestari juga dapat ditentukan melalui penjajaran urutan asam amino pada tingkat protein. Urutan asam amino ini kemudian diturunkan ke urutan basa DNA. Dari satu urutan asam amino sangat mungkin akan diperoleh lebih dari satu urutan basa DNA karena setiap asam amino dapat disandi oleh lebih dari satu triplet kodon. Dengan demikian, urutan basa primer yang disusun dapat merupakan kombinasi beberapa kemungkinan. Primer dengan urutan basa semacam ini dinamakan primer degenerate. Selain itu, primer yang disusun melalui penjajaran urutan basa DNA pun dapat merupakan primer degenerate karena urutan basa pada daerah lestari di tingkat DNA pun tidak selamanya memperlihatkan homologi sempurna (100%). Urutan basa pasangan primer yang telah disusun kemudian dianalisis menggunakan program komputer untuk mengetahui kemungkinan terjadinya
21
primer-dimer akibat homologi sendiri (self-homology) atau homologi silang (cross-homology). Selain itu, juga perlu dilihat kemungkinan terjadinya salah tempel (mispriming), yaitu penempelan primer di luar sekuens target. Analisis juga dilakukan untuk mengetahui titik leleh (Tm) masing-masing primer dan kandungan GC-nya. Sepasang primer yang baik harus mempunyai Tm yang relatif sama dengan kandungan GC yang cukup tinggi.
22
BAB XII Sekuensing DNA
Prinsip Sekuensing DNA Molekul DNA rekombinan yang memperlihatkan hasil positif dalam reaksi hibridisasi dengan fragmen pelacak sangat diduga sebagai molekul yang membawa fragmen sisipan atau bahkan gen yang diinginkan. Namun, hal ini masih memerlukan analisis lebih lanjut untuk memastikan bahwa fragmen tersebut benar-benar sesuai dengan tujuan kloning. Analisis antara lain dapat dilakukan atas dasar urutan (sekuens) basa fragmen sisipan. Penentuan urutan (sekuensing) basa DNA pada prinsipnya melibatkan produksi seperangkat molekul/fragmen DNA yang berbeda-beda ukurannya tetapi salah satu ujungnya selalu sama. Selanjutnya, fragmen-fragmen ini
dimigrasikan/dipisahkan menggunakan elektroforesis gel poliakrilamid atau polyacrylamide gel electrophoresis (PAGE) agar pembacaan sekuens dapat dilakukan. Di bawah ini akan diuraikan sekilas dua macam metode sekuensing DNA.
Metode Maxam-Gilbert Metode sekuensing DNA yang pertama dikenal adalah metode kimia yang dikembangkan oleh A.M. Maxam dan W. Gilbert pada tahun 1977. Pada metode ini fragmen-fragmen DNA yang akan disekuens harus dilabeli pada salah satu ujungnya, biasanya menggunakan fosfat radioaktif atau suatu nukleotida pada ujung 3. Metode Maxam-Gilbert dapat diterapkan baik untuk DNA untai ganda
23
maupun DNA untai tunggal dan melibatkan pemotongan basa spesifik yang dilakukan dalam dua tahap. Molekul DNA terlebih dahulu dipotong-potong secara parsial
menggunakan piperidin. Pengaturan masa inkubasi atau konsentrasi piperidin akan menghasilkan fragmen-fragmen DNA yang bermacam-macam ukurannya. Selanjutnya, basa dimodifikasi menggunakan bahan-bahan kimia tertentu. Dimetilsulfat (DMS) akan memetilasi basa G, asam format menyerang A dan G, hidrazin akan menghidrolisis C dan T, tetapi garam yang tinggi akan menghalangi reaksi T sehingga hanya bekerja pada C. Dengan demikian, akan dihasilkan empat macam fragmen, masing-masing dengan ujung G, ujung A atau G, ujung C atau T, dan ujung C. Dari hasil PAGE pada Gambar 13.1 dapat diketahui sekuens fragmen DNA yang dipelajari atas dasar laju migrasi masing-masing pita. Lajur kedua berisi fragmen-fragmen yang salah satu ujungnya adalah A atau G. Untuk memastikannya harus dilihat pita-pita pada lajur pertama. Jika pada lajur kedua terdapat pita-pita yang posisi migrasinya sama dengan posisi migrasi pada lajur pertama, maka dapat dipastikan bahwa pita-pita tersebut merupakan fragmen yang salah satu ujungnya adalah G. Sisanya adalah pita-pita yang merupakan fragmen dengan basa A pada salah satu ujungnya. Cara yang sama dapat kita gunakan untuk memastikan pita-pita pada lajur ketiga, yaitu dengan membandingkannya dengan pita-pita pada lajur keempat. Seperti halnya pada elektroforesis gel agarosa (Bab X), laju migrasi pita menggambarkan ukuran fragmen. Makin kecil ukuran fragmen, makin cepat migrasinya. Dengan demikian, ukuran fragmen pada contoh tersebut di atas dapat
24
diurutkan atas dasar laju/posisi migrasinya. Jadi, kalau diurutkan dari yang terkecil hingga yang terbesar, hasilnya adalah fragmen-fragmen dengan ujung TTGCCCCGCGTGGCGCAAAGG. dipelajari. Inilah sekuens fragmen DNA yang
Metode Sanger Dewasa ini metode sekuensing Maxam-Gilbert sudah sangat jarang digunakan karena ada metode lain yang jauh lebih praktis, yaitu metode dideoksi yang dikembangkan oleh A. Sanger dan kawan-kawan pada tahun 1977 juga. Metode Sanger pada dasarnya memanfaatkan dua sifat salah satu subunit enzim DNA polimerase yang disebut fragmen klenow. Kedua sifat tersebut adalah kemampuannya untuk menyintesis DNA dengan adanya dNTP dan
ketidakmampuannya untuk membedakan dNTP dengan ddNTP. Jika molekul dNTP hanya kehilangan gugus hidroksil (OH) pada atom C nomor 2 gula pentosa, molekul ddNTP atau dideoksi nukleotida juga mengalami kehilangan gugus OH pada atom C nomor 3 sehingga tidak dapat membentuk ikatan fosfodiester. Artinya, jika ddNTP disambungkan oleh fragmen klenow dengan suatu molekul DNA, maka polimerisasi lebih lanjut tidak akan terjadi atau terhenti. Basa yang terdapat pada ujung molekul DNA ini dengan sendirinya adalah basa yang dibawa oleh molekul ddNTP. Dengan dasar pemikiran itu sekuensing DNA menggunakan metode dideoksi dilakukan pada empat reaksi yang terpisah. Keempat reaksi ini berisi dNTP sehingga polimerisasi DNA dapat berlangsung. Namun, pada masingmasing reaksi juga ditambahkan sedikit ddNTP sehingga kadang-kadang
25
polimerisasi akan terhenti di tempat -tempat tertentu sesuai dengan ddNTP yang ditambahkan. Jadi, di dalam tiap reaksi akan dihasilkan sejumlah fragmen DNA yang ukurannya bervariasi tetapi ujung 3nya selalu berakhir dengan basa yang sama. Sebagai contoh, dalam reaksi yang mengandung ddATP akan diperoleh fragmen-fragmen DNA dengan berbagai ukuran yang semuanya mempunyai basa A pada ujung 3nya. Pada Gambar 13.2 diberikan sebuah contoh sekuensing sebuah fragmen DNA. Tabung ddATP menghasilkan dua fragmen dengan ukuran tiga dan tujuh basa; tabung ddCTP menghasilkan tiga fragmen dengan ukuran satu, dua, dan empat basa; tabung ddGTP menghasilkan dua fragmen dengan ukuran lima dan sembilan basa; tabung ddTTP menghasilkan dua fragmen dengan ukuran enam dan delapan basa. Di depan (arah 5) tiap fragmen ini sebenarnya terdapat primer, yang berfungsi sebagai prekursor reaksi polimerisasi sekaligus untuk kontrol hasil sekuensing karena urutan basa primer telah diketahui. Untuk melihat ukuran fragmen-fragmen hasil sekuensing tersebut dilakukan elektroforesis menggunakan gel poliakrilamid sehingga akan terjadi perbedaan migrasi sesuai dengan ukurannya masing-masing. Setelah ukurannya diketahui, dilakukan pengurutan fragmen mulai dari yang paling pendek hingga yang paling panjang, yaitu fragmen dengan ujung C (satu basa) hingga fragmen dengan ujung G (sembilan basa). Dengan demikian, hasil sekuensing yang diperoleh adalah CCACGTATG. Urutan basa DNA yang dicari adalah urutan yang komplementer dengan hasil sekuensing ini, yaitu GGTGCATAC.
26
Pangkalan Data Sekuens DNA Selama bertahun-tahun telah banyak sekuens DNA yang ditentukan oleh para ilmuwan di seluruh dunia, dan saat ini kebanyakan jurnal ilmiah mempersyaratkan penyerahan sekuens DNA terlebih dahulu untuk keperluan pangkalan data publik sebelum mereka menerima naskah selengkapnya dari para penulis/ilmuwan. Pengelola pangkalan data akan saling bertukar informasi tentang sekuens-sekuens yang terkumpul dan menyediakannya untuk akses publik sehingga semua pangkalan data yang ada akan menjadi nara sumber yang sangat bermanfaat. Sekuens-sekuens baru terus bertambah dengan kecepatan yang kian meningkat. Begitu pula, sejumlah perangkat lunak komputer diperlukan agar data yang tersedia dapat dimanfaatkan dengan lebih baik. EMBL di Eropa dan GenBank di Amerika Serikat merupakan dua pangkalan data sekuens DNA terbesar di dunia. Selain sekuens DNA, mereka juga mengelola data sekuens RNA dan protein. Sementara itu, beberapa perusahaan mempunyai pangkalan data sekuens DNA sendiri. Ketika sekuens suatu fragmen DNA telah diketahui, hanya ada sedikit sekali gambaran yang dapat diperoleh dari sekuens tersebut. Analisis sekuens perlu dilakukan untuk mengetahui beberapa karakteristik pentingnya seperti peta restriksi, rangka baca, kodon awal dan kodon akhir, atau kemungkinan tempat promoternya. Di samping itu, perlu juga dipelajari hubungan kekerabatan suatu sekuens baru dengan beberapa sekuens lainnya yang telah terlebih dahulu diketahui. Biasanya, analisis semacam itu dilakukan menggunakan paket-paket perangkat lunak, misalnya paket GCG Universitas Wisconsin dan DNAstar.
27
Proyek-proyek Sekuensing Genom Sejalan dengan berkembangnya mesin-mesin sekuensing DNA automatis (automatic DNA sequencer), sejumlah organisasi telah memberikan perhatian dan dukungan dana bagi penentuan sekuens genom berbagai spesies organisme penting. Beberapa genom yang ukurannya sangat kecil seperti genom virus HIV dan fag telah disekuens seluruhnya. Genom sejumlah bakteri, misalnya E. coli (4,6 x 106 pb), dan khamir Saccharomyces cerevisiae (2,3 x 107 pb) juga telah selesai disekuens. Sementara itu, proyek sekuensing genom tanaman Arabidopsis thaliana (6,4 x 107 pb) dan nematoda Caenorhabditis elegans saat ini masih berlangsung. Proyek Genom Manusia (Human Genom Project), yang diluncurkan pada tahun 1990 dan sebenarnya diharapkan selesai pada tahun 2005, ternyata berakhir dua tahun lebih cepat daripada jadwal yang telah ditentukan. Pada genom manusia dan genom-genom lain yang berukuran besar biasanya dilakukan pemetaan kromosom terlebih dahulu untuk mengetahui lokuslokus gen pada tiap kromosom. Selanjutnya, perpustakaan gen untuk suatu kromosom dikonstruksi menggunakan vektor YACs (lihat Bab XI) dan klon-klon YACs yang saling tumpang tindih diisolasi hingga panjang total kromosom tersebut akan tercakup. Demikian seterusnya untuk kromosom-kromosom yang lain hingga akhirnya akan diperoleh sekuens genom total yang sambungmenyambung dari satu kromosom ke kromosom berikutnya.
28
Anda mungkin juga menyukai
- Rekayasa Genetika. ResumeDokumen12 halamanRekayasa Genetika. ResumeBinazir Tuza Qiyah Ma'rufahBelum ada peringkat
- Konsensus IBDDokumen42 halamanKonsensus IBDNurul Hidayati SY33% (3)
- Dasar-Dasar Teknologi DNA RekombinanDokumen11 halamanDasar-Dasar Teknologi DNA RekombinanAgil Cendoll AnggaraBelum ada peringkat
- DNA Rekombinan Dan Vektor KloningDokumen21 halamanDNA Rekombinan Dan Vektor KloningHadianti NurfitriBelum ada peringkat
- DNA Rekombinan TeknologiDokumen12 halamanDNA Rekombinan TeknologiSulis IndriantoBelum ada peringkat
- Teknologi Dna RekombinanDokumen12 halamanTeknologi Dna RekombinanArif Sardi100% (1)
- Pengertian Teknologi DNA RekombinanDokumen5 halamanPengertian Teknologi DNA RekombinanNella100% (1)
- Rekayasa Genetik Dalam Bidang PanganDokumen24 halamanRekayasa Genetik Dalam Bidang PanganAfida Tul Hasanah100% (1)
- SELEKSI TRANSFORMAN DAN REKOMBINANDokumen6 halamanSELEKSI TRANSFORMAN DAN REKOMBINANsizukhaaBelum ada peringkat
- BIOTEKNOLOGI VETERINERDokumen15 halamanBIOTEKNOLOGI VETERINERAgdilaBelum ada peringkat
- DNA Rekombinan MekanismeDokumen6 halamanDNA Rekombinan MekanismeWijayaBelum ada peringkat
- DNA REKOMDokumen14 halamanDNA REKOMRos MeliaBelum ada peringkat
- Rekayasa GenetikDokumen8 halamanRekayasa GenetikkenBelum ada peringkat
- Makalah Biotek Kelompok 1Dokumen26 halamanMakalah Biotek Kelompok 1Eria MarinaBelum ada peringkat
- Resume Pemotongan Dna Dan Penggabungan Dna DG VektorDokumen12 halamanResume Pemotongan Dna Dan Penggabungan Dna DG VektorZulifa FadillaBelum ada peringkat
- DNA Rekombinan TeknologiDokumen7 halamanDNA Rekombinan TeknologiDwii RettnoBelum ada peringkat
- Fix Kelompok 4 Dna RekombinanDokumen27 halamanFix Kelompok 4 Dna RekombinanLondoBelum ada peringkat
- DNA RekombinanDokumen4 halamanDNA RekombinanSulis IndriantoBelum ada peringkat
- ElektroforesisDokumen14 halamanElektroforesisNorma RizkiananingrumBelum ada peringkat
- Bioteknologi InsulinDokumen21 halamanBioteknologi InsulindwiastariniBelum ada peringkat
- Dna RekombinasiDokumen20 halamanDna RekombinasiSatria NugrahaBelum ada peringkat
- Rekayasa GenetikaDokumen8 halamanRekayasa GenetikaDewa Ayu SwaratriBelum ada peringkat
- Kloning GenDokumen45 halamanKloning GenNafilah HusainiyahBelum ada peringkat
- B - Fitria Rahmadani Niati - 431419013Dokumen24 halamanB - Fitria Rahmadani Niati - 431419013shugiyanti slametBelum ada peringkat
- REKAYASA GENETIKADokumen9 halamanREKAYASA GENETIKAIka Airin Nur RohmadhaniBelum ada peringkat
- DNA Rekombinan dan Seleksi Biru PutihDokumen11 halamanDNA Rekombinan dan Seleksi Biru PutihBryan PramanaBelum ada peringkat
- Kloning GenDokumen8 halamanKloning GenMulyawatiBelum ada peringkat
- Dna RekombinasiDokumen20 halamanDna RekombinasiAnggie WindrianiBelum ada peringkat
- DNA REKAYASADokumen32 halamanDNA REKAYASAanak tanahBelum ada peringkat
- Kloning Tahapan MolekulerDokumen8 halamanKloning Tahapan MolekulerRima ElfitaBelum ada peringkat
- Kloning Gen Dan Rekombinasi DNA...Dokumen45 halamanKloning Gen Dan Rekombinasi DNA...Noerman YusufBelum ada peringkat
- Kloning GenDokumen10 halamanKloning GenMaulinaBelum ada peringkat
- Enzim RestriksiDokumen32 halamanEnzim RestriksiDilan 1991Belum ada peringkat
- Makalah DNA Rekombinan 2Dokumen27 halamanMakalah DNA Rekombinan 2Ridwan NurdinBelum ada peringkat
- Rekayasa GenetikaDokumen11 halamanRekayasa GenetikafitriaBelum ada peringkat
- Pengertian Rekombinasi DNADokumen28 halamanPengertian Rekombinasi DNAKenny BawolehBelum ada peringkat
- LECT-11 Gene Manipulation - En.idDokumen31 halamanLECT-11 Gene Manipulation - En.idIkrimah FithriyandiniBelum ada peringkat
- BiomolekulerDokumen12 halamanBiomolekulerAriee Line-roosevelt100% (1)
- 4 - Metode Rekayasa Genetika Dan MolekulerDokumen22 halaman4 - Metode Rekayasa Genetika Dan MolekulerAmana MarlianaBelum ada peringkat
- Contoh Makalah KloningDokumen7 halamanContoh Makalah Kloningcinta sari100% (1)
- Makalah PBL Blok 3Dokumen7 halamanMakalah PBL Blok 3dwikartikahBelum ada peringkat
- Rekayasa GenetikDokumen5 halamanRekayasa GenetikMeeyghaa ThayhaankksZaiinyiikwuBelum ada peringkat
- Isolasi DNADokumen9 halamanIsolasi DNAapkemBelum ada peringkat
- Blok 7 Modul 3 Teknologi Rekombinan DNADokumen13 halamanBlok 7 Modul 3 Teknologi Rekombinan DNAputriBelum ada peringkat
- Manfaat Rekayasa GenetikaDokumen23 halamanManfaat Rekayasa Genetikadedi santaBelum ada peringkat
- Paper Kelompok 1Dokumen7 halamanPaper Kelompok 1Rina NatasiaBelum ada peringkat
- Nurul Hilmiyah T20188060 Bio 2 Remidi Uts BioteknologiDokumen4 halamanNurul Hilmiyah T20188060 Bio 2 Remidi Uts BioteknologiNurul HilmiyahBelum ada peringkat
- Transformasi DNADokumen17 halamanTransformasi DNAfebrin100% (1)
- Ekstraksi DNADokumen3 halamanEkstraksi DNAGaluh Prapita SariBelum ada peringkat
- Kel 2ac - Protein Rekombinan (Makalah)Dokumen63 halamanKel 2ac - Protein Rekombinan (Makalah)Geraldi Cool50% (2)
- RFLP Analisis DNADokumen13 halamanRFLP Analisis DNAJenry Reyes Trispa100% (1)
- Peranan Dna Dalam TeknologiDokumen20 halamanPeranan Dna Dalam TeknologimiftaBelum ada peringkat
- PEMETAAN DNA PLASMIDDokumen14 halamanPEMETAAN DNA PLASMIDArmydha IgaBelum ada peringkat
- Kloning 5Dokumen7 halamanKloning 5purfaji.ftiBelum ada peringkat
- Genetika Klmpok 5 Rekayasa GenetikDokumen9 halamanGenetika Klmpok 5 Rekayasa GenetikGlorya WullurBelum ada peringkat
- Mikrobiologi Medis I: Patogen dan Mikrobioma ManusiaDari EverandMikrobiologi Medis I: Patogen dan Mikrobioma ManusiaPenilaian: 4 dari 5 bintang4/5 (11)
- Mikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaDari EverandMikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaPenilaian: 2.5 dari 5 bintang2.5/5 (2)
- KODE ETIK TERBARUDokumen80 halamanKODE ETIK TERBARUMuthia Fydiah JayantiBelum ada peringkat
- RAPID39Dokumen2 halamanRAPID39Erikha ChairilBelum ada peringkat
- Bab IiiDokumen1 halamanBab IiiErikha ChairilBelum ada peringkat
- Juknis DPU FinalDokumen35 halamanJuknis DPU FinalSoehalino GazaliBelum ada peringkat
- Cara Pelepasan APD Swab COVID-19Dokumen2 halamanCara Pelepasan APD Swab COVID-19Erikha ChairilBelum ada peringkat
- Permenkes 21 Tahun 2016Dokumen20 halamanPermenkes 21 Tahun 2016PUSKESMAS PEKKAE100% (4)
- Laporan Hasil Kegiatan PelatihanDokumen5 halamanLaporan Hasil Kegiatan PelatihanErikha ChairilBelum ada peringkat
- SOP Syok AnafilaktikDokumen3 halamanSOP Syok AnafilaktikErikha ChairilBelum ada peringkat
- APD Swab COVIDDokumen2 halamanAPD Swab COVIDErikha ChairilBelum ada peringkat
- Master Roll Banner Alur Pelayanan 60cm X 160cmDokumen1 halamanMaster Roll Banner Alur Pelayanan 60cm X 160cmpkrs rsud slemanBelum ada peringkat
- Bab IDokumen1 halamanBab IErikha ChairilBelum ada peringkat
- Bab IiDokumen3 halamanBab IiErikha ChairilBelum ada peringkat
- Materi Inst Keb 29 Agustus Jabar Lauren PDFDokumen7 halamanMateri Inst Keb 29 Agustus Jabar Lauren PDFErikha ChairilBelum ada peringkat
- Cara Pelepasan APD Swab COVID-19Dokumen2 halamanCara Pelepasan APD Swab COVID-19Erikha ChairilBelum ada peringkat
- Format DDSTDokumen1 halamanFormat DDSTArsya WinaBelum ada peringkat
- Laporan Akhir KKN DewiDokumen20 halamanLaporan Akhir KKN DewiErikha ChairilBelum ada peringkat
- Dokumen - Tips Kolitis-UlseratifDokumen35 halamanDokumen - Tips Kolitis-UlseratifErikha ChairilBelum ada peringkat
- Halaman Pengesahan DibaDokumen1 halamanHalaman Pengesahan DibaErikha ChairilBelum ada peringkat
- Laporan KKN DibaDokumen45 halamanLaporan KKN DibaErikha ChairilBelum ada peringkat
- GhtyDokumen26 halamanGhtymeliani.fitriBelum ada peringkat
- Laporan KKN KojepDokumen41 halamanLaporan KKN KojepErikha Chairil0% (1)
- 2 Kata PengantarDokumen1 halaman2 Kata PengantarErikha ChairilBelum ada peringkat
- Kode Etik KedokteranDokumen10 halamanKode Etik KedokteranErikha ChairilBelum ada peringkat
- Leaflet DBDDokumen2 halamanLeaflet DBDErikha ChairilBelum ada peringkat
- 3 Daftar IsiDokumen1 halaman3 Daftar IsiErikha ChairilBelum ada peringkat
- Borang Portofolio TB WindaDokumen25 halamanBorang Portofolio TB WindaErikha ChairilBelum ada peringkat
- Leaflet SkabiesDokumen2 halamanLeaflet SkabiesMelisha L. GayaBelum ada peringkat
- 4 Bab 1Dokumen11 halaman4 Bab 1Erikha ChairilBelum ada peringkat
- 2 Kata PengantarDokumen1 halaman2 Kata PengantarErikha ChairilBelum ada peringkat