ELEKTROKIMIA
Diunggah oleh
Imelda GustiaDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
ELEKTROKIMIA
Diunggah oleh
Imelda GustiaHak Cipta:
Format Tersedia
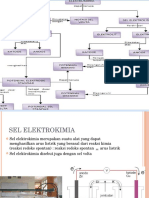
ELEKTROKIMIA Dalam reaksi redoks yang sudah dipelajari terjadi transfer elektron, yakni adanya elektron yang dilepaskan
dan ada elektron yang diterima. Energi yang dilepaskan dari reaksi redoks dapat diubah menjadi energi listrik yang digambarkan dengan sel volta atau sel galvani. Sel Volta Agar dapat menghasilkan arus listrik maka kita dapat memanfaatkan perpindahan elektron dengan cara membuat setengah reaksi oksidasi dan reduksi yang terjadi dibagian sel galvanik seperti pada gambar Pada gambar tersebut batang seng dan tembaga dinamakan elektroda. Logam ink dicelupkan ke dalam larutan yang mengandung ion !n dan logam "u dicelupkan kedalam larutan yang mengandung ion "u. untuk melihat prosesnya anda bisa buka animasi pada link berikut
sel daniel.swf
Gambar sel volta Logam ink larut melepas dua elektron !n#s$ % !n&'
#a($
'& e). Elektron yang dilepaskan mengalir melalui
ka*at penghantar. Dan ion "u&' akan mengambil elektron dari logam tembaga, kemudian mengendap. "u&'#a($ '&e) % "u#s$
Pada sel volta tersebut !n bertindak sebagai anoda karena mengalami reaksi .......... +edangkan "u&' bertindak sebagai katoda karena mengalami reaksi ............ ,edua larutan tersebut dipisahkan dan dihubungkan dengan jembatan garam. -embatan garam adalah alat yang digunakan untuk menghubungkan reaksi reduksi dan oksidasi setengah sel dari sel volta yang berfungsi untuk menyeimbangkan muatan. -embatan garam berbentuk seperti huruf . terbalik yang diisi dengan larutan elektrolit ,"l dan /01/23, yang ionnya tidak akan bereaksi dengan ion lain dalam larutan atau elektroda. -ika pada rangkaian tersebut diletakkan suatu bohlam, maka arus listrik yang mengalir akan mengakibatkan bohlam menyala. Arus listrik akan mengalir dari ........... ke ............. 4agaimana prosesnya agar reaksi redoks berubah menjadi energi listrik5 6enyalanya lampu bohlam disebabkan karena perpindahan elektron secara langsung dihindari sehingga aliran elektron mengalir melalui rangkaian luar yang melalui
ka*at dapat menyalakan bohlam. +ehingga pada sel volta arus listrik yang dihasilkan berasal dari reaksi kimia yang berupa reaksi redoks spontan yang terjadi pada anoda dan katoda. -ika ink dan ion tembaga langsung direaksikan maka elektron berpindah dari logam !n ke "u&'. Larutan "u+21 yang ber*arna biru juga memudar apabila larutannya bereaksi, dimana terbentuk !n&' yang berasal dari batang seng. +elama terjadi reaksi di permukaan seng, tidak diperoleh adanya arus elektron. Dalam reaksi tersebut ion "u&' akan bereaksi langsung dengan batang. sehingga tidak ada kerja listrik yang diperoleh. 7eaksi yang terjadi adalah "u&'#a($ ' !n#s$ % "u#s$ ' !n&'#a($ . +el volta memiliki kemampuan untuk mendorong elektron melalui rangkaian luar yang disebut beda potensial #gaya elektromotif8emf$. Perbedaan energi potensial per muatan listrik #beda potensial$ antara dua elektroda diukur dalam satuan volt. -ika konsentrasi dari ion !n&' dan "u masing)masing 9 6. -ika rangkaian sel volta dihubungkan dengan sebuah alat yakni voltmeter maka arus yang terukur pada voltmeter ialah 9.9: ;. <ang terukur adalah beda potensial dari kedua elektroda #dalam suatu sel$ atau disebut dengan potensial sel standar E=sel. Lambang = menunjukkan kondisi standar. -ika yang terukur pada voltmeter adalah beda potensial antara kedua elektroda. Dapatkah kita mengukur potensial masing)masing elektroda5 Potensial elektroda tidak dapat diukur, untuk itu perlu suatu elektroda sebagai pembanding. 2leh karena itu dipilih elektroda hidrogen standar #+0E > Standard Hydrogen Electrode$. ,arena +0E memiliki potensial standar reduksi sebesar nol #E?red +0E > :$ jikadiukur pada keadaan standar #tekanan gas 0 & sebesar 9 atm, konsentrasi larutan ion 0 ' sebesar 9 6, dan pengukuran dilakukan pada suhu &@?"$. & 0' #9 6$ ' & e) % 0& #9 atm$ E?red > : ;
+0E dapat digunakan untuk menentukan besarnya potensial standar reduksi #E?red$ elektroda lainnya. Potensial sel adalah perbedaan antara dua potensial elektroda untuk menentukan Esel. 4erdasarkan konvensi, emf standar dari E=sel, yang terdiri atas kontribusi dari anoda dan kontribusi dari katoda, dinyatakan sebagai E=sel > E=katoda ) E=anoda +ebagai contoh untuk mengetahui potensial dari suatu elektroda dari tembaga maka dipasangkan dengan elektroda hidrogen standar #Standard Hydrogen Electrode$. Dalam hal ini, elektrode tembaga bertindak sebagai katoda. 7eaksinya sebagai berikut "u&' #a($ ' & e) % "u #s$ 0& #g$ % & 0' #a($ ' & e) +ehingga 0&#s$A0'#96$ AA "u&' #96$A"u#s$ Pada kondisi standar dan pada &@=", potensialnya adalah :,31 ;, sehingga E=sel > E=katoda ) E=anoda :,31 ; > E="u&'8"u ) E=0'80& > E="u&'8"u ) : +ehingga potensial reduksi standar untuk tembaga adalah ':,31 ;. +ebagai contoh jika diketahui & elektrode sebagai berikut. 0itunglah potensial selnya &Ag'#a($ ' &e % &Ag#s$ "u&' #a($ ' & e) % "u #s$ +ehingga ,atode adalah elektroda yang memiliki potensial reduksi lebih positif yakni .......... dan anodanya adalah......... 6aka kita dapat menghitung potensial selnya sebagai berikut 7eduksi 2ksidasi 7eaksi sel C C C &Ag'#a($ ' &e % &Ag#s$ "u #s$ % "u&' #a($ ' & e) &Ag' #a($ ' "u #s$ % &Ag #s$ ' "u&' #a($ E? > ':,B: ; E? > ) :,31 ; E? > ':,B: ; E? > ':,31 ; #katode$ #anode$
dengan menggunakan rumus berikut C E=sel > E=katoda ) E=anoda E=sel > .......... ) .......... > ...... ; D ..... ; E=sel > .............;
-ika harga potensial sel standar yang dimiliki adalah positif maka reaksinya berlangsung spontan.
Anda mungkin juga menyukai
- Pesawat TerbangDokumen134 halamanPesawat TerbangFaza Zulianto100% (1)
- Elektrogravimetri MilaDokumen13 halamanElektrogravimetri MilaAprimaRezaBelum ada peringkat
- Makalah ElektrokimiaDokumen20 halamanMakalah Elektrokimiaseptya_193534235100% (9)
- 20090904001255-Kelas3 Ipa Dianapuspita (1) DinamisDokumen14 halaman20090904001255-Kelas3 Ipa Dianapuspita (1) DinamisDanil IrawanBelum ada peringkat
- ELEKTROKIMIADokumen13 halamanELEKTROKIMIARio SaputraBelum ada peringkat
- Bahan LTM ElektrokimiaDokumen23 halamanBahan LTM ElektrokimiaFhani MelianaBelum ada peringkat
- ElektrokimiaDokumen13 halamanElektrokimiaCita Purnama SittaBelum ada peringkat
- SELEKTROKIMIADokumen5 halamanSELEKTROKIMIAdewisetiyaningrumBelum ada peringkat
- LKS Sel Volta & Potensial SelDokumen11 halamanLKS Sel Volta & Potensial SelDevinta WidiatinBelum ada peringkat
- VOLTA DAN ELEKTROLISISDokumen10 halamanVOLTA DAN ELEKTROLISISIyemSulistia100% (1)
- Sel ElektrokimiaDokumen11 halamanSel ElektrokimiaRizky AzizahBelum ada peringkat
- Sel ElektrolisisDokumen15 halamanSel ElektrolisisMarganingtyas Wicaksanti0% (1)
- K.An - Instrumen I-IIDokumen30 halamanK.An - Instrumen I-IIcollong100% (2)
- Bahan Ajar Sel Volta 2Dokumen6 halamanBahan Ajar Sel Volta 2putry ayuningtyasBelum ada peringkat
- Potensial DekomposisiDokumen6 halamanPotensial DekomposisiHanna DiniaBelum ada peringkat
- ELEKTROKIMIADokumen20 halamanELEKTROKIMIAAzizah AzizahBelum ada peringkat
- Elektrolisis ProsesDokumen19 halamanElektrolisis ProsesRemy RockBelum ada peringkat
- Kimia Sel Volta-1Dokumen8 halamanKimia Sel Volta-1Aji AbadiBelum ada peringkat
- Elektro GravimetriDokumen14 halamanElektro GravimetriAgustina HasugianBelum ada peringkat
- Elektrokimia 2007Dokumen23 halamanElektrokimia 2007Mirawati EfendiBelum ada peringkat
- Sel ElektrokimiaDokumen5 halamanSel ElektrokimiaFadil_MHFBelum ada peringkat
- 4 ElektrolisisDokumen20 halaman4 ElektrolisisSherlyBelum ada peringkat
- ELEKTROKIMIA RESUMEDokumen9 halamanELEKTROKIMIA RESUMEReVengeR 178 PBGIBelum ada peringkat
- SENI FAJRINA A (XI APL 1) IntrumentDokumen4 halamanSENI FAJRINA A (XI APL 1) IntrumentSENI FAJRINA APRILLIABelum ada peringkat
- Laporan Resmi Korosi Deret GalvaniDokumen11 halamanLaporan Resmi Korosi Deret GalvaniIka IslamirrBelum ada peringkat
- Makalah Sel VoltaDokumen6 halamanMakalah Sel VoltaAlit Supriyana Putra100% (1)
- AnggaDokumen30 halamanAnggaSatria AtmajaBelum ada peringkat
- ELEKTROKIMIA] Elektrokimia dan Prinsip Kerja Sel VoltaDokumen3 halamanELEKTROKIMIA] Elektrokimia dan Prinsip Kerja Sel VoltaImtikhana KhofifahBelum ada peringkat
- Makalah ElektrokimiaDokumen26 halamanMakalah ElektrokimiaFaradisa AninditaBelum ada peringkat
- ELEKTROLISIS PENGERTIAN DAN KEGUNAANNYADokumen25 halamanELEKTROLISIS PENGERTIAN DAN KEGUNAANNYArika umamiBelum ada peringkat
- Reaksi Redoks Dan ElektrokimiaDokumen19 halamanReaksi Redoks Dan ElektrokimiaErwin Nur CahyantoBelum ada peringkat
- Sel Elektrokimia & Potensial SelDokumen39 halamanSel Elektrokimia & Potensial SelLulu ChaeraBelum ada peringkat
- Laporan Voltameter TembagaDokumen20 halamanLaporan Voltameter TembagaSari Ully SibaraniBelum ada peringkat
- SEL ELEKTROKIMIADokumen4 halamanSEL ELEKTROKIMIAnirwanapro100% (1)
- GGL RedoksDokumen5 halamanGGL RedoksElisa SumbayakBelum ada peringkat
- SELEKTRIKDokumen9 halamanSELEKTRIKAhmad MaulaniBelum ada peringkat
- Kimia Sel VoltaDokumen7 halamanKimia Sel VoltaDavina TazkiaBelum ada peringkat
- Makalah Sel VoltaDokumen6 halamanMakalah Sel VoltaBayti NurulBelum ada peringkat
- Makalah Sel ElektrokimiaDokumen13 halamanMakalah Sel ElektrokimiaUmisabariyahBelum ada peringkat
- ElektrokimiaDokumen24 halamanElektrokimiaAbdi IzayBelum ada peringkat
- Sel ElektrokimiaDokumen27 halamanSel ElektrokimiapandeBelum ada peringkat
- Bahan AjarDokumen6 halamanBahan Ajaruhkty fauzyahBelum ada peringkat
- Sel Volta (Sel Galvani)Dokumen7 halamanSel Volta (Sel Galvani)Andiana Kanendyah PutriBelum ada peringkat
- ELEKTROLISIS DAN ANALISIS KIMIADokumen12 halamanELEKTROLISIS DAN ANALISIS KIMIA-Manuel A Luakusa-Belum ada peringkat
- POTENSIAL ELEKTRODA DAN POTENSIAL SELDokumen4 halamanPOTENSIAL ELEKTRODA DAN POTENSIAL SELNadia NovitaBelum ada peringkat
- Sel ElektrokimiaDokumen22 halamanSel ElektrokimiaEka TinaBelum ada peringkat
- W06.mixed PotentialDokumen31 halamanW06.mixed Potentialpopular102001Belum ada peringkat
- Laporan Percobaan Sel VoltaDokumen9 halamanLaporan Percobaan Sel VoltaNilna Jauharotul KameliaBelum ada peringkat
- Voltameter TembagaDokumen16 halamanVoltameter TembagarifkywijayaBelum ada peringkat
- ELEKTROKIMIADokumen16 halamanELEKTROKIMIANuril 016Belum ada peringkat
- SemikonduktorDokumen20 halamanSemikonduktorJedha YantiBelum ada peringkat
- Sel ElektrokimiaDokumen4 halamanSel ElektrokimiaChristine IkaBelum ada peringkat
- DETEKSI RADIASIDokumen15 halamanDETEKSI RADIASIVhatica24Belum ada peringkat
- Makalah Sel ElektrolisisDokumen13 halamanMakalah Sel ElektrolisisDiah Mega100% (1)
- Laporan Praktikum Sel Volta Dan ElektrolisisDokumen10 halamanLaporan Praktikum Sel Volta Dan Elektrolisisulumimaf100% (1)
- Fisika Arus ListrikDokumen12 halamanFisika Arus ListrikAaqilatul Mumtaazah HafiluddinBelum ada peringkat
- Telaah Hasil Tes ImeldaDokumen16 halamanTelaah Hasil Tes ImeldaImelda GustiaBelum ada peringkat
- Petunjuk PembelajaranDokumen1 halamanPetunjuk PembelajaranImelda GustiaBelum ada peringkat
- Satuan Acuan PerkuliahanDokumen3 halamanSatuan Acuan PerkuliahanImelda GustiaBelum ada peringkat
- Prinsip Pendekatan Metode Teknikstrategi Dan Model PembelajaranDokumen25 halamanPrinsip Pendekatan Metode Teknikstrategi Dan Model PembelajaranImelda GustiaBelum ada peringkat
- ELEKTROKIMIADokumen4 halamanELEKTROKIMIAImelda GustiaBelum ada peringkat
- 117-128 PTJJ 11 (2) 2010 Benny, Pendekatan KonstruktivistikDokumen12 halaman117-128 PTJJ 11 (2) 2010 Benny, Pendekatan KonstruktivistikImelda GustiaBelum ada peringkat
- 1 Kumpul Abstrak TEP S3 2Dokumen14 halaman1 Kumpul Abstrak TEP S3 2Imelda GustiaBelum ada peringkat
- KesetimbanganDokumen2 halamanKesetimbanganImelda GustiaBelum ada peringkat
- Gas MuliaDokumen10 halamanGas Muliamujib_santosoBelum ada peringkat
- Penerapan Pembelajaran Kontekstual Pada Materi Pokok Pemisahan CampuranDokumen7 halamanPenerapan Pembelajaran Kontekstual Pada Materi Pokok Pemisahan CampuranImelda GustiaBelum ada peringkat
- Banyak Reaksi Penataan Ulang Melibatkan Perpindahan Suatu Atom Atau Gugus Dari Satu Atom Ke LainnyaDokumen4 halamanBanyak Reaksi Penataan Ulang Melibatkan Perpindahan Suatu Atom Atau Gugus Dari Satu Atom Ke LainnyaImelda GustiaBelum ada peringkat
- Reaksi Penataan UlangDokumen6 halamanReaksi Penataan UlangImelda GustiaBelum ada peringkat
- Sandiwara Cinta - RepublikDokumen1 halamanSandiwara Cinta - RepublikImelda GustiaBelum ada peringkat
- Cara Menghapus Item Right Click Menu Pada Desktop Windows 7Dokumen3 halamanCara Menghapus Item Right Click Menu Pada Desktop Windows 7Imelda GustiaBelum ada peringkat



























![ELEKTROKIMIA] Elektrokimia dan Prinsip Kerja Sel Volta](https://imgv2-1-f.scribdassets.com/img/document/434342379/149x198/36f353acb7/1573444488?v=1)