Termokimia
Diunggah oleh
Zoria JuJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Termokimia
Diunggah oleh
Zoria JuHak Cipta:
Format Tersedia
TERMOKIMIA Perubahan tenaga (E) dlm t/b kimia 1.
Menurut Hukum Keabadian Tenaga, tenaga tidak boleh dicipta atau dimusnahkan. Ia hanya boleh ditukarkan drpd satu bentuk ke satu bentuk yg lain. Contohnya, tenaga kimia tenaga haba 2. t/b eksotermik t/b yg membebaskan tenaga haba ke persekitaran 3. t/b endotermik t/b yg melibatkan penyerapan tenaga haba dr persekitaran
4. Jadual menunjukkan perbezaan antara tindak balas eksotermik & tindak balas endotermik: CIRI-CIRI 1.Tenaga haba 2.Suhu termometer 3.Penukaran btk tenaga 4.Ikatan 5.Tenaga dalaman tenaga kimia tenaga haba Ikt terbtk
E
EKSOTERMIK Dibebaskan ke persekitaran
ENDOTERMIK Diserap dr persekitaran
tenaga haba tenaga kimia Ikt pecah
E
6.Contoh t/b
- larut asid / alkali pekat dm air - pembakaran bhn api - pengaratan besi - t/b asid dgn logam - t/b peneutralan - proses Haber - proses Sentuh - larut asid / alkali pekat dm air - pembakaran bhn api - pengaratan besi - t/b asid dgn logam - t/b peneutralan
6.Contoh t/b
- larut garam dlm air - penguraian haba garam karbonat / nitrat - t/b asid dgn NaHCO3 & KHCO3 - fotosintesis - larut garam dlm air - penguraian haba garam karbonat / nitrat - t/b asid dgn
- proses Haber - proses Sentuh
NaHCO3 & KHCO3 - fotosintesis
Zarahzarah bhn t/b
Eksotermik
Larutan dlm bikar = Endotermik persekitaran
5. Tenaga (E) kebolehan melakukan kerja - diukur dlm unit Joule (J) 6. Entalpi (H) kandungan tenaga mutlak sst bahan - dpt ditentukan 7. Perubahan entalpi perubahan kandungan tenaga a/p ( H) t/b berlaku - unit KJ mol-1 - nilai ve bagi t/b ekso & +ve bagi t/b endo - Hhasil t/b Hbahan t/b Pengiraan Perubahan Entalpi, H 1. H diukur dlm unit KJ mol-1 2. H = mc m = jisim air (kecuali penghitungan haba pembakaran, m= jisim bhn api) c = muatan haba tentu , cair = 4.18 J g-1 C
-1
= perubahan suhu , T = suhu akhir suhu awal 3. Gambarajah aras tenaga menunjukkan aras tenaga bhn t/b dgn hasil t/b
E
H1 bhn t/b
Eksotermik H = -ve
H2 hasil t/b
E
H = H2 H1
H2 hasil t/ b H = +ve Endotermik
H1 bhn t/b * gambarajah aras tenaga gambarajah profil tenaga (Ea) 4. H1 = haba t/b H2 = haba diserap a/p ikt dipecah (+ve) H3 = haba dibebas a/p ikt dibtk (-ve) H1 = H2 + H3 Maka, jika H2 < H3, H1 ve (ekso) H2 > H3, H1 +ve (endo) Contoh: C (p) + H2O (ce) CO (g) + H2 (g) ,H1 +ve
C (g) + 2H (g) + O (g)
Bebas haba utk btk ikt Serap haba utk pecah ikt H3
H1 CO (g) + H2 (g)
H2 C (p) + H2O (ce)
Haba Pemendakan - maksud: perubahan tenaga haba apabila satu mol mendakan terbentuk pada keadaan piawai - cth: AgNO3 (ak) + NaCl (ak) Pers. Ion : Ag+ (ak) + Cl- (ak) AgCl (p) + NaNO3 (ak) AgCl (p)
kaedah penentuan Haba Pemendakan campurkan larutan ion garam, Mn+ sbyk V1 dengan larutan ion garam Xnsbyk V2 & perubahan suhu maksimum disukat
Haba Penyesaran maksud: haba yang dibebaskan a/p satu mol logam disesarkan drpd larutan garamnya oleh logam lain yang > elektropositif pada keadaan piawai Cth: Mg (p) + FeCl2 (ak) pers. Ion : Mg (p) + Fe2+ (ak) Fe (p) + MgCl2 (ak) Fe (p) + Mg2+ (ak)
kaedah penentuan Haba Penyesaran campurkan serbuk logam > elektropositif berlebihan dengan larutan garam, Mn+ sbyk V1 & perubahan suhu maksimum disukat Jisim bahan t/b & tidak diambil kira bahan t/b yg berlainan memberi haba penyesaran berlainan cth: haba t/b Zn dgn Fe2+ haba t/b Al dgn Fe2+
Haba Peneutralan maksud: haba yang dibebaskan a/p satu mol ion H+ t/b dgn satu mol ion OH- utk menghasilkan satu mol air pada keadaan piawai
Anda mungkin juga menyukai
- LKPD tERMOKIMIADokumen11 halamanLKPD tERMOKIMIAKrisostomus AnsaBelum ada peringkat
- Materi TermokimiaDokumen32 halamanMateri Termokimianurhikmah_88Belum ada peringkat
- Bak Air Yang MengalirDokumen13 halamanBak Air Yang MengalirZoria JuBelum ada peringkat
- Termokimia NotaDokumen4 halamanTermokimia NotaSarah WongBelum ada peringkat
- TermokimiaDokumen49 halamanTermokimianoorkeyoBelum ada peringkat
- TermokimiaDokumen24 halamanTermokimiaagusBelum ada peringkat
- Termokimia NotaDokumen4 halamanTermokimia NotaAzura AzizBelum ada peringkat
- Ppttermokimia 140206111422 Phpapp01 DikonversiDokumen32 halamanPpttermokimia 140206111422 Phpapp01 DikonversiSinta Dwi PrisiliaBelum ada peringkat
- Materi Kuliah Neraca PanasDokumen33 halamanMateri Kuliah Neraca PanasCrystal TaylorBelum ada peringkat
- SBMPTN - Termokimia PDFDokumen38 halamanSBMPTN - Termokimia PDFHansel HendrawanBelum ada peringkat
- 5.bahan AjarDokumen11 halaman5.bahan AjarYeni SenobaanBelum ada peringkat
- Termokimia SWDDokumen25 halamanTermokimia SWDDede Abdul AzisBelum ada peringkat
- Termokimia Sman GabunganDokumen42 halamanTermokimia Sman Gabunganmamanya inchanBelum ada peringkat
- Kayrea Aliffia TermokimiaDokumen5 halamanKayrea Aliffia TermokimiaKayrea AliffiaBelum ada peringkat
- Termodinamika Soal Pilihan GandaDokumen11 halamanTermodinamika Soal Pilihan GandaWilyanda RezekiBelum ada peringkat
- Termokimia 1Dokumen21 halamanTermokimia 1Desi wulandariBelum ada peringkat
- Soal Termodinamika PDFDokumen12 halamanSoal Termodinamika PDFKarsten Lius BongBelum ada peringkat
- LKS Persamaan TermokimiaDokumen11 halamanLKS Persamaan TermokimiaYudaaBelum ada peringkat
- Vi. Kesetimbangan KimiaDokumen75 halamanVi. Kesetimbangan KimiaNico Agung NugrahaBelum ada peringkat
- 11.2. TermokimiaDokumen2 halaman11.2. TermokimiaDar Sono TursinBelum ada peringkat
- ThermokimiaDokumen17 halamanThermokimiamaawsBelum ada peringkat
- Soal 2Dokumen4 halamanSoal 2Dicky SajjaBelum ada peringkat
- TERMOKIMIADokumen12 halamanTERMOKIMIAPakardan TeaBelum ada peringkat
- TermokimiaDokumen68 halamanTermokimiaEmma TheresiaBelum ada peringkat
- THERMOKIMIADokumen8 halamanTHERMOKIMIAAudrey BernadineTheroneBelum ada peringkat
- Termo KimiaDokumen26 halamanTermo KimiaDjoko Sriyadi67% (3)
- Termokimia SWDDokumen21 halamanTermokimia SWDRita AnggrainiBelum ada peringkat
- EnergetikaDokumen25 halamanEnergetikaDHe Vic'zBelum ada peringkat
- Ulangan Harian Ke-2 Xi Mipa TermokimiaDokumen2 halamanUlangan Harian Ke-2 Xi Mipa Termokimia,sxjBelum ada peringkat
- TERMOKIMIADokumen3 halamanTERMOKIMIASuci Rahmayani RahmayaniBelum ada peringkat
- TERMOKIMIA BAB 2Dokumen65 halamanTERMOKIMIA BAB 2PAK HERIBelum ada peringkat
- SOAL-LATIHAN-3-final-termokimia Dan Termodinamika PDFDokumen2 halamanSOAL-LATIHAN-3-final-termokimia Dan Termodinamika PDFaisyahnz100% (1)
- SadasdDokumen21 halamanSadasdAldi JonataBelum ada peringkat
- TermokimiaDokumen36 halamanTermokimiamuhamad pajrulBelum ada peringkat
- Pengertian Panas ReaksiDokumen1 halamanPengertian Panas ReaksiRizka Amelia PutriBelum ada peringkat
- Ulangan Harian TermokimiaDokumen5 halamanUlangan Harian TermokimiaRatulangi RatWulBelum ada peringkat
- Pertemuan 7 - TermokimiaDokumen8 halamanPertemuan 7 - TermokimiaAdelia NurulBelum ada peringkat
- Termokimia Olimpiade Kimia NasionalDokumen8 halamanTermokimia Olimpiade Kimia NasionalAdelia NurulBelum ada peringkat
- SOAL KIMIADokumen18 halamanSOAL KIMIAbambang craftBelum ada peringkat
- Soal Remidi Termokimia Kelas XI MIPA 1Dokumen1 halamanSoal Remidi Termokimia Kelas XI MIPA 1Anik nur rokhmahBelum ada peringkat
- Termokimia SWDXXDokumen25 halamanTermokimia SWDXXLian ElvaniBelum ada peringkat
- TERMOKIMIADokumen17 halamanTERMOKIMIASyafiqa50% (2)
- Soal Ulangan Harian TermokimiaDokumen3 halamanSoal Ulangan Harian TermokimiawakhidahBelum ada peringkat
- TERMOKIMIADokumen9 halamanTERMOKIMIARahayu LestariBelum ada peringkat
- TERMOKIMIADokumen37 halamanTERMOKIMIAESTUARYBelum ada peringkat
- TermokimiaDokumen37 halamanTermokimiaHardianti KamaluddinBelum ada peringkat
- TermokimiaDokumen17 halamanTermokimiaYosep Kevin DamanikBelum ada peringkat
- SMA N 68 TERMOKIMIADokumen3 halamanSMA N 68 TERMOKIMIAdevy_yantiBelum ada peringkat
- TERMOKIMIADokumen63 halamanTERMOKIMIAAri Sofyan SauriBelum ada peringkat
- Materi Kimia Dasar Teknik Pertemuan 15Dokumen28 halamanMateri Kimia Dasar Teknik Pertemuan 15gily StrongBelum ada peringkat
- TermokimiaDokumen41 halamanTermokimiaHanifahDwi SaharaBelum ada peringkat
- TERMOKIMIADokumen38 halamanTERMOKIMIAdzaky najwanBelum ada peringkat
- Kimia Fisika Kesetimbangan KimiaDokumen8 halamanKimia Fisika Kesetimbangan KimiaRiki WahyudiBelum ada peringkat
- Termokimia 2Dokumen31 halamanTermokimia 2Rina MonalisaBelum ada peringkat
- Contoh Soal PembakaranDokumen13 halamanContoh Soal PembakaranDuwi AgustinaBelum ada peringkat
- Entalpi dan reaksi termokimiaDokumen12 halamanEntalpi dan reaksi termokimiaVia AlzahraBelum ada peringkat
- Tes Hasil BelajarDokumen9 halamanTes Hasil BelajarNurul AtiqahBelum ada peringkat
- TERMOKIMIADokumen44 halamanTERMOKIMIAIqna AmaliyahBelum ada peringkat
- Perkataan BerimbuhanDokumen19 halamanPerkataan BerimbuhanZoria JuBelum ada peringkat
- Topik 2.1 Konsep Asas PSVDokumen39 halamanTopik 2.1 Konsep Asas PSVZoria JuBelum ada peringkat
- BBB Inovatif SainsDokumen14 halamanBBB Inovatif SainsOsman AbdullahBelum ada peringkat
- Topik 1.2 Kanak-Kanak Dan SeniDokumen22 halamanTopik 1.2 Kanak-Kanak Dan SeniAnonymous Z57yeGqBelum ada peringkat
- Pembentangan 2Dokumen25 halamanPembentangan 2Zi YanBelum ada peringkat
- Topik 1.2 Kanak-Kanak Dan SeniDokumen22 halamanTopik 1.2 Kanak-Kanak Dan SeniAnonymous Z57yeGqBelum ada peringkat
- Seni DLM PendidikanDokumen44 halamanSeni DLM PendidikanZoria JuBelum ada peringkat
- Sdp-Pengetahuan Asas Dalam MuzikDokumen39 halamanSdp-Pengetahuan Asas Dalam MuzikNisa TastasBelum ada peringkat
- Sdp-Pengetahuan Asas Dalam MuzikDokumen39 halamanSdp-Pengetahuan Asas Dalam MuzikNisa TastasBelum ada peringkat
- Esei PendekDokumen23 halamanEsei PendekZoria JuBelum ada peringkat
- Topik 2.2 Seni MuzikDokumen44 halamanTopik 2.2 Seni MuzikZoria JuBelum ada peringkat
- Topik 2.1 Konsep Asas PSVDokumen39 halamanTopik 2.1 Konsep Asas PSVZoria JuBelum ada peringkat
- Sdp-Pengetahuan Asas Dalam MuzikDokumen39 halamanSdp-Pengetahuan Asas Dalam MuzikNisa TastasBelum ada peringkat
- Proposal FaizDokumen33 halamanProposal FaizAhmad Faiz ShahidinBelum ada peringkat
- Nota Pengurusan Makmal SainsDokumen16 halamanNota Pengurusan Makmal SainsZoria JuBelum ada peringkat
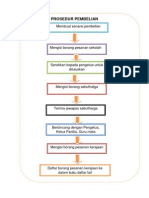
- Prosedur Pembelian SekolahDokumen1 halamanProsedur Pembelian SekolahZoria JuBelum ada peringkat
- Prosedur Pembelian SekolahDokumen1 halamanProsedur Pembelian SekolahZoria JuBelum ada peringkat
- Kaedah - Panduan Kertas KerjaDokumen28 halamanKaedah - Panduan Kertas KerjaZoria JuBelum ada peringkat
- REFLEKSIDokumen7 halamanREFLEKSIangah6327Belum ada peringkat
- Pengurusan Panitia Mata Pelajaran 2012Dokumen42 halamanPengurusan Panitia Mata Pelajaran 2012Anonymous F2Ocy2vBelum ada peringkat
- REFLEKSIDokumen7 halamanREFLEKSIangah6327Belum ada peringkat
- Contoh Refleksi Edu3105Dokumen5 halamanContoh Refleksi Edu3105Zoria JuBelum ada peringkat
- Refleksi Sce3123Dokumen1 halamanRefleksi Sce3123Zoria JuBelum ada peringkat
- Guru Matematik ProfesionalDokumen63 halamanGuru Matematik ProfesionalZoria JuBelum ada peringkat
- SejarahsepakbolaDokumen6 halamanSejarahsepakbolaZoria JuBelum ada peringkat
- Flower BorderDokumen6 halamanFlower BorderZoria JuBelum ada peringkat
- Laporan Karnival Permainan TradisionalDokumen2 halamanLaporan Karnival Permainan TradisionalGrace Emmanuelle RamaswarenBelum ada peringkat
- Nota Pengurusan Makmal SainsDokumen14 halamanNota Pengurusan Makmal SainsZoria JuBelum ada peringkat