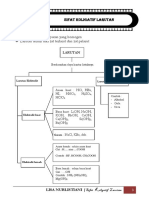
KELARUTAN ION
Diunggah oleh
Rizka Yuni R0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
199 tayangan3 halamanLATIHAN SOAL DAN JAWABAN UAS KIMIA KELAS 11
Judul Asli
SOAL KIMIA 11
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniLATIHAN SOAL DAN JAWABAN UAS KIMIA KELAS 11
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
199 tayangan3 halamanKELARUTAN ION
Diunggah oleh
Rizka Yuni RLATIHAN SOAL DAN JAWABAN UAS KIMIA KELAS 11
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 3
1. Larutan Mg(OH)2 0,01 M mempunyai 7.
Untuk menetralkan 11,6 Mg(OH)2 (mr =
konsentrasi OH- sebesar ... 58) diperlukan HCl sebanyak …. (mr HCl
A. 0,001 M = 36,5)
B. 0,1 M A. 12 g
C. 0,01 M B. 13 g
D. d. 0,02 M C. 14, 6 g
D. 13,4 g
2. Larutan NH3 0,1 M (Kb = 10-5
mempunyai [OH] sebesar …. 8. Dalam 100 mL larutan CH3COOH (Kc =
A. 10-1 10-5) dimasukan 50 mL larutan KOH 0,2
B. 10-3 M, ternyata dihasilkan larutan penyangga
C. 10-2 dengan pH = 5, maka molaritas larutan
D. 10-4 CH3COOH adalah ….
A. 0,1 M
3. Pasangan asam-basa konjugasi dari reaksi: B. 0,3 M
CH3COOH + HNO2 ⇌ CH3COOH2+ + NO2- C. 0,2 M
adalah …. D. 0,5 M
A. CH3COOH2+ dan HNO2
B. CH3COOH2+ dan NO2 9. Kelarutan Mg(OH)2 dalam air adalah 10-3
C. CH3COOH2+ dan CH3COOH mol/L. Maka harga Ksp Mg(OH)2 adalah…
D. CH3COOH dan HNO2 A. 1 . 10-6
B. 1 . 10-9
4. Larutan NH3 dengan pH = 11 + log 2 (Kb = C. 4 . 10-9
10-5) mempunyai konsentrasi sebesar ….
D. 8 . 10-9
A. 4 x 10-1 M
B. 2 x 10-2 M
C. 4 x 10-2 M 10. Dalam 200 mL air dapat larut 0,233
D. 2 x 10-1 M mg BaSO4. Hasil kali kelarutan
BaSO4 adalah….(Mr BaSO4= 233 )
5. Bila larutan HCl 0,2 M dapat dinetralkan A. 1 . 10-10
oleh 20 mL larutan NaOH 0,1 M, maka B. 3,6 . 10-9
banyaknya larutan HCl yang diperlukan C. 2,5 . 10-11
adalah …. D. 1 . 10-3
A. 5 mL
B. 20 mL 11. Harga hasil kali kelarutan (Ksp)
C. 10 mL
Ag2SO4 = 4 . 10-12 maka kelarutan
D. 30 mL
nya dalam 1 liter air adalah….
6. Berikut tabel harga Ka asam lemah A. 2 . 10-5 mol
B. 2 . 10-4 mol
No Asam Ka C. 1 . 10-4mol
1 HP 1,2 x 10-5 D. 4 . 10-2 mol
2 HQ 2,3 x 10-8 12. Dalam 200 ml larutan terdapat 2 . 10-5
3 HR 4,6 x 10-6 mol Mg(OH)2 jenuh, maka kelarutan
Mg(OH)2 dalam larutan pH 11 + log 2
4 HS 6,8 x 10-5 adalah..
Urutan kekuatan asam berdasarkan A. 1 . 10-2 M
tabel tersebut adalah …. B. 0,5 . 10-3M
A. HP > HS > HR > HQ C. 1 . 10-6 M
B. HP > HQ > HR > HS D. 2 . 10-6 M
C. HQ > HS > HR > HP
D. HP > HR > HQ > HR
13. Diketahui: 18. Jika kelarutan senyawa AgCl dalam
-16
Ksp AgCl = 1,2 . 10 mol/L air murni adalah 1 . 10-5M, maka
Ksp Mg(OH)2 = 1,2 . 10-12 mol/L kelarutan AgCl dalam larutan AgNO3
Ksp AgIO3 = 4 . 10-12 mol / L 0,01 M adalah..
Ksp AgBr = 5 . 10-13 mol/L A. 10-9
Ksp Mn(OH)2 = 1,9 . 10-13 mol/L B. 10-8
Dari data di atas, senyawa yang paling C. 10-7
kecil kelarutannya dalam air adalah…. D. 10-5
A. AgCl
B. Mg(OH)2 19. Pada suhu tertentu kelarutan Mg(OH)2
C. AgBr , (Ar Mg = 24 ; O = 16 ; H = 1) dalam
D. Mn(OH)2 tiap 2 Liter larutan jenuhnya sebanyak
116 mg , maka kelarutan Mg(OH)2
14. Diketahui Ksp dari: dalam larutan MgCl2 0,1 M adalah . . .
AgCl = 10-10, A. 4 x 10-4 mol/
AgI = 10-16 B. 2 x 10-4 mol/L
Ag2S = 10-49 C. 1 x 10-4 mol/L
Ag2CrO4 = 10-12 D. 1x 10-8 mol/L
Ag2CO3 = 10-11
Diantara senyawa senyawa tersebut di 20. Pada suhu dan tekanan tertentu
atas yang paling mudah larut dalam air kelarutan Ba(OH)2 ( Ar Ba=137,
adalah… O=16, H=1), dalam tiap liter larutan
A. Ag2CO3 jenuhnya sebanyak 171 mg, maka
B. Ag2CrO4 kelarutan Ba(OH)2 dalam BaCl2 0,001
C. Ag2S M adalah….
D. AgI A. 4 x 10-4 mol/L
B. 2 x 10-4 mol/L
15. Diketahui Ksp MgF2 adalah 10-8 maka C. 1 x 10-4 mol/L
kelarutan MgF2 dalam 0,01 M MgSO4 D. 4 x 10-3 mol/L
adalah…
A. 8,4 x 10-5 21. Kelarutan Ca(OH)2 (Mr = 74) dalam
B. 5 x 10-4 1L larutan jenuhnya sebanyak 7,4 mg ,
C. 10-5 maka pH larutan jenuh Ca(OH)2
D. 5 x 10-5 adalah . . . .
A. 10
16. Diketahui Ksp AlPO4 adalah B. 10 + log2
6,3 x10-19 maka kelarutan AlPO4 C. 10 – log2
dalam 0,63 M Al(OH)3 adalah… D. 4 + log2
A. 8,4 x 10-16
B. 5 x 10-16 22. Kelarutan Mg(OH)2 (Mr = 58) dalam
C. 1 x 10-17 100 mL larutan jenuhnya sebanyak
D. 1 x 10-18 0,58 mg maka pH larutan jenuh
Mg(OH)2 adalah . . . .
17. Jika Ksp Ag2CO3 = 1 . 10-14, maka A. 4 – log2
kelarutan Ag2CO3 dalam AgCl 0,001 B. 4 + log2
M adalah… C. 10 – log2
A. 5 . 10-13 D. 10 + log2
B. 1 . 10-12
C. 5 . 10-9
D. 1 . 10-8
23. Larutan L(OH)2 mempunyai pH = 10, Urutan kelarutan garam-garam
Hasil kali kelarutan dari L(OH)2 tersebut diatas dari yang besar ke yang
adalah…. kecil adalah …
A. 10-10 A. AgCl – Ag2CO3 – Ag3PO4 –
B. 5 . 10-13 Ag2S
C. 10-11 B. Ag2S – AgCl – Ag3PO4 – Ag2CO3
D. 5 . 10-16 C. Ag2CO3 – Ag3PO4 – AgCl –
Ag2S
24. Sebanyak 50 mL larutan K2CrO4 10-2 D. AgCl – Ag2S – Ag2CO3 – Ag3PO4
M masing masing dimasukkan ke
dalam lima wadah yang berisi ion Ba+,
Ca+, Cu+, Sr+2 dan Pb2+ dengan 27. Salah satu perbedaan antara koloid
volume dan konsentrasi yang sama. dengan suspensi adalah….
Jika Ksp: A. koloid bersifat homogen
BaCrO4 = 1,2 x 10-10 sedangkan suspensi bersifat
CaCrO4 = 7,1 x 1-4 heterogen
SrCrO4 = 4 x 10-5 B. koloid menghamburkan cahaya
CuCrO4 = 3,6 x 10-6 sedangkan suspensi meneruskan
PbCrO4 = 2,8 x 10-13 cahaya
Senyawa yang mengendap adalah… C. koloid stabil sedangkan
A. BaCrO4 dan CaCrO4 suspensi tidak stabil
D. koloid dua fasa sedangkan
B. CaCrO4 dan SrCrO4
suspensi satu fasa
C. SrCrO4 dan CuCrO4 Pembahasan:
D. BaCrO4 dan PbCrO4 a. Sifat sifat larutan, koloid , dan
suspensi adalah sebagai berikut:
25. Sebanyak 200 mL larutan AgNO3
0,02M, masing masing dimasukkan ke b. larutan satu fasa (homogen
dalam 5 wadah yang berisi 5 jenis sedangkan koloid dan suspensi
larutan yang mengandung ion S2-, dua fasa (heterogen)
PO43-, CrO42-, Br-, dan SO42- dengan c. larutan jernih sedangkan koloid
volume dan molaritas yang sama. Jika dan suspensi tidak jernih
harga Ksp dari d. larutan dan koloid tidak dapat
Ag2S = 2 . 10-49 disaring sedangkan suspensi dapat
Ag3PO4 = 1 . 10-20 disaring
Ag2CrO4 = 6 . 10-5 e. larutan dan koloid stabil (tidak
AgBr = 5 . 10-13 memisah jika didiamkan sedangkan
Ag2SO4 = 3 . 10-5 suspensi tidak stabil
Maka garam yang akan larut adalah….
A. Ag2S dan Ag3PO4
B. Ag2S dan AgBr
C. Ag2CrO4 dan Ag2SO4
D. Ag3PO4 dan AgBr
26. Diketahui :
Ksp Ag2CO3 = 8 × 10–12
Ksp Ag2S = 8 × 10–50
Ksp AgCl = 2 × 10–10
Ksp Ag3PO4 = 1 × 10–18
Anda mungkin juga menyukai
- Makalah Unsur Periode KetigaDokumen14 halamanMakalah Unsur Periode KetigaNurfajar IskandarBelum ada peringkat
- REAKSI REDOKSDokumen7 halamanREAKSI REDOKSAl Dien FaathiraBelum ada peringkat
- COPERDokumen29 halamanCOPERFebbil Zian FahmiBelum ada peringkat
- KSP Kimia SMAN 1 BOGORDokumen9 halamanKSP Kimia SMAN 1 BOGORPrahastomi Muttahari S.100% (2)
- LKPD Sel VoltaDokumen26 halamanLKPD Sel VoltaDavia SahraniBelum ada peringkat
- Tugas Kimia Kelompok X 2018Dokumen19 halamanTugas Kimia Kelompok X 2018Ayu Tiara AnnisaBelum ada peringkat
- Kelompok 6Dokumen18 halamanKelompok 6Zahra RamadhaniBelum ada peringkat
- KimiaDokumen41 halamanKimiaArief ARBelum ada peringkat
- Makalah Bahasa Indonesia Tifany Kelas 12 Mipa 6Dokumen57 halamanMakalah Bahasa Indonesia Tifany Kelas 12 Mipa 6Tifany putriBelum ada peringkat
- Soal Latihan Essay Usbn TerbaruDokumen3 halamanSoal Latihan Essay Usbn Terbarudumb SUPPLYBelum ada peringkat
- LKPDDokumen8 halamanLKPDintanBelum ada peringkat
- SifatKoligatifDokumen4 halamanSifatKoligatifriska nimasBelum ada peringkat
- Soal Bio SimulasiDokumen14 halamanSoal Bio SimulasiMaria AnastasiaBelum ada peringkat
- MATERIKIMIA 10 Soal Dan Pembahasan Sifat Koligatif Larutan PDFDokumen6 halamanMATERIKIMIA 10 Soal Dan Pembahasan Sifat Koligatif Larutan PDFyha widyaBelum ada peringkat
- Kumpulan Soal Kimia Dan JawabanDokumen5 halamanKumpulan Soal Kimia Dan JawabanHendrakimia100% (1)
- Prediksi Soal UN Bahasa Indonesia SMADokumen93 halamanPrediksi Soal UN Bahasa Indonesia SMATienLieBelum ada peringkat
- SOAL PAS KIMIA KELAS XII K13 (Prediksi) 2021/2022Dokumen5 halamanSOAL PAS KIMIA KELAS XII K13 (Prediksi) 2021/2022AudiBelum ada peringkat
- KIMIA ElektrolisisDokumen2 halamanKIMIA ElektrolisisIlovia Aya RegitaBelum ada peringkat
- Reaksi Halogen Dengan BasaDokumen3 halamanReaksi Halogen Dengan BasaMammy Nya AllyaBelum ada peringkat
- Pembahasan Soal Kimia UN 2015 No. 11-15Dokumen9 halamanPembahasan Soal Kimia UN 2015 No. 11-15AgilYogaBelum ada peringkat
- LKPD Kimia MarsyaDokumen9 halamanLKPD Kimia MarsyaNeli indahBelum ada peringkat
- Hasil Pengamatan Korosi Pada Paku (Tugas Kimia)Dokumen4 halamanHasil Pengamatan Korosi Pada Paku (Tugas Kimia)Jalalia BachtiarBelum ada peringkat
- Kebutuhan Prioritas PelajarDokumen11 halamanKebutuhan Prioritas PelajarNobu TadaBelum ada peringkat
- Terapan Hukum Hardy WeinbergDokumen11 halamanTerapan Hukum Hardy WeinbergRahmah Khairunnisa QonitaBelum ada peringkat
- 2 Soal Usbn Susulan Kimia 2018Dokumen12 halaman2 Soal Usbn Susulan Kimia 2018Asih Nia SariBelum ada peringkat
- TitikBekuLarutanDokumen2 halamanTitikBekuLarutanDella aprilaBelum ada peringkat
- Hukum KirchhoffDokumen7 halamanHukum KirchhoffThoriqBelum ada peringkat
- MODIFIKASI MAKANAN KHAS DAERAH-WPS OfficeDokumen11 halamanMODIFIKASI MAKANAN KHAS DAERAH-WPS Officealie mukhsonBelum ada peringkat
- Gform Enzim PraktikumDokumen3 halamanGform Enzim PraktikumarielBelum ada peringkat
- HALOGEN PPTXDokumen17 halamanHALOGEN PPTXYoga PurbaBelum ada peringkat
- Alkali TanahDokumen6 halamanAlkali TanahHadi WahyuBelum ada peringkat
- Jawaban Tts WsDokumen9 halamanJawaban Tts WsDwhy AndrianiBelum ada peringkat
- Latihan SOAL EHB-BKS KIMIA MODEL AKMDokumen15 halamanLatihan SOAL EHB-BKS KIMIA MODEL AKMcindy fatikaBelum ada peringkat
- LKS 2 Katabolisma 2021Dokumen6 halamanLKS 2 Katabolisma 2021Nazar S DwiputraBelum ada peringkat
- 19 TO UTBK SISTEM TERBARU 2021 (SAINTEK NEW) - KimiaDokumen16 halaman19 TO UTBK SISTEM TERBARU 2021 (SAINTEK NEW) - KimiaambisBelum ada peringkat
- Nama: Dimas Reza Fadlian Kelas: Xii Mipa Mapel: Fisika: =2Ω, R =4Ω ,Danr =6ΩDokumen8 halamanNama: Dimas Reza Fadlian Kelas: Xii Mipa Mapel: Fisika: =2Ω, R =4Ω ,Danr =6ΩWahyutri Nur'aini R. YBelum ada peringkat
- 5 6224172025888374811Dokumen19 halaman5 6224172025888374811yeni anggraeniBelum ada peringkat
- Makalah Es Krim Kel DewiDokumen9 halamanMakalah Es Krim Kel DewiAisyah HaurainaBelum ada peringkat
- PRESENTASI KIMIA KoloidDokumen10 halamanPRESENTASI KIMIA KoloidFarhan S. AdulBelum ada peringkat
- KKM MADRASAH ALIYAH NEGERI 2 KOTA SERANG TRY OUT UJIAN MADRASAH TAHUN PELAJARAN 2021/2022Dokumen8 halamanKKM MADRASAH ALIYAH NEGERI 2 KOTA SERANG TRY OUT UJIAN MADRASAH TAHUN PELAJARAN 2021/2022Fattah raihanBelum ada peringkat
- SMAN 1 Negara Unsur AlkaliDokumen24 halamanSMAN 1 Negara Unsur AlkaliBayu PramanaBelum ada peringkat
- Logam Alkali TanahDokumen1 halamanLogam Alkali TanahHalimah FauziahBelum ada peringkat
- HBR Tidak Dapat Dibuatdengan Cara Mereaksikan NaBr Dengan H2So4 Karena HBR Bersifat Reduktor Yang Sangat KuatDokumen2 halamanHBR Tidak Dapat Dibuatdengan Cara Mereaksikan NaBr Dengan H2So4 Karena HBR Bersifat Reduktor Yang Sangat KuatHayati NufusBelum ada peringkat
- Konfigurasi ElektronDokumen3 halamanKonfigurasi ElektronRizal AgungBelum ada peringkat
- RADIASIDokumen8 halamanRADIASIdevi ardiantiniBelum ada peringkat
- Soal Penjaskes KLS X Xi XiiDokumen3 halamanSoal Penjaskes KLS X Xi XiiSyaifulloh SyaifullohBelum ada peringkat
- 05 JAWABAN KIMIA K-2006-OkeDokumen11 halaman05 JAWABAN KIMIA K-2006-OkeMusdalifah MusdalifahBelum ada peringkat
- Unsur NeonDokumen16 halamanUnsur NeonFathmyBelum ada peringkat
- Bab 4 Benzena & TurunannyaDokumen6 halamanBab 4 Benzena & TurunannyaAgung BudiBelum ada peringkat
- Modul 3.9Dokumen27 halamanModul 3.9Firgita Lasido10Belum ada peringkat
- Latihan Un Sastra - KeduaDokumen8 halamanLatihan Un Sastra - Keduasastra indonesiaBelum ada peringkat
- Laporan Biologi FermentasiDokumen9 halamanLaporan Biologi FermentasiDewi Yuliantika IIBelum ada peringkat
- TTS KimiaDokumen2 halamanTTS KimiaAndyBelum ada peringkat
- LAPORAN Sel Volta - OkeDokumen7 halamanLAPORAN Sel Volta - OkeDevi Sri WahyuniBelum ada peringkat
- Materi Kimia Senyawa KarbonDokumen13 halamanMateri Kimia Senyawa KarbonDervishta NurBelum ada peringkat
- KkimiaDokumen17 halamanKkimiakarina ameliaBelum ada peringkat
- Kimia Unsur Part2Dokumen40 halamanKimia Unsur Part2rafiqah nasution100% (1)
- Latihan Soal Kimia Unsur Dan ElektrokimiaDokumen10 halamanLatihan Soal Kimia Unsur Dan ElektrokimiaArie MakasuciBelum ada peringkat
- Pembahasan Soal Kimia Xi Ipa Semester GenapDokumen6 halamanPembahasan Soal Kimia Xi Ipa Semester GenapNadya Chalista AgusthineBelum ada peringkat
- 40 Contoh Soal Kimia Kelas XI Beserta Jawabannya PDF DikonversiDokumen7 halaman40 Contoh Soal Kimia Kelas XI Beserta Jawabannya PDF DikonversiNora Amara SimbolonBelum ada peringkat
- PTS B.indo Kelas 4 Ta 2022/2023Dokumen2 halamanPTS B.indo Kelas 4 Ta 2022/2023Rizka Yuni RBelum ada peringkat
- Pedoman PenskoranDokumen1 halamanPedoman PenskoranRizka Yuni RBelum ada peringkat
- Soal Tema 3 Kelas 5Dokumen4 halamanSoal Tema 3 Kelas 5Rizka Yuni RBelum ada peringkat
- PTS Pai Kelas 4Dokumen4 halamanPTS Pai Kelas 4Rizka Yuni RBelum ada peringkat
- PTS Tema 1 Kelas 6Dokumen5 halamanPTS Tema 1 Kelas 6Rizka Yuni RBelum ada peringkat
- LKS Pembelajaran 4Dokumen12 halamanLKS Pembelajaran 4Rizka Yuni RBelum ada peringkat
- SEMESTERDokumen3 halamanSEMESTERRizka Yuni RBelum ada peringkat
- PTS Matematika Kelas 5 Ta 2022/2023Dokumen5 halamanPTS Matematika Kelas 5 Ta 2022/2023Rizka Yuni RBelum ada peringkat
- Lembar Kerja SiswaDokumen1 halamanLembar Kerja SiswaRizka Yuni RBelum ada peringkat
- Soal Pas KLS 5 Tema 1Dokumen6 halamanSoal Pas KLS 5 Tema 1yennyBelum ada peringkat
- Ulangan Harian Tema 1 Kelas 5Dokumen4 halamanUlangan Harian Tema 1 Kelas 5Rizka Yuni RBelum ada peringkat
- Kelas3Tema4HakKewajibanDokumen1 halamanKelas3Tema4HakKewajibanRizka Yuni RBelum ada peringkat
- Akm NumerasiDokumen4 halamanAkm NumerasiRizka Yuni RBelum ada peringkat
- PTS Tema 1 Kelas 2Dokumen4 halamanPTS Tema 1 Kelas 2Rizka Yuni RBelum ada peringkat
- Soal Pat BTQ Kelas 3Dokumen2 halamanSoal Pat BTQ Kelas 3Rizka Yuni RBelum ada peringkat
- OBJEK IPADokumen13 halamanOBJEK IPARizka Yuni RBelum ada peringkat
- Soal Pat BTQ Kelas 2Dokumen1 halamanSoal Pat BTQ Kelas 2Rizka Yuni RBelum ada peringkat
- Soal Fiqih Kelas 3Dokumen1 halamanSoal Fiqih Kelas 3Rizka Yuni RBelum ada peringkat
- Kelas 2 Tema 6Dokumen2 halamanKelas 2 Tema 6Rizka Yuni RBelum ada peringkat
- Tes Persamaan KataDokumen4 halamanTes Persamaan KataRizka Yuni RBelum ada peringkat
- Kingdom AnimaliaDokumen1 halamanKingdom AnimaliaRizka Yuni RBelum ada peringkat
- Kunci PrakaryaDokumen7 halamanKunci PrakaryaRizka Yuni RBelum ada peringkat
- Kelas 2 Tema 6Dokumen2 halamanKelas 2 Tema 6Rizka Yuni RBelum ada peringkat
- Lembar DiskusiDokumen1 halamanLembar DiskusiRizka Yuni RBelum ada peringkat
- Kelas 3 Tema 3Dokumen1 halamanKelas 3 Tema 3Rizka Yuni RBelum ada peringkat
- Mat Wajib XDokumen9 halamanMat Wajib XDipto Pratomo NugrohoBelum ada peringkat
- Kunci Biologi - 10Dokumen5 halamanKunci Biologi - 10Rizka Yuni R100% (1)
- Soal Ipa 8Dokumen2 halamanSoal Ipa 8Rizka Yuni RBelum ada peringkat
- Dokumentasi Kegiatan LaboratoriumDokumen5 halamanDokumentasi Kegiatan LaboratoriumRizka Yuni RBelum ada peringkat
- GLBDokumen4 halamanGLBRizka Yuni RBelum ada peringkat