Kimia Analitik Kualitatif Kation Dan Ani
Diunggah oleh
Arista YrDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kimia Analitik Kualitatif Kation Dan Ani
Diunggah oleh
Arista YrHak Cipta:
Format Tersedia
BAB I
PENDAHULUAN
1.1 Latar Belakang Masalah
Di sekitar kita dapat ditemukan banyak ion-ion terlarut seperti pada sungai, limbah,
air laut, atau pun dalam bentuk padatannya seperti pada tanah dan pupuk. Unsur logam dalam
larutannya akan membentuk ion positif atau kation, sedangkan unsur nonlogam akan
membentuk ion negatif atau anion. Metode yang digunakan untuk menentukan keberadaan
kation dan anion tersebut dalam bidang kimia disebut analisis kualitatif. Banyak pendekatan
yang dapat digunakan untuk melakukan analisis kualitatif. Ion-ion dapat diidentifikasi
berdasarkan sifat fisika dan kimianya.
1.2 Rumusan Masalah
1. Apa yang dimaksud dengan kimi analitik kualitatif?
2. Bagaimana cara menganalisis kation?
3. Bagaimana cara menganalisis anion?
1.3 Tujuan Penulisan
1. Mengetahui kimia analitik kualitatif secara keseluruhan beserta penjelasannya.
2. Memahami dan dapat menganalisis kation secara tepat.
3. Memahami dan dapat menganalisis anion secara tepat.
1.4 Manfaat Penulisan
Hasil penulisan ini diharapkan bermanfaat bagi pembaca dalam bidang kimia analitik
kualitatif mengenai analisis kation dan anion sehingga dapat menganalisis atau
mengidentifikasi kation dan anion dengan tepat sesuai metode yang disajikan.
Kimia Analitik Kualitatif Kation dan Anion 1
BAB II
PEMBAHASAN
2.1 Kimia Analitik Kualitatif
Analisis Kualitatif merupakan metode analisis kimia yang digunakan untuk mengenali
atau mengidentifikasi suatu unsur atau senyawa kimia (anion atau kation) yang terdapat
dalam sebuah sampel berdasarkan sifat kimia dan fisikanya. Sifat fisika suatu zat kimia
adalah sifat yang dapat diamati dengan pancaindera dan sifat yang dapat diukur tanpa
mengubah susunan kimia zat tersebut. Sifat yang dapat diamati dengan pancaindera adalah
wujud/rupa, warna, bau, rasa, tekstur, terbentuknya gelembung gas, dan terbentuknya
endapan, sedangkan sifat yang dapat diukur tanpa mengubah susunan kimia zat antara lain
bobot jenis, indeks bias, titik didih, dan titik leleh/beku.
2.2 Analisis Kation
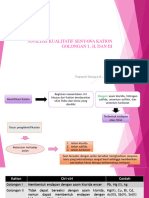
1. Klasifikasi Kation
Kation-kation dikelompokkan dalam lima golongan yang bertujuan untuk analisis
kualitatif sistematik. Kation-kation digolongkan berdasarkan sifat-sifat kation
terhadap beberapa reagensia. Reagensia golongan yang biasanya digunakan untuk
klasifikasi kation adalah asam klorida, hidrogen sulfida, amonium sulfida, dan
amonium karbonat. Klasifikasi ini didasarkan pada kemampuan suatu kation untuk
bereaksi dengan reagensia-reagensia dengan membentuk endapan atau tidak.
Ciri-ciri khas kelima golongan ini adalah:
a. Golongan I
Kation golongan I membentuk endapan dengan asam klorida encer. Ion-ion
golongan ini adalah timbel, merkurium (I) (raksa), dan perak.
b. Golongan II
Kation golongan II tidak dapat bereaksi dengan asam klorida, namun dapat
membentuk endapan dengan hidrogen sulfida dalam suasana asam mineral encer.
Ion-ion golongan ini adalah merkurium(II), tembaga, bismut, kadmium, arsenik
(III), arsenik (V), stibium (III), stibium (V), timah (II), dan timah (III)(IV).
Kimia Analitik Kualitatif Kation dan Anion 2
c. Golongan III
Kation golongan III tidak bereaksi dengan asam klorida encer atau dengan
hidrogen sulfida dalam suasana asam mineral encer. Kation golongan ini
membentuk endapan dengan amonium sulfida dalam suasana netral atau
amoniakal. Kation-kation golongan ini adalah kobalt (II), nikel (II), besi (II), besi
(III), kromium (III), aluminium, zink, dan mangan (II).
d. Golongan IV
Kation golongan ini tidak bereaksi dengan reagensia golongan I, II, dan III.
Kation-kation pada golongan IV membentuk endapan dengan amonium karbonat
dengan adanya amonium klorida, dalam suasana netral atau sedikit asam. Kation-
kation golongan ini adalah: kalsium, strontium, dan barium.
e. Golongan V
Kation-kation pada golongan V adalah kation yang umum yang tidak bereaksi
dengan reagensia-reagensia pada golongan sebelumnya. Kation ini merupakan
golongan kation yang terakhir yaitu ion-ion magnesium, natrium, kalium,
amonium, litium, dan hidrogen.
2. Golongan Kation I: Timbel (II), Merkurium (I), dan Perak (I)
Kation pada golongan pertama membentuk klorida-klorida yang tidak larut. Tetapi
timbel klorida sedikit larut dalam air sehingga tidak pernah mengendap dengan
sempurna bila ditambahkan asam klorida encer pada suatu cuplikan; ion timbel yang
tersisa itu, diendapkan secara kuantitatif dengan hidrogen sulfida dalam suasana asam
bersama kation golongan kedua.
a. Timbel (Pb)
Timbel merupakan logam berwarna abu-abu kebiruan dengan rapatan sebesar
11,48 g/ml pada suhu kamar. Timbel mudah larut dalam asam nitrat dengan
tingkat kepekatan sedang (8M), dan terbentuk nitrogen
-
oksida: 3Pb + 8HNO3 3Pb2 + 6NO3 + 2NO + 4H2O
Gas nitrogen (II) oksida yang tidak berwarna bila tercampur dengan udara akan
teroksidasi menjadi nitrogen dioksida berwarna
merah: 2NO (tidak berwarna) + O2 2NO2 (merah)
Kimia Analitik Kualitatif Kation dan Anion 3
Dengan asam nitrat pekat dapat terbentuk lapisan pelindung berupa timbel nitrat
pada permukaan logam yang mencegah pelarutan lebih lanjut.
Reaksi-reaksi dari ion timbel (II)
1. Asam klorida encer
2. Hidrogen sulfida dalam suasana netral atau asam encer: endapan hitam timbel
sulfida
3. Larutan amonia
4. Natrium hidroksida
b. Merkurium atau Raksa (Hg)
Merkurium adalah logam cair berwarna putih keperakan pada suhu biasa dengan
o
rapatan 13,534 g/ml pada 25 C. Merkurium mudah bereaksi dengan asam nitrat,
namun tidak dipengaruhi oleh asam klorida atau asam sulfat encer (2M). Reaksi-
reaksi dari ion merkurium (I)
1. Asam klorida encer atau klorida-klorida yang larut: endapan putih merkurium
(I) klorida (kalomel)
2. Hidrogen sulfida dalam suasana netral atau asam encer: endapan hitam, yang
merupakan campuran dari merkurium (II) sulfida dan logam merkurium
3. Larutan amonia: endapan hitam yang merupakan campuran logam merkurium
dan merkurium (II) amidonitrat basa.
4. Natrium hidroksida: endapan hitam merkurium (I) oksida
c. Perak, Ag
Perak adalah logam berwarna yang putih, dapat ditempa, liat dengan rapatan 10,5
o
g/ml dan melebur pada 960,5 C. Perak tidak larut dalam asam klorida, asam sulfat
encer (1M) atau asam nitrat encer (2M). Dalam larutan asam nitrat yang lebih
pekat (8M) atau dalam asam pekat panas, perak melarut:
+ -
6Ag + 8 HNO3 6Ag + 2NO + 6NO3 +4H2O
+ 2-
2Ag + 2H2SO4 2Ag + SO4 + SO2 +
2H2O Reaksi-reaksi ion perak (I):
1. Asam klorida encer (atau klorida-klorida yang larut): endapan putih perak
klorida
2. Hidrogen sulfida (gas atau larutan-air jenuh) dalam suasana netral atau asam:
endapan hitam perak sulfida
3. Larutan amonia: endapan coklat perak oksida
Kimia Analitik Kualitatif Kation dan Anion 4
4. Natrium hidroksida: endapan coklat perak oksida
Tabulasi reaksi-reaksi kation Golongan I
Pereaksi 2+ + +
Pb Hg Ag
HCl Putih, PbCl2 ↓ Putih, Hg2Cl2 ↓ Putih, AgCl2 ↓
Tdk ada prubahan Hitam, Hg ↓ + 2+
+ NH3 Larut, [ Ag(NH3)2]
+ air panas Larut HgNH2 ↓ Tdk ada prubahan
Tdk ada perubahan
H2S (+ HCl) Hitam, PbS ↓ Hitam, Hg ↓ + HgS ↓ Hitam, Ag2S ↓
+
+cc. NHO3 Putih, PbSO4 Putih, Hg2(NO3)2S ↓ Larut, Ag
Didihkan Putih, Pb(OH)2 ↓ Hitam, Hg+HgO, Coklat, Ag2O ↓
Tdk ada perubahan +
NH3 sedikit HgNH2NO3 ↓ Larut, [ Ag(NH3)2]
+ berlebihan Tdk ada perubahan
NaOH, sedikit ↓putih, Pb(OH)2 Hitam, Hg+HgO2, ↓ coklat, Ag2O
berlebih 2- Tdk ada perubahan
Larut, [Pb(OH4)] ↓ HgNH2NO3
Tdk ada perubahan
KI sedikit ↓ kuning PbI2 ↓ hijau HgI ↓ kuning HgI
+ berlebihan Tdk ada perubahan ↓ abu-abu Tdk ada perubahan
2-
Hg+[HgI4]
K2CrO4 ↓ kuning PbCrO4 ↓ merah Hg2CrO4 ↓ merah Ag2CrO4
+ NH3 Tdk ada perubahan ↓ hitam Larut,[Ag(NH3)]+
Hg+HgNH2NO3↓
KCN, sedikit ↓ Putih Pb(CN)2 ↓ Hitam Hg + ↓ Putih AgCN
+ berlebihan Tdk ada perubahan Hg(CN)2 Larut, [Ag(CN)2]-
Tdk ada perubahan
Na2CO3 ↓ Putih PbO, PbCO3 ↓ Putih kekuningan ↓ Putih kekuningan
+ mendidih Tdk ada perubahan Hg2CO3 Ag2CO3
↓ Hitam Hg + ↓ HgO ↓ Coklat Ag2O
Na2HPO4 ↓ Putih Pb3(PO4)2 ↓ Putih Hg2HPO4 ↓ Kuning Ag3PO4
Kimia Analitik Kualitatif Kation dan Anion 5
Reaksi spesifik Benzidina (+Br2) Difenil karbazida p-dimetilamino-
Warna biru Warna ungu benzilidena rodamina
(+HNO3)
Warna lembayung
3. Golongan kation II: Merkurium (II), Timbel (II), Bismut (III), Tembaga (II),
Kadmium (II), Arsenik (III) dan (V), Stibium (III) dan (V), dan Timah (II) dan
(IV).
a. Merkurium (Raksa), Hg- Merkurium
(II) Rekasi-reaksi ion merkurium (II):
1. Hidrogen Sulfida (gas atau larutan air jenuh): endapan putih merkurium (II)
klorosulfida terbentuk karena adanya asam klorida encer. Bila ditambahkan
hidrogen sulfida lebih lanjut akan terbentuk endapan hitam merkurium (II)
sulfida.
2. Larutan amonia: endapan putih dengan komposisi tercampur, pada dasarnya
2+
dari merkurium (II) oksida dan merkurium (II) amidonitrat: 2Hg
- +
+ NO3 + 4NH3 + H2O HgO.Hg(NH2)NO3 + 3NH4
3. Natrium hidroksida bila ditambahkan dalam jumlah sedikit: endapan merah-
kecoklatan dengan komposisi berbeda-beda, jika ditambahkan dalam jumlah
stoikiometris endapan berubah menjadi kuning ketika terbentuk merkurium
(II) oksida:
4. Kalium sianida (RACUN): tidak terdapat perubahan apapun dalam larutan
encer (perbedaan dari ion-ion lain dari sub-golongan tembaga)
5. Lembaran atau mata uang tembaga mereduksi ion merkurium (II) menjadi
logamnya:
2+ 2+
Cu + Hg Cu + Hg
b. Bismut, Bi
Bismut adalah logam yang putih-kemerahan, kristalin, getas, dan mempunyai titik
o
lebur 271,5 C. Bismut tidak larut dalam asam klorida namun dapat larut dalam
asam pengoksid seperti asam nitrat pekat, air raja, atau asam sulfat pekat. Reaksi-
reaksi ion bismut (III)
Kimia Analitik Kualitatif Kation dan Anion 6
1. Hidrogen sulfida (gas larutan air jenuh): endapan hitam bismut sulfida
2. Larutan amonia: garam basa putih dengan berbagai komposisi.
3. Natrium hidroksida: endapan putih bismut (III) hidroksida
4. Kalium sianida (RACUN): endapan putih, bismut hidroksida. Reaksi ini
adalah suatu hidrolisis:
3+ -
Bi + 3H2O + 3CN Bi(OH)3 + 3HCN
c. Tembaga, Cu
Tembaga adalah logam berwarna merah muda, lunak, dapat ditempa, dan liat.
o
Tembaga mempunyai titik lebur 1038 C. Tembaga tidak larut dalam asam klorida
dan asam sulfat encer, namun dapat sedikit larut dengan adanya oksigen. Reaksi-
reaksi ion tembaga (II):
1. Hidrogen sulfida (gas atau larutan-air jenuh): endapan hitam, tembaga(II)
sulfida
2. Larutan amonia bila ditambahkan dalam jumlah yang sangat sedikit: endapan
biru suatu garam basa (tembaga sulfat basa).
3. Natrium hidroksida dalam larutan dingin: endapan biru tembaga (II)
hidroksida.
4. Kalium iodida: mengendapkan tembaga (I) iodida yang putih, tetapi
larutannya berwarna coklat tua karena terbentuknya ion-ion tri-iodida (iod).
5. Kalium sianida (RACUN): terbentuk endapan kuning tembaga(II) sianida
apabila ditambahkan dengan sedikit sekali.
d. Kadmium, Cd
Kadmium adalah logam putih keperakan yang dapat ditempa dan liat. Kadmium
o
mempunyai titik lebut pada 321 C dan melarut dengan lambat dalam asam encer
dengan melepaskan hidrogen. Cd
+ 2+
+ 2H Cd + H2 Rekasi-
reaksi ion kadmium (II):
1. Hidrogen sulfida (gas atau larutan air jenuh): endapan kuning kadmium sulfida
2. Larutan amonia bila ditambahkan tetes demi tetes: endapan putih kadmium
(II) hidroksida
3. Natrium hidroksida: endapan putih kadmium(II) hidroksida
4. Kalium sianida (RACUN): endapan putih kadmium sianida
5. Kalium tiosianat: tidak membentuk endapan (perbedaan dari tembaga)
6. Kalium iodida: tidak membentuk endapan (perbedaan dari tembaga)
Kimia Analitik Kualitatif Kation dan Anion 7
e. Arsenik, As-Arsenik (III)
Arsenik merupakan zat padat berwarna abu-abu seperti baja, getas, dan berkilap
seperti logam. Arsenik bersublimasi dan timbul bau seperti bawang putih apabila
dipanaskan.
Reaksi-reaksi ion arsenik (III)
1. Hidrogen sulfida: endapan kuning arsenik(III) sulfida
2. Perak nitrat: endapan kuning perak arsenit dalam larutan netral (perbedaan
dari arsenat)
3. Larutan tembaga sulfat: endapan hijau tembaga arsenit (hijau Scheele)
4. Kalium tri-iodida (larutan iod dalam kalium iodida): mengoksidasikan ion
arsenit sambil kehilangan warna
f. Arsenik, As-Arsenik (V)
Reaksi-reaksi ion arsenat:
1. Hidrogen sulfida: tidak terjadi endapan segera dengan adanya asam klorida
encer.
2. Larutan perak nitrat: endapan merah kecoklatan, perak arsenat Ag3AsO4 dari
larutan netral. Endapan larut dalam asam dan dalam larutan amonia tetapi
tidak larut dalam asam asetat.
g. Uji-uji Khusus untuk Arsenik yang Berjumlah Sedikit
1. Uji Marsh
2. Uji Gutzeit
3. Uji Fleitzmann
4. Uji Reinsch
5. Uji Kering
h. Stibium, Sb-Stibium (III)
Stibium adalah logam putih keperakan mengkilap yang memiliki titik lebur
o
630 C. Stibium tidak larut dalam asam klorida dan asam sulfat encer. Senyawa-
3-
senyawa stibium (V) mengandung ion antimonat, SbO4 . Ciri-ciri khasnya serupa
dengan senyawa-senyawa arsenik padanannya.
i. Timah, Sn-Timah (II)
Tabulasi reaksi-reaksi kation Golongan IIA
Kimia Analitik Kualitatif Kation dan Anion 8
Pereaksi Hg2+ Sn2+ Bi3+ Cu2+ Cd2+
H2S ↓ Putih Coklat ↓ Hitam ↓ Hitam CuS ↓ Kuning
Hg3S2Cl2 Bi2Sr3 CdS
↓ Hitam HgS ↓SnS
larut
NH3, ↓ Putih ↓Bi(OH)2NO ↓ Biru ↓ Putih
sedikit HgO.Hg(NH)2N 3 Cu(OH)2CuSO Cd(OH)2
O3 4
NaOH, ↓ Merah Putih ↓ Putih ↓ Biru Cu(OH)2 ↓ Putih
sedikit kecoklatan Bi(OH)3 Cd(OH)2
+ ↓ Sedikit larut Tidak larut Tidak larut
berlebih Larut Sn(OH)2
KI ↓ Merah HgI2 ↓ Putih Putih, CuI2
+
Berlebih Larut Larut, (BrI)2-
KCN Tdk ada ↓ Putih Kuning, ↓ Putih
perubahan Bi(OH)3 Cu(CN)2 Cd(CN)2
+
Berlebih Tdk ada Tdk larut Larut Larut
perubahan [Cd(CN)4]2
-
SnCl2 ↓ Putih ↓ HgCl2
+
Berlebih ↓ Hitam Hg
Air ↓ Putih
BrO(NO)2
Reaksi Uji kobalt (II) Kalium Asam tionat Dinitro-P
spesifik Tiosianat → iodida → hitam depensi ↓
biru tua → warbadida
endapan (0,1%) →
merah dari coklat
jingga berubah
Kimia Analitik Kualitatif Kation dan Anion 9
menjadi
kehijauan
Biru Hijau
Uji nyala
abu-abu kebiran
Tabulasi Kation-kation golongan II B
Pereaksi As3+ As5+ Sb3+ Sb5+ Sn4+
H2S Suasana Kuning Merah Coklat Kuning
asam kuning As2S5 jingga Sb5S2 SnS2
(As2S3) Sb2S3
+ HCl pelarut, Tidak larut Tidak larut Larut Larut Larut, SnS2
dididihkan
AgNO3 + Kuning Merah
HNO3/NH4OH Ag3AsO3 coklat
Larut, AgAsO4
[Ag(NH3)2]+ Larut
SnCl2 + 2 mL HCl
pekat
0,5 mL
SnCl2↓
Coklat tua
NH4-molibolat Kristalin
putih
MgNH4SO4
KI + HCl pekat, Merah
ungu, I2 ↓ (SbI)3-
+CCl4
Gelatin,
kuning muda
Air Putih, Putih SbO4
SbOCl
Kimia Analitik Kualitatif Kation dan Anion 10
NaOH/NH4OH Putih, Putih Putih,
SbO3 Sb(OH)2 Sn(OH)4
Zink ↓ Hitam, Sb ↓ Hitam Sb Mereduksi
ion Sn4+
menjadi
Sn2+
HgCl2, sedikit Putih, Tdk ada
berlebih HgCl2 endapan
Abu-abu
Hg
Reaksi spesifik ↓ kuning Barutan Reagensia Reagensia
muda utanil rodamin-B Rodamin-B
asetat:↓ Warna
kuning muda biru
4. Golongan kation III: Besi (II) dan (III), Aluminium, Kromium (III) dan (VI),
Nikel, Kobalt, Mangan (II) dan (VII), dan Zink.
Reagensia golongan: hidrogen sulfida (gas atau larutan air jenuh) dengan adanya
amonia dan amonium klorida, atau larutan amonium sulfida.
Reaksi golongan: endapan-endapan dengan berbagai warna: besi (II) sulfida(hitam),
aluminium hidroksida (putih), kromium (III) hidroksida (hijau), nikel sulfida (hitam),
kobalt sulfida (hitam), mangan (II) sulfida (merah jambu), dan zink sulfida (putih).
a. Besi, Fe-Besi (II)
Besi murni adalah logam berwarna putih perak yang kukuh dan liat. Besi memiliki
o
titik lebur pada 1535 C. Biasanya besi mengandung sejumlah kecil karbida,
silisida, fosfida, dan sulfida dari besi, serta sedikit grafit.
b. Besi, Fe-Besi (III)
c. Aluminium – Al
Aluminium adalah logam berwarna putih yang liat dan dapat ditempa. Aluminium
o
melebur pada suhu 659 C. Aluminium dapat teroksidasi pada permukaannya
apabila terkena udara. Oksida dari aluminium melindungi objek oksida lebih
lanjut. Asam klorida encer dapat melarutkan logam ini dengan mudah.
d. Kromium, Cr – Kromium (II)
Kimia Analitik Kualitatif Kation dan Anion 11
Kromium adalah logam kristalin berwarna putih, tidak begitu liat, dan tidak dapat
o
ditempa. Logam kromium memiliki titik lebur 1765 C.logam ini larut dalam asam
klorida encer maupun pekat.
e. Oksoanion Logam-Logam Golongan III: Kromat dan Permanganat
2-
Oksoanion logam-logam golongan III seperti kromat (CrO 4 ) dan dikromat
2- -
(Cr2O7 ), dan permanganat (MnO4 ) direduksi oleh hidrogen sulfida dalam
suasana asam klorida menjadi masing-masing ion-ion kromium (III) dan mangan
(II). Dalam pengerjaan analisis, suatu cuplikan yang tidak diketahui, anion-anion
ini sudah diubah menjadi kation-kation Golongan III ketika proses pemisahan
mencapai tahap ini.
f. Kobalt, Co
Kobalt adalah logam berwarna abu-abu seperti baja yang bersifat sedikit magnetis.
o
Kobalt melebur pada 1490 C dan dapat melarut dalam asam-asam mineral encer.
g. Nikel
Nikel adalah logam berwarna putih perak dengan sifat material yang keras, kukuh,
o
bersifat liat, dan dapat ditempa. Logam nikel memiliki titik lebur pada 1455 C
dan sedikit magnetis.
h. Mangan, Mn- Mangan (II)
Mangan adalah logam berwarna putih abu-abu seperti besi tuang. Mangan
o
melebur pada suhu 1250 C. Mangan bereaksi dengan air hangat membentuk
mangan (II) hidroksida dan hidrogen.
i. Zink, Zn
Zink adalah logam yang berwarna putih kebiruan, mudah ditempa dan liat pada
o o
suhu 110-150 C. Zink mempunyai titik lebur pada 410 C dan titik didih pada
o
906 C.
Tabulasi Kation Golongan IIIA
No Pereaksi 2+ 3+ 3+ 3+ 4+
Fe Fe Al Cr / Cr
1. NaOH, tanpa Endapan putih, Endapan Endapan Endpn abu2
O2 Fe(OH)2 coklat putih, hijau biru
+ berlebih Tak larut kmerahan, Al(OH)3 gelatin,
+H2O2 Coklat keemasan, Fe(OH)2 Larut Cr(OH)2
Kimia Analitik Kualitatif Kation dan Anion 12
Fe(OH)3 Tak larut ———- Larut
———- Endapan
kuning
2. NH3 Endapan putih, Endapan Endapan Endapan
+ berlebih Fe(OH)2 coklat merah, putih, abu2 hijau
Tak larut Fe(OH)2 Al(OH)3 biru gelatin,
Tak larut Sedikit larut Cr(OH)2
———
3. H2S Tak ada perubahan Endapan ———– ———
+CH3OONa Endapan hitam, FeS putih susu, S ———– ———
————
4. (NH4)2S Endapan hitam, FeS Endapan Endapan Endpn abu2
+ O2 Endapan coklat, hitam, FeS putih, hijau biru
+ HCl Fe2O(SO4)2 ———— Al(OH)3 gelatin,
————– Endapan ———- Cr(OH)2
larut, warna ———- ———
putih ———
5. KCN Endapan coklat Endapan ———- ———
+ berlebih kekuningan, Fe(CN)2 coklat ———- ———
larut kemerahan,
Fe(CN)3
larut
6. K4[Fe(CN)6]2 Endapan putih, Endapan ———- ———
tanpa O2 K2Fe[Fe(CN)6] coklat ———– ———
+ O2 Endapan biru muda kemerahan,
Fe3[Fe(CN)6]3
+NaOH
endapan
merah
7. K3[Fe(CN)6] Endapan biru tua Warna coklat, ———– ———
Kimia Analitik Kualitatif Kation dan Anion 13
+ H2O2 ————- Fe3[Fe(CN)6] ———– ———
Endapan biru
prusia
8. (NH4)2CNS Tak ada perubahan Warna merah ———– ———
tua
9. Na2HPO4 ————- Endapan Endapan Endapan
+ NaOH ————- putih putih, AlPO4 hijau, CrPO4
kekuningan, Endapan larut ———
FePO4
————
10. CH3COONa ————- Warna coklat Tak ada Tak ada
+ encerkan & ————- kemerahan, perubahan perubahan
panaskan Endapan ———– Tak ada
+ berlebih & coklat perubahan
panaskan kemerahan,
11. Na2CO3 ————- ———— Endapan Endapan
+ berlebih ————- ———— putih, abu2 hijau
Al(OH)3 biru gelatin,
larut Cr(OH)2
——–
Tabulasi kation golongan III B
No Pereaksi 2+ 2+ 2+ 7+ 2+
Co Ni Mn ,Mn Zn
1. NaOH Endapan basa Endapan Endapan putih, Endapan putih
+berlebih biru, hijau, Mn(OH)2 gelatin, Zn(OH)2
+H2O2 Co(OH)NO3 NI(OH)2 Larut larut
Tak larut Tak larut Endapan ———
Endapan hitam ———– coklat,
kecoklatan, Mn(OH)2
Co(OH)3
Kimia Analitik Kualitatif Kation dan Anion 14
2. NH3 Endapan basa Endapan Endapan putih, Endapan putih,
+berlebih biru, hijau, Mn(OH)2 Zn(OH)2
Co(OH)NO3 NI(OH)2 larut larut
larut larut
3. (NH4)2S Endapan hitam, Endapan Endapan merah Endapan putih,
+ HNO3 CoS hitam, jambu, MnS ZnS
+ HCl Larut NiS ——— ———
+ berlebih Endapan putih, S ———- ——— ———
+ CHOOH ——— ———- ———larut Tak larut
——— Lar.Koloid ———
coklat tua
———
4. KCN Endapan coklat Endapan —————— ———
+ berlebih kemerahan, hijau, ———
Co(CN2) Ni(CN2)
larut larut
5. K4[Fe(CN)6]2 —————— ——— ——— Endapan putih,
+NaOH ——— ——— K2Zn3[Fe(CN)6]2
larut
6. Na2HPO4 ——— ——— Endapan merah Endapan putih,
+NH4 ——— ——– jambu, Zn(PO4)2
Mn(NH4)PO4
——— larut
7. KNO Endapan kuning, ——– ——— ———
K3[Co(NO2)6]
5. Golongan kation IV: Barium, Strontium, dan Kalsium
Reagensia golongan adalah larutan amonium karbonat 1M. Reagensia tidak berwarna
dan memperlihatkan reaksi basa karena hidrolisis.
a. Barium, Ba
Kimia Analitik Kualitatif Kation dan Anion 15
Barium adalah logam putih perak yang dapat ditempa, liat, dan stabil dalam udara
kering.
b. Strontium, Sr
Strontium adalah logam berwarna putih perak yang dapat ditempa dan liat.
o
Strontium memiliki titik lebur 771 C. Strontium memiliki sifat-sifat seperti
barium.
c. Kalsium, Ca
Kalsium adalah logam putih perak dengan struktur sedikit lunak dan mempunyai
o
titik lebur 845 C.
Tabulasi Kation Golongan IV
Pereaksi 2+ 2+ 2+
Ba Sr Ca
NH3 tidak ada perubahan tidak ada endapan tidak ada endapan
+berlebih Keruh
(NH4)2CO3 endapan putih endapan putih endapan amorf putih
+di didihkan BaCO3 SrCO3 CaCO3
+CH3COOH sedikit larut sedikit larut
endapan larut
(NH4)2C2O4 endapan putih endapan putih endapan putih
+CH3COOH Ba2C2SO4 Sr2C2SO4 Ca2C2SO4
endapan larut
H2SO4 endapan putih endapan putih endapan putih CaSO4
+H2SO4 pekat BaSO4 SrSO4 endapan larut
panas
CaSO4 endapan putih endapan putih tidak ada endapan
BaSO4 SrCO4
K4[Fe(CN)6]2 endapan putih
K2Ca[Fe(CN6]
K2CrO4 endapan kuning Endapan kuning tidak ada endapan
Kimia Analitik Kualitatif Kation dan Anion 16
+CH3COOH BaCrO4 SrCrO4
endapan jingga endapan larut
kemerahan
6. Golongan kation V: Magnesium, Natrium, Kalium, dan Amonium.
Pada golongan ini tidak terdapat reagensia golongan umum untuk kation-kation.
Kation-kation golongan V tidak bereaksi dengan asam klorida, hidrogen sulfida,
amonium sulfida atau dengan amonium karbonat. Hal yang dapat dilakukan untuk
mengidentifikasi ion-ion ini adalah dengan uji nyala atau reaksi khusus.
a. Magnesium, Mg
Magnesium adalah logam putih yang dapat ditempa, liat, memiliki titik lebur pada
o
650 C. Logam magnesium dapat terbakar dalam oksigen dengan mudah,
mengeluarkan cahaya putih dan membentuk oksida MgO dan nitrida Mg3N2.
b. Kalium, K
Kalium adalah logam berwarna putih perak, lunak, memiliki titik lebur pada
o
63,5 C. Kalium tidak berubah pada udara kering namun dapat teroksidasi dengan
cepat pada udara lembab. Logam kalium menguraikan air dengan dahsyat
menghasilkan hidrogen dan terbakar dengan nyala lembayung.
c. Natrium, Na
Natrium adalah logam berwarna putih perak berteskstur lunak dan memiliki titik
o
lebur 97,5 C. Dalam udara lembab, natrium dapat teroksidasi dengan cepat
sehingga harus disimpan dalam pelarut nafta atau silena. Logam natrium dapat
bereaksi hebat dengan air membentuk natrium oksida dan hidrogen.
+
d. Ion Amonium, NH4
Ciri-ciri khas ion amonium serupa dengan ciri-ciri khas ion logam-logam alkali.
Garam-garam amonium umumnya adalah senyawa-senyawa yang larut dalam air
dengan membentuk larutan yang tidak berwarna.
Tabulasi Kation Golongan V
2+ 2+ + +
Pereaksi Mg Na K NH4
NaOH ↓ putih gelatin
+ air Larut sedikit
Kimia Analitik Kualitatif Kation dan Anion 17
NaOH ↓ putih ↑ NH3, bau uap
+ berlebih Putih
NH4CO3 ↓ putih
Na2CO3 ↓ putih
+ asam Larut
Na2HPO4 ↓ kristalin putih
+ CH3COOH Larut
Kuning titan ↓ merah tua
Na3CO(NO2)6 ↓ kuning ↓ kuning
+CH3COOH
H2C4H4O6
+ Na-asetat
HClO4 ↓ kristal
putih
Uji nyala Meah tua Kuning lembayung
intensif
Nessler ↓ coklat tua, kuning
Pemijaran Menguap, tidak ada
sisa
2.3 Analisis Anion
Anion merupakan ion yang muatan totalnya negatif akibat adanya kenaikan jumlah
electron. Pengujian anion dilakukan setelah uji kation. Analisis anion tidak jauh berbeda
dengan analisis kation. Pengujian terhadap anion relatif lebih sederhana karena gangguan-
gangguan dari ion-ion lain yang ada dalam larutan minimal (dapat diabaikan). Analisis anion
tidak sesistematis analisis kation. Uji pendahuluan awal pada analisis anion juga berdasarkan
pada sifat fisika seperti warna, bau, terbentuknya gas, dan kelarutannya.
Kimia Analitik Kualitatif Kation dan Anion 18
Analisis anion dapat dilakukan dengan tiga cara: Bunsen, Gilreath dan Vogel.
Bunsen dengan cara menggolongkan anion dari sifat kelarutan garam perak dan garam
bariumnya, warna, kelarutan garam alkali dan kemudahan menguapnya. Gilreath
menggolongkan anion berdasarkan pada kelarutan garam-garam Ca, Ba, Cd, dan garam
perak. Cara vogel yaitu menggolongkan anion berdasarkan pada proses yang digunakan
dalam identifikasi anion yang menguap bila diolah dengan asam dan identifikasi anion
berdasarkan reaksinya dalam larutan. Analisis anion umumnya menggunakan cara vogel.
Umumnya anion dibagi menjadi 3 golongan utama yaitu:
2- 2- 3- 2- - 2- 2- -
a. Golongan Sulfat : SO4 , SO3 , PO4 , Cr2O4 , BO2 , CO3 , C2O4 , AsO4
- - - 2-
b. Golongan Halida : Cl , Br , I , S
- - -
c. Golongan Nitrat : NO3 , NO2 , C2H3O2
Kimia Analitik Kualitatif Kation dan Anion 19
Uji anion dalam larutan
1. Uji Sulfat
Garam BaSO4, BaSO3, Ba2(PO4)3, BaCr2O4, Ba(BO2)2, BaCO3, BaC2O4,
Ba3(AsO4)2 tidak larut dalam air kondisi basa, sedangkan garam barium anion
lainnya mudah larut. Berdasarkan sifat tersebut maka pemisahan dan identifikasi
untuk golongan sulfat dapat dilakukan dengan penambahan pereaksi BaCl2. Kecuali
barium kromat yang berwarna kuning, garam barium lainnya berwarna putih.
2. Uji untuk zat pereduksi
3. Uji untuk zat pengoksid
Uji regensia mangan(II)klorida, Zat ini dalam asam klorida pekat akan diubah oleh zat
zat pengoksidasi yang lemah sekalipun menjadi garam(III)mangan yang berwarna
coklat tua. Memungkinkan adanya ion ion kompleks
4. Uji dengan larutan perak nitrat
Jika larutan sampel diasamkan dengan asam nitrat dan ditambahkan perak nitrat maka
hanya golongan anion halida yang akan mengendap sebagai garam perak, yaitu: AgCl
(putih), AgBr(kuning), AgI(kuning muda), Ag2S (hitam).
5. Uji dengan larutan kalsium klorida
Dalam uji ini dibutuhkan ekstrak soda yang bersifat netral, ambil 10ml ekstrak soda
dan jadikan sedikit asam dengan asam nitrat lalu didihkan. Tambah ammonia encer
sampai basa, tambahkan CaCl2 dan diamkan, endapan putih menunjukan fluoride,
oksalat, fosfat, arsenat dan tartrat
6. Uji dengan larutan besi(III) klorida
Endapan kuning sampai coklat Benzoat,suksinat
Endapan biru Heksasianoferat(II)
Coklat kemerahan Asetat,Format
Kimia Analitik Kualitatif Kation dan Anion 20
Merah-darah dihilangkan oleh HgCl2 Tiosianat
Ungu-kemerahan Tiosulfat
Coklatdan Endapan Biru Heksasianoferat(III)
Lembayung Salisilat
Hitam-kehijauan Galat
Hitam-kebiruan Tanat
7. Uji Kromat
Perhatikan filltrat pada uji sulfat, jika berwarna kuning maka anion kromat ada.
Tambahkan pada filtrat Pbnitrat, jika terbentuk endapan kuning maka kromat ada.
8. Uji Asetat
Ambil beberapa tetes sampel, tambahkan etanol, perhatikan bau yang terbentuk, jika
tercium bau buah maka asetat ada.
Kimia Analitik Kualitatif Kation dan Anion 21
BAB III
PENUTUP
3.1 Kesimpulan
Dalam analisa kualitatif yang dilakukan berdasarkan metode H 2S kation-
kation diklasifikasikan dalam lima golongan berdasarkan sifat-sifat kation tersebut
terhadap beberapa pereaksi. Pereaksi yang paling umum dipakai adalah HCl, H2S,
amonium sulfida dan amonium karbonat. Cara identifikasi anion tidak begitu spesifik
seperti pada identifikasi kation. Identifikasi anion meliputi analisis pendahuluan,
analisis anion dari zat asal, dan analisis anion dengan menggunakan larutan ekstra
soda. Dari hasil analisis sebelumnya (data kelarutan) dan pengetahuan tentang kation
yang ada, dapat memberikan petunjuk tentang anion yang mungkin ada atau tak ada
dalam larutan sampel. Sebagai contoh, zat asal larut dalam air panas, kation yang
2+
ditemukan Pb , anion yang mungkin ada adalah klorida karena PbCl 2 larut dalam
air panas. Tida mungkin nitrat karena timbal nitrat mudah larut dalam air dingin.
3.2 Daftar Pustaka
Svehla, G. (Setiono & Pudjaatmaka, alih bahasa). 1985. Vogel Analsis Anorganik
Kualitatif Makro dan Semimikro, Edisi 5 Bagian I dan Bagian II. Jakarta: Kalman
Media Pusaka
http://wanibesak.files.com/2011/06/analisis-kation-dan-anion.pdf
https://docs.google.com/file/d/0B_7lFpil7ZYOZWRBdy1RMEZwdFU/edit?pli=1
Kimia Analitik Kualitatif Kation dan Anion 22
Anda mungkin juga menyukai
- ANALISIS KATION DAN ANIONDokumen21 halamanANALISIS KATION DAN ANIONRegina Aurelia RatteBelum ada peringkat
- Wido IndentifikasiDokumen22 halamanWido IndentifikasiYogo Candra BrotolarasBelum ada peringkat
- Kimia Analitik Kualitatif Kation Dan AniDokumen22 halamanKimia Analitik Kualitatif Kation Dan AniRafi DzakyBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Dokumen22 halamanMakalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Fajar Yusya Ramadhan94% (33)
- TP2 Kimia AnalisisDokumen24 halamanTP2 Kimia AnalisisSukmaBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion Ira JaperDokumen23 halamanMakalah Analisis Kualitatif Kation Dan Anion Ira JaperFauziahBelum ada peringkat
- Laporan Tetap Kation Kel 3Dokumen22 halamanLaporan Tetap Kation Kel 3Shendy PratamaBelum ada peringkat
- LA ArrheniusDokumen27 halamanLA Arrheniuseli eliBelum ada peringkat
- JSJSKSKSKKD 13 ANION KATIONjsjshshDokumen25 halamanJSJSKSKSKKD 13 ANION KATIONjsjshshNiaer ParenteiBelum ada peringkat
- Laporan-Tetap Kation PolsriDokumen19 halamanLaporan-Tetap Kation Polsririyan sanjayaBelum ada peringkat
- ANALISIS KATION SECARA SISTEMATISDokumen16 halamanANALISIS KATION SECARA SISTEMATISsoniaBelum ada peringkat
- ANALISIS KATIONDokumen9 halamanANALISIS KATIONZhalzhabilla AzzahrahBelum ada peringkat
- Kimia AnalitikDokumen20 halamanKimia AnalitikYannieApriyani50% (2)
- ANALISIS KATION SEDEHANADokumen22 halamanANALISIS KATION SEDEHANAM. Arif RachmanBelum ada peringkat
- p11 & p12) Analisis Kualitatif Anorganik Kation AnionDokumen22 halamanp11 & p12) Analisis Kualitatif Anorganik Kation AnionlidyawatiBelum ada peringkat
- Analisis KationDokumen16 halamanAnalisis KationLinggar Rudiarto100% (1)
- Analisis KationDokumen23 halamanAnalisis Kationabdurahman rifatBelum ada peringkat
- KATION DAN ANIONDokumen17 halamanKATION DAN ANIONHestiy SheechingBelum ada peringkat
- Kation IV Kelompok 3Dokumen21 halamanKation IV Kelompok 3ZahraBelum ada peringkat
- RX Kation Gol 1 & 2Dokumen46 halamanRX Kation Gol 1 & 2Lisa AndrianiBelum ada peringkat
- Analisis Kimia Kualitatif 22Dokumen20 halamanAnalisis Kimia Kualitatif 22Agus SanzdingerBelum ada peringkat
- 27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIDokumen22 halaman27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIMawar RamadhaniBelum ada peringkat
- Analisis KationDokumen12 halamanAnalisis KationExcel ClaudioBelum ada peringkat
- Buku Saku Kad 1Dokumen41 halamanBuku Saku Kad 1Vinola Legita S1 2018Belum ada peringkat
- Identifikasi Kation-1Dokumen16 halamanIdentifikasi Kation-1mareta silvianaBelum ada peringkat
- Kimia Dasar 7Dokumen20 halamanKimia Dasar 7Marwan RamadhanBelum ada peringkat
- Analisis Kualitatif (Uji Kation Dan Anion)Dokumen27 halamanAnalisis Kualitatif (Uji Kation Dan Anion)Heri YansyahBelum ada peringkat
- Materi KA1 Minggu 1Dokumen28 halamanMateri KA1 Minggu 1Arnes TataBelum ada peringkat
- REAKSI IDENTIFIKASI KATIONDokumen23 halamanREAKSI IDENTIFIKASI KATIONRindyani AgustinaBelum ada peringkat
- Kimia Analisis 1Dokumen30 halamanKimia Analisis 1nivia wibiantiBelum ada peringkat
- 6,7. Analisis KationDokumen24 halaman6,7. Analisis Kationcalvin kp22Belum ada peringkat
- Analisis Kation Golongan IDokumen5 halamanAnalisis Kation Golongan Ijung kristalBelum ada peringkat
- Analisis Kimia Kualitatif 20Dokumen22 halamanAnalisis Kimia Kualitatif 20Agus SanzdingerBelum ada peringkat
- Makalah Kimia Analitik Kualitatif Kation Dan AnionDokumen8 halamanMakalah Kimia Analitik Kualitatif Kation Dan AnionSri WahyuniBelum ada peringkat
- Identifikasi Kation Dengan Uji EndapanDokumen7 halamanIdentifikasi Kation Dengan Uji Endapanretno dwi pangastutiBelum ada peringkat
- Reaksi Identifikasi Kation Dan AnionDokumen21 halamanReaksi Identifikasi Kation Dan AnionZimon Pereiz43% (7)
- Identifikasi Kation Golongan 1 Dan 2Dokumen26 halamanIdentifikasi Kation Golongan 1 Dan 2Muhammad Alfi Syahri 1607112225Belum ada peringkat
- Analisis KationDokumen19 halamanAnalisis KationÐzíkrû HìlfîBelum ada peringkat
- Makalah Kation Dan AnionDokumen29 halamanMakalah Kation Dan AnionCahaya PratamaBelum ada peringkat
- Bahan Ajar Analisis KualitatifDokumen32 halamanBahan Ajar Analisis KualitatifEla Nur AnisaBelum ada peringkat
- ANALISIS KUALITATIFDokumen25 halamanANALISIS KUALITATIFtaufiq duppa duppaaBelum ada peringkat
- Analisis Kation Golongan I II III IV DanDokumen13 halamanAnalisis Kation Golongan I II III IV Dannadya aulia100% (1)
- Penuntuk Praktikum Kimia AnalitikDokumen27 halamanPenuntuk Praktikum Kimia AnalitikPutri AniBelum ada peringkat
- Analisis Kualitatif Kation Golongan IDokumen25 halamanAnalisis Kualitatif Kation Golongan IAlandoff FrnndzBelum ada peringkat
- Analisa Kation Golongan IDokumen10 halamanAnalisa Kation Golongan InaimaBelum ada peringkat
- Bab 7. Stoikiometri Larutan PDFDokumen15 halamanBab 7. Stoikiometri Larutan PDFNadya Chalista AgusthineBelum ada peringkat
- Modul Analisis Kimia 2022-2023Dokumen32 halamanModul Analisis Kimia 2022-2023abu alzenaBelum ada peringkat
- Analisis KationDokumen17 halamanAnalisis KationSileents ShaadowBelum ada peringkat
- Makalah KationDokumen50 halamanMakalah KationPalupi Diah UtamiBelum ada peringkat
- Analisis KationDokumen20 halamanAnalisis KationAldila PutriBelum ada peringkat
- Analisis Kualitatif AnorganikDokumen27 halamanAnalisis Kualitatif AnorganikTisenda TimiselaBelum ada peringkat
- Soal Manajemen+kunciDokumen12 halamanSoal Manajemen+kunciyulindaBelum ada peringkat
- STROKDokumen12 halamanSTROKArista YrBelum ada peringkat
- UU N0 4 1984 (Pencegahan Penyebaran Virus Corona Di Tempat Ibadah)Dokumen2 halamanUU N0 4 1984 (Pencegahan Penyebaran Virus Corona Di Tempat Ibadah)Arista YrBelum ada peringkat
- Pemanfaatan BelalangDokumen8 halamanPemanfaatan BelalangArista YrBelum ada peringkat
- Resep Dry SyrupDokumen1 halamanResep Dry SyrupArista YrBelum ada peringkat
- Konsep Penyebab Penyakit 1Dokumen36 halamanKonsep Penyebab Penyakit 1Arista YrBelum ada peringkat
- Materi 1 Kimia Dasar 1Dokumen29 halamanMateri 1 Kimia Dasar 130061991Belum ada peringkat
- Farmakologi KomprehensifDokumen342 halamanFarmakologi KomprehensifbazliahsyarfinaBelum ada peringkat
- Obat ResepDokumen2 halamanObat ResepArista YrBelum ada peringkat
- TEKNOLOGI SEDIAAN STERIL (Jawaban SOAL UAS TAKE HOME SED - STERIL)Dokumen12 halamanTEKNOLOGI SEDIAAN STERIL (Jawaban SOAL UAS TAKE HOME SED - STERIL)Arista YrBelum ada peringkat
- Materi 3, Media Pertumbuhan MikrobaDokumen5 halamanMateri 3, Media Pertumbuhan MikrobaArista YrBelum ada peringkat
- Elixir KemasanDokumen3 halamanElixir KemasanArista YrBelum ada peringkat
- UU N0 4 1984 (Pencegahan Penyebaran Virus Corona Di Tempat Ibadah)Dokumen2 halamanUU N0 4 1984 (Pencegahan Penyebaran Virus Corona Di Tempat Ibadah)Arista YrBelum ada peringkat
- ADMINISTRASI (5.B.Pengarahan, Motivasi & Konflik) PDFDokumen54 halamanADMINISTRASI (5.B.Pengarahan, Motivasi & Konflik) PDFArista YrBelum ada peringkat