Analisis Kimia Kualitatif 20
Diunggah oleh
Agus Sanzdinger0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
4 tayangan22 halamanDokumen tersebut membahas tentang analisis kimia kualitatif dan kuantitatif untuk mengetahui kandungan zat kimia dalam suatu sampel, serta identifikasi kation logam berat golongan I seperti timbal, merkuri, dan perak melalui reaksi khasnya dengan asam klorida yang menghasilkan endapan.
Deskripsi Asli:
Judul Asli
ANALISIS KIMIA KUALITATIF 20
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniDokumen tersebut membahas tentang analisis kimia kualitatif dan kuantitatif untuk mengetahui kandungan zat kimia dalam suatu sampel, serta identifikasi kation logam berat golongan I seperti timbal, merkuri, dan perak melalui reaksi khasnya dengan asam klorida yang menghasilkan endapan.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
4 tayangan22 halamanAnalisis Kimia Kualitatif 20
Diunggah oleh
Agus SanzdingerDokumen tersebut membahas tentang analisis kimia kualitatif dan kuantitatif untuk mengetahui kandungan zat kimia dalam suatu sampel, serta identifikasi kation logam berat golongan I seperti timbal, merkuri, dan perak melalui reaksi khasnya dengan asam klorida yang menghasilkan endapan.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 22
mengetahui keberadaan suatu
unsur atau senyawa kimia
KUALITATIF
ANALISIS KIMIA
KUANTITATIF
jenis analisis yang dilakukan untuk
untuk mengetahui kadar suatu
mengetahui kandungan senyawa kimia
zat
yang terdapat pada sampel uji baik
secara kualitatif ataupun secara
kuantitatif.
ANALISIS KUALITATIF
Dasar analisis kualitatif :
“ Tidak ada dua zat yang berlainan yang seluruh sifat-
sifatnya sama”
Pelaksanaan analisis kualitatif
1. Memeriksa/mengamati sifat bahan
2. Menafsirkan hasil pengamatan melalui perbandingan
dengan sifat zat yang sudah dikenal
3. Mengenal sifat-sifat berbagai bahan, meliputi:
a. Sifat fisika : warna, bau, rasa, kelarutan, massa jenis,dll
b. Sifat kimia : sifat yang dapat diamati setelah bahan
diberi zat kimia lain yang disebut reagen.
4. Hasil reaksi yang dapat diamati antara lain: perubahan
warna, pembentukan endapan, pembentukan gas dan
pembentukan hasil reaksi yang berbau
Analisa kualitatif dapat dilakukan dengan dua
cara, yaitu:
1.Reaksi kering
2.Reaksi basah
1. Reaksi Kering
digunakan untuk zat-zat padat dan dalam keadaan
kering, tanpa melarutkan sampel.
Reaksi kering salah satunya dapat dilakukan dengan
cara uji nyala
Uji Nyala
• digunakan untuk mengidentifikasi keberadaan ion
logam dalam jumlah yang relatif kecil pada sebuah
senyawa.
• uji nyala menggunakan nyala bunsen dan kawat
nikrom.
Zat mengandung Warna Nyala
Na Kuning
K Violet
Ca Merah bata
Sr Merah
Ba Hijau kuning
Cu Hijau kebiruan
Stronsium Kalium
Merah Ungu
Natrium Barium
Kuning Hijau Kekuningan
Kalsium
Merah Bata
2. Reaksi Basah
dilakukan dengan cara zat yang akan dianalisis
dilarutkan lebih dahulu dalam suatu zat pelarut yang
tepat.
Reaksi dikatakan terjadi bila :
• terbentuk endapan
• terjadi pembebasan gas
• terjadi perubahan warna.
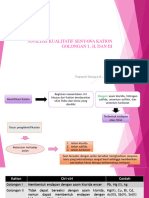
IDENTIFIKASI SENYAWA ANORGANIK
KLASIFIKASI KATION
Untuk memudahkan dalam melakukan analisis, kation-kation
dikelompokkan menjadi 5 golongan.
Golongan tersebut dibentuk berdasarkan sifat kation terhadap
reagen tertentu.
Reagen yg umum dipakai utk klasifikasi kation adalah asam
klorida, hidrogen sulfida, amonium sulfida dan amonium
karbonat.
Klasifikasi kation berdasarkan reagen adalah sbb:
1. Golongan I
Membentuk endapan dengan asam klorida encer. Ion-ion
golongan ini adalah timbal (Pb), merkurium (I) raksa, dan
perak(Ag).
2. Golongan II
• Membentuk endapan dengan hidrogen sulfida.
• Ion-ion golongan ini dibagi menjadi dua yaitu
golongan IIA dan IIB
• golongan IIA yaitu merkurium (II), tembaga ,
bismuth, kadmium,
• golongan IIB yaitu arsenik (III), arsenik (V),
stibium(III), stibium (V), timah (II) timah (III) dan
(IV).
3. Golongan III
• Kation golongan ini membentuk endapan dengan
amonium sulfida dalam suasana netral atau amoniakal.
• Kation-kation golongan ini adalah kobalt (II), nikel (II),
besi (II), besi (III), kromium(III) aluminium, zink dan
mangan (II).
4. Golongan IV
• Kation-kation ini membentuk endapan dengan
amonium karbonat dengan adanya amonium klorida
dalam suasana netral atau sedikit asam. Kation-kation
golongan ini adalah kalsium, stronsium dan barium.
5. Golongan V
Kation-kation yang umum, yang tidak bereaksi dengan
reagensia golongan sebelumnya, merupakan golongan
kation terakhir (sisa) yang meliputi ion magnesium,
natrium, kalium, dan amonium.
IDENTIFIKASI KATION
GOLONGAN I
• Ion-ion golongan I : timbal (Pb), merkurium (I)
dan perak(Ag).
• Pereaksi golongan : asam klorida (HCl)
• Reaksi golongan : endapan putih dari timbel
klorida (PbCl2), merkurium (I) klorida (Hg2Cl2)
dan perak klorida (AgCl)
1. Ion Timbal (Pb2+)
Ion Pereaksi Hasil Reaksi
asam klorida (HCl) endapan putih (PbCl2) Pb2+ + 2Cl- PbCl2↓
Hidrogen sulfida endapan hitam timbal Pb2+ + H2S PbS↓ + 2H+
(H2S) sulfida (PbS)
Amonia (NH4OH) endapan putih timbal Pb2+ + 2NH3 + 2H2O Pb(OH)2↓ +
hidroksida (Pb(OH)2) 2NH4+
Pb2+ Natrium endapan putih timbal Pb2+ + 2OH- Pb(OH)2↓
hidroksida (NaOH) hidroksida (Pb(OH)2)
asam sulfat encer endapan putih timbal Pb2+ + SO42- Pb SO4↓
(H2SO4) sulfat(Pb SO4)
Kalium Iodida (KI) endapan kuning Pb2+ + 2I- PbI2 ↓
timbal iodida (PbI2)
2. Ion Merkuri (I)/Hg22+
Ion Pereaksi Hasil Reaksi
asam klorida (HCl) endapan putih (Hg2Cl2) Hg22+ + 2Cl- Hg2Cl2↓
Hidrogen sulfida endapan hitam (HgS) Hg22+ + H2S Hg + HgS↓ + 2H+
(H2S)
Amonia (NH4OH) endapan hitam Hg22+ + NO3- + 4NH3+H2O
(HgOHg– NH2 dan 2Hg) HgOHg– NH2↓ + 2Hg↓ +
Hg22+ 3NH4+NO3
Natrium endapan hitam Mer- Hg22+ + 2OH- Hg2O↓ +
hidroksida (NaOH) kurium (I) oksida H2O
Kalium Iodida (KI) endapan hijau merku- Hg22+ + 2I - Hg2I2 ↓
rium(I) iodida
3. Ion Perak (Ag+)
Ion Pereaksi Hasil Reaksi
asam klorida (HCl) endapan putih perak Ag+ + 2Cl- AgCl↓
klorida
Hidrogen sulfida endapan hitam perak 2Ag+ + H2S Ag2S↓ +
(H2S) sulfida 2H+
Amonia (NH4OH) endapan coklat perak 2Ag+ + 2NH3 + H2O Ag2O↓
oksida + 2NH4+
Ag+
Natrium endapan coklat perak 2Ag+ + 2OH- Ag2O↓ + H2O
hidroksida (NaOH) oksida
Kalium Iodida (KI) endapan kuning perak Ag+ + I- AgI ↓
iodida
PERBEDAAN
Timbal Merkuri (I) Perak
Endapan Endapan Endapan
Amonia
putih hitam coklat
Endapan Endapan Endapan
Natrium hidroksida
putih hitam coklat
Endapan Endapan Endapan
Kalium kromat
kuning merah merah
Endapan Endapan Endapan
Kalium iodida
kuning hijau kuning
Endapan
Endapan Endapan
Natrium karbonat putih
putih kuning
kekuningan
Anda mungkin juga menyukai
- Analisis Kimia Kualitatif 22Dokumen20 halamanAnalisis Kimia Kualitatif 22Agus SanzdingerBelum ada peringkat
- Buku Saku Kad 1Dokumen41 halamanBuku Saku Kad 1Vinola Legita S1 2018Belum ada peringkat
- ANALISIS KATION DAN ANIONDokumen21 halamanANALISIS KATION DAN ANIONRegina Aurelia RatteBelum ada peringkat
- Kimia Analitik Kualitatif Kation Dan AniDokumen22 halamanKimia Analitik Kualitatif Kation Dan AniArista YrBelum ada peringkat
- Kimia Analitik Kualitatif Kation Dan AniDokumen22 halamanKimia Analitik Kualitatif Kation Dan AniRafi DzakyBelum ada peringkat
- Praktikum Kimia Analitik - Kation Gol 1Dokumen10 halamanPraktikum Kimia Analitik - Kation Gol 1meganingrumBelum ada peringkat
- Wido IndentifikasiDokumen22 halamanWido IndentifikasiYogo Candra BrotolarasBelum ada peringkat
- ANALISIS KATION DAN ANIONDokumen35 halamanANALISIS KATION DAN ANIONSetiawanBelum ada peringkat
- Analisis KualitatifDokumen29 halamanAnalisis KualitatifStella Christa100% (1)
- Analisis Kation 1-5Dokumen62 halamanAnalisis Kation 1-5farisaBelum ada peringkat
- Modul Analisis Kimia 2022-2023Dokumen32 halamanModul Analisis Kimia 2022-2023abu alzenaBelum ada peringkat
- REAKSI IDENTIFIKASI KATIONDokumen23 halamanREAKSI IDENTIFIKASI KATIONRindyani AgustinaBelum ada peringkat
- Teknik Analis KationDokumen16 halamanTeknik Analis Kationgamersantuy201Belum ada peringkat
- Buku Saku KadDokumen40 halamanBuku Saku KadMAYLANIBelum ada peringkat
- Kimia Analisis 1Dokumen30 halamanKimia Analisis 1nivia wibiantiBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion Ira JaperDokumen23 halamanMakalah Analisis Kualitatif Kation Dan Anion Ira JaperFauziahBelum ada peringkat
- 6,7. Analisis KationDokumen24 halaman6,7. Analisis Kationcalvin kp22Belum ada peringkat
- Laporan Tetap Kation Kel 3Dokumen22 halamanLaporan Tetap Kation Kel 3Shendy PratamaBelum ada peringkat
- Identifikasi KationDokumen38 halamanIdentifikasi KationfasyaurfaniBelum ada peringkat
- 27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIDokumen22 halaman27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIMawar RamadhaniBelum ada peringkat
- Analisis Kualitatif (Uji Kation Dan Anion)Dokumen27 halamanAnalisis Kualitatif (Uji Kation Dan Anion)Heri YansyahBelum ada peringkat
- Kimia Dasar 7Dokumen20 halamanKimia Dasar 7Marwan RamadhanBelum ada peringkat
- Penuntuk Praktikum Kimia AnalitikDokumen27 halamanPenuntuk Praktikum Kimia AnalitikPutri AniBelum ada peringkat
- kIMIA ANALTIKDokumen14 halamankIMIA ANALTIKdedyBelum ada peringkat
- p11 & p12) Analisis Kualitatif Anorganik Kation AnionDokumen22 halamanp11 & p12) Analisis Kualitatif Anorganik Kation AnionlidyawatiBelum ada peringkat
- Laporan KA Minggu 1Dokumen22 halamanLaporan KA Minggu 1RomeliRomBelum ada peringkat
- Laporan KfaDokumen29 halamanLaporan KfaRenato PutraBelum ada peringkat
- Analisa Kualitatif Senyawa AnOrganikDokumen16 halamanAnalisa Kualitatif Senyawa AnOrganiknofaliasariBelum ada peringkat
- KATIONANALISISDokumen12 halamanKATIONANALISISariemahendraBelum ada peringkat
- Kation Golongan II - Anion 2022Dokumen24 halamanKation Golongan II - Anion 2022DianiLafitaBelum ada peringkat
- Analisis Kualitatif Kation dan AnionDokumen6 halamanAnalisis Kualitatif Kation dan AnionAuliya NaurahBelum ada peringkat
- Makalah KationDokumen50 halamanMakalah KationPalupi Diah UtamiBelum ada peringkat
- Analisis Kualitatif Kation dan AnionDokumen16 halamanAnalisis Kualitatif Kation dan AnionFrisqila RizkaBelum ada peringkat
- LA ArrheniusDokumen27 halamanLA Arrheniuseli eliBelum ada peringkat
- JSJSKSKSKKD 13 ANION KATIONjsjshshDokumen25 halamanJSJSKSKSKKD 13 ANION KATIONjsjshshNiaer ParenteiBelum ada peringkat
- Kimia AnalitikDokumen20 halamanKimia AnalitikYannieApriyani50% (2)
- ANALISIS KATIONDokumen9 halamanANALISIS KATIONZhalzhabilla AzzahrahBelum ada peringkat
- Identifikasi Kation Golongan 1 Dan 2Dokumen26 halamanIdentifikasi Kation Golongan 1 Dan 2Muhammad Alfi Syahri 1607112225Belum ada peringkat
- Kation Gol 5Dokumen15 halamanKation Gol 5Aditiya DewantaraBelum ada peringkat
- ANALISIS KATION SECARA SISTEMATISDokumen16 halamanANALISIS KATION SECARA SISTEMATISsoniaBelum ada peringkat
- Bab II Lanjutan PDFDokumen35 halamanBab II Lanjutan PDFRiskiBelum ada peringkat
- Kelompok 2 KAD (Autosaved)Dokumen28 halamanKelompok 2 KAD (Autosaved)susi simangunsongBelum ada peringkat
- Analisis KationDokumen9 halamanAnalisis KationWati setyaningrumBelum ada peringkat
- ANALISIS KATION SEDEHANADokumen22 halamanANALISIS KATION SEDEHANAM. Arif RachmanBelum ada peringkat
- KATION DAN ANIONDokumen19 halamanKATION DAN ANIONwahyu kurniawanBelum ada peringkat
- Bab II Analisis KualitatifDokumen23 halamanBab II Analisis KualitatifFaradisa AninditaBelum ada peringkat
- ANALISIS KATION DENGAN REAKSI SPESIFIKDokumen22 halamanANALISIS KATION DENGAN REAKSI SPESIFIKtri anugrahBelum ada peringkat
- Analisis KationDokumen23 halamanAnalisis Kationabdurahman rifatBelum ada peringkat
- Kelompok.5 Analisis Kualitatif KationDokumen34 halamanKelompok.5 Analisis Kualitatif Kationzahratul jannahBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Dokumen22 halamanMakalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Fajar Yusya Ramadhan94% (33)
- Kation Gol IiDokumen35 halamanKation Gol IiMuhammad FirmansyahBelum ada peringkat
- Laporan-Tetap Kation PolsriDokumen19 halamanLaporan-Tetap Kation Polsririyan sanjayaBelum ada peringkat
- Laporan Praktikum Kimia AnalisaDokumen18 halamanLaporan Praktikum Kimia AnalisaAji SetiawanBelum ada peringkat
- Identifikasi Kation 1-5Dokumen176 halamanIdentifikasi Kation 1-5mirandaBelum ada peringkat
- Analisis AnionDokumen10 halamanAnalisis AniongustifhzBelum ada peringkat
- IDENTIFIKASI KATION GOLONGAN IIDokumen22 halamanIDENTIFIKASI KATION GOLONGAN IIjane nizar rahmanBelum ada peringkat
- Kation IV Kelompok 3Dokumen21 halamanKation IV Kelompok 3ZahraBelum ada peringkat
- Konfigurasi ElektronDokumen9 halamanKonfigurasi ElektronAgus SanzdingerBelum ada peringkat
- LKPD Sel Elektrolisis - I Kadek Agus TarsanaDokumen4 halamanLKPD Sel Elektrolisis - I Kadek Agus TarsanaAgus SanzdingerBelum ada peringkat
- LKPD Hukum Hess - I Kadek Agus TarsanaDokumen6 halamanLKPD Hukum Hess - I Kadek Agus TarsanaAgus SanzdingerBelum ada peringkat
- Media RA1 - I Kadek Agus TarsanaDokumen8 halamanMedia RA1 - I Kadek Agus TarsanaAgus SanzdingerBelum ada peringkat
- LKPD Tindakan, Motif, Dan Prinsip EkonomiDokumen5 halamanLKPD Tindakan, Motif, Dan Prinsip EkonomiAgus SanzdingerBelum ada peringkat
- LKPD KALORIMETER AsliDokumen5 halamanLKPD KALORIMETER AsliAgus SanzdingerBelum ada peringkat
- Konsep Laju ReaksiDokumen10 halamanKonsep Laju ReaksiAgus SanzdingerBelum ada peringkat
- Kebutuhan Dan KelangkaanDokumen12 halamanKebutuhan Dan KelangkaanAgus SanzdingerBelum ada peringkat
- TITRASI IODIMETRI IodoDokumen9 halamanTITRASI IODIMETRI IodoAgus SanzdingerBelum ada peringkat
- Tindakan Ekonomi Motif Dan Prinsip EkonoDokumen7 halamanTindakan Ekonomi Motif Dan Prinsip EkonoAgus SanzdingerBelum ada peringkat
- LKPD Hukum Hess - I Kadek Agus TarsanaDokumen6 halamanLKPD Hukum Hess - I Kadek Agus TarsanaAgus SanzdingerBelum ada peringkat
- KONSEP MOL DaringDokumen14 halamanKONSEP MOL DaringAgus SanzdingerBelum ada peringkat
- Titrasi PermanganometriDokumen9 halamanTitrasi PermanganometriAgus SanzdingerBelum ada peringkat
- Faktor Laju ReaksiDokumen12 halamanFaktor Laju ReaksiAgus SanzdingerBelum ada peringkat
- Unsur RadioaktifDokumen13 halamanUnsur RadioaktifAgus SanzdingerBelum ada peringkat
- LIPIDDokumen8 halamanLIPIDAgus SanzdingerBelum ada peringkat
- Tugas Titrasi RedoksDokumen1 halamanTugas Titrasi RedoksAgus SanzdingerBelum ada peringkat
- Konsep Mol 17-18Dokumen20 halamanKonsep Mol 17-18Agus SanzdingerBelum ada peringkat
- LKS Isotop Dan Konfigurasi ElektronDokumen1 halamanLKS Isotop Dan Konfigurasi ElektronAgus SanzdingerBelum ada peringkat
- LKS IkatanDokumen1 halamanLKS IkatanAgus SanzdingerBelum ada peringkat
- HIDROKARBONDokumen11 halamanHIDROKARBONtary rhismaBelum ada peringkat
- KONSENTRASI LARUTANDokumen12 halamanKONSENTRASI LARUTANAgus SanzdingerBelum ada peringkat
- Larutan ElektrolitDokumen20 halamanLarutan ElektrolitAgus SanzdingerBelum ada peringkat
- Asam Amino, Peptida Dan ProteinDokumen16 halamanAsam Amino, Peptida Dan ProteinAgus SanzdingerBelum ada peringkat
- Laju Reaksi 1Dokumen9 halamanLaju Reaksi 1Agus SanzdingerBelum ada peringkat
- Identifikasi Ion Golongan IDokumen20 halamanIdentifikasi Ion Golongan IAgus SanzdingerBelum ada peringkat
- ALKANADokumen18 halamanALKANAAgus SanzdingerBelum ada peringkat
- Hidrokarbon 1Dokumen10 halamanHidrokarbon 1Agus SanzdingerBelum ada peringkat
- Ion KompleksDokumen15 halamanIon KompleksAgus SanzdingerBelum ada peringkat
- Hidrokarbon 3Dokumen15 halamanHidrokarbon 3Agus SanzdingerBelum ada peringkat