REAKSI KIMIA
Diunggah oleh
Megawati Setiawan Putri0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
9 tayangan5 halamantugas
Judul Asli
19031010056_MEGAWATI SETIAWAN PUTRI_TUGAS 2 TRK I
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Initugas
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
9 tayangan5 halamanREAKSI KIMIA
Diunggah oleh
Megawati Setiawan Putritugas
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 5
NAMA : MEGAWATI SETIAWAN PUTRI
NPM : 19031010056
PARALEL :B
TUGAS TEKNIK REAKSI KIMIA I
3.1 Menemukan persamaan laju reaksi dengan menggunakan metode integral
Reaktan A terdekomposisi dalam reaktor batch
𝐴 → 𝑃𝑟𝑜𝑑𝑢𝑘
Komposisi A di reaktor diukur dengan variasi waktu yang disajikan dalam kolom 1
dan 2. Menemukan persamaan laju reaksi untuk mewakili data.
Kolom 1 Kolom 2 Kolom 3 Kolom 4
Waktu, t(sekon) Konsentrasi 𝐶𝐴0 1
𝑙𝑛
CA, mol/Liter 𝐶𝐴 𝐶𝐴
0 CA0 = 10 Ln 10/10 = 0 0.1
20 8 Ln 10/8 = 0.2231 0.125
40 6 0.511 0.167
60 5 0.6931 0.200
120 3 1.204 0.333
180 2 1.609 0.500
300 1 2.303 1.000
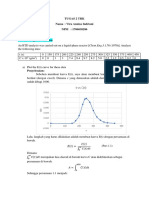
Penyelesaian:
a. Mencoba menggunakan reaksi orde pertama
𝐶𝐴0
Reaksi orde pertama digambarkan kurva antara 𝑙𝑛 vs t. Didapatkan kurva seperti
𝐶𝐴
pada gambar berikut.
Gambar 1. Grafik Orde Satu
Kurva yang dihasilkan yaitu berbentuk garis lengkung dan buka garis lurus, sehingga
harus dicoba dengan reaksi order yang lain.
b. Mencoba menggunaan reaksi orde kedua
1
Reaksi orde kedua digambarkan kurva natara vs t. Didapatkan kurva seperti pada
𝐶𝐴
gambar berikut.
Gambar 2. Grafik Orde Dua
Kurva yang dihasilkan sama seperti dengan reaksi orde pertama yaitu garis lengkung,
sehingga harus dicoba dengan rekasi orde ke-n.
c. Mencoba menggunakan reaksi orde ke-n
𝐶
Menggunakan metode fractional life dengan F=80%. Dimana F adalah 𝐶 𝐴 . Diperoleh
𝐴𝑂
persamaan sebagai berikut.
(0.8)1−𝑛 − 1 1−𝑛
𝑡𝑓 = 𝐶 … … … … … … … … … . … … … … . . (𝑖)
𝑘(𝑛 − 1) 𝐴0
Kemudian persamaan (i) dibuat menjadi bentuk log, sehingga menjadi persamaan
sebagai berikut.
𝑙𝑜𝑔 𝑡𝑓 (0.8)1−𝑛 − 1
= log ( ) + (1 − 𝑛)𝑙𝑜𝑔𝐶𝐴0 … … … … . . (𝑖𝑖)
𝑦 𝑘(𝑛 − 1)
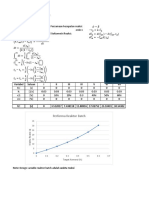
Setelah itu plot grafik CA vs t, dihasilkan grafik sebagai berikut.
Gambar 3. Grafik Hubungan antara Ca vs Waktu
Lalu pilih titik CA0 pada nilai 10,5,2 agar bisa membentuk garis pada grafik dan buat
tabel seperti dibawah ini:
CA0 CA end Waktu yang Log tF Log CA0
(=0.8*CA0) dibutuhkan tF, s
10 8 0→18.5 = 18.5 Log 18.5 = 1.27 1.00
5 4 59→82 = 23 1.36 0.70
2 1.6 180→215 = 35 1.54 0.30
Selanjutnya plot grafik tF vs log CA0, dihasilkan grafik sebagai berikut dan dihasilkan
slope.
Gambar 4. Grafik Hubungan antara Log t vs ln CA0
𝑆𝑙𝑜𝑝𝑒 = 1 − 𝑛 = −0.4
𝑛 = 1.4
Ambil salah satu data dari grafik CA vs t. dipilih CA0 = 10 dengan tF = 18.5 sekon.
Kemudian subtitusi ke dalam persamaan (i).
(0.8)1−1.4 − 1 1−1.4
18.5 = 10
𝑘(1.4 − 1)
((0.8)1−1.4 − 1) 𝑥 101−1.4
𝑘=
18.5 (1.4 − 1)
0.03717
𝑘=
7.4
𝑘 = 0.005
Dengan demikian, diperoleh persmaan laju reaksi yang mewakili reaksi tersebut
adalah
𝑙𝑖𝑡𝑒𝑟 0.4 1.4 𝑚𝑜𝑙
−𝑟𝐴 = (0.005 )𝐶
𝑚𝑜𝑙 0.4 𝑠 𝐴 𝑙𝑖𝑡𝑒𝑟. 𝑠
3.2 Menentukan persamaan laju reaksi dengan menggunakan metode differesial
Menggunakan data order reaksi ke-n untuk grafik konsentrasi vs waktu pada soal 3.1
Penyelesaian:
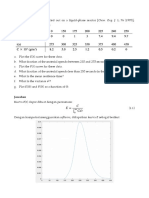
a. Plot grafik antara konsentrasi dengan t, diperoleh grafik sebagai berikut.
Gambar 5. Grafik Hubungan antara CA vs t
Kolom 1 Kolom 2 Kolom 3 Kolom 4 Kolom 5
Waktu t, s Konsentrasi Slope, dari gambar 5 (dCA/dt) Log10 Log10CA
CA, mol/liter (-dCA/dt)
0 10 (10-0)/ (0-75) =-0.1333 -0.875 1.000
20 8 (10-0)/ (-3-94) =-1.1031 -0.987 0.903
40 6 (10-0)/ (-21-131) =-0.0658 -1.182 0.778
60 5 (8-0)/ (-15-180) =-0.0410 -1.387 0.699
120 3 (6-0)/ (-10-252) =-0.0238 -1.623 0.477
180 2 (4-1)/ (24-255) =-0.0108 -1.967 0.301
300 1 (3-1)/ (-10-300) =-0.0065 -2.187 0.000
b. Persamaan order reaksi ke-n
𝑑𝐶𝐴
−𝑟𝐴 = = 𝑘𝐶𝐴𝑛
𝑑𝑡
Kemudian persamaan diatas dibuat dalam bentuk log
𝑑𝐶𝐴
𝑙𝑜𝑔10 (− ) = 𝑙𝑜𝑔10 𝑘 + 𝑛𝑙𝑜𝑔10 𝐶𝐴
𝑑𝑡
𝑑𝐶𝐴
c. Plot grafik 𝑙𝑜𝑔10 (− ) vs 𝑙𝑜𝑔10 𝐶𝐴 sehingga diperoleh grafik sebagi berikut.
𝑑𝑡
𝑑𝐶𝐴
Gambar 6. Grafik Hubungan antara (− ) vs 𝑙𝑜𝑔10 𝐶𝐴
𝑑𝑡
Dari grafik maka didapatkan slope sebesar 1,43 dan k sebesar 0,005
Anda mungkin juga menyukai
- RTD ANALISISDokumen53 halamanRTD ANALISISdino ileyBelum ada peringkat
- KINETIKA DAN KATALISISDokumen41 halamanKINETIKA DAN KATALISISRizka Rinda PramastiBelum ada peringkat
- Tugas Kimia Dasar - Teknik Geologi 2017Dokumen5 halamanTugas Kimia Dasar - Teknik Geologi 2017Iqbal Muhammad FajarBelum ada peringkat
- Cover MAKALAH KimfisDokumen35 halamanCover MAKALAH KimfisFauzan HantoroBelum ada peringkat
- Tugas 2Dokumen10 halamanTugas 2Siti Hafidzotur RBelum ada peringkat
- Prob 8 Dan Prob 9Dokumen9 halamanProb 8 Dan Prob 9Daning Kinanti SutamaBelum ada peringkat
- BAB III-cetakDokumen20 halamanBAB III-cetakErlangga Aria PratamaBelum ada peringkat
- Solusi Soal Hidrolisis EsterDokumen6 halamanSolusi Soal Hidrolisis EsterJannatulBelum ada peringkat
- Tugas Kelompok - TRK 2-03 - Kelompok 7Dokumen25 halamanTugas Kelompok - TRK 2-03 - Kelompok 7Adam Haikal SahadewoBelum ada peringkat
- Metode Waktu ParuhDokumen30 halamanMetode Waktu ParuhElenna WardaniBelum ada peringkat
- KinetikaDokumen11 halamanKinetikaYunita SariBelum ada peringkat
- REAKSI KIMIA OZONDokumen6 halamanREAKSI KIMIA OZONEvi LutfianiBelum ada peringkat
- Tugas 1 - Kelompok 1 - TRK II CDokumen8 halamanTugas 1 - Kelompok 1 - TRK II Camanda novrizaBelum ada peringkat
- Asistensi Kimia Fisika UAS 2023Dokumen9 halamanAsistensi Kimia Fisika UAS 2023Puput NurlizanBelum ada peringkat
- PENGONTROLAN PIDokumen68 halamanPENGONTROLAN PIdilacantikBelum ada peringkat
- MATLAB_ARRAYDokumen5 halamanMATLAB_ARRAYFarhan'zBelum ada peringkat
- Qurratu Aini Alya Adzkia - 1801188Dokumen6 halamanQurratu Aini Alya Adzkia - 1801188alya adzkiaBelum ada peringkat
- Arrhenius EnergiDokumen10 halamanArrhenius Energikurnia lenggogeniBelum ada peringkat
- Tugas 2 TRK LanjutDokumen23 halamanTugas 2 TRK LanjutLailyBelum ada peringkat
- Tugas 4 - Kelompok 7Dokumen85 halamanTugas 4 - Kelompok 7Muhammad Rahmadya PermanaBelum ada peringkat
- Laju Awal Teori yDokumen12 halamanLaju Awal Teori ydhiyaulBelum ada peringkat
- RL2TEADokumen11 halamanRL2TEARIKA SEPTIBelum ada peringkat
- Contoh Soal Metode Isolasi DythaDokumen8 halamanContoh Soal Metode Isolasi DythaDytha FlorenzaBelum ada peringkat
- Contoh-Contoh SimulasiDokumen7 halamanContoh-Contoh SimulasiN DesfajayaBelum ada peringkat
- 16-11. The Volumetric Ow Rate Through A Reactor Is 10 Dm3/min. A Pulse Test Gave The Following Concentration Measurements at The OutletDokumen9 halaman16-11. The Volumetric Ow Rate Through A Reactor Is 10 Dm3/min. A Pulse Test Gave The Following Concentration Measurements at The Outletnisa methildaarBelum ada peringkat
- Regresi Linier - Soal Pra Praktikum Minggu Ke-1 Senin SiangDokumen2 halamanRegresi Linier - Soal Pra Praktikum Minggu Ke-1 Senin Siangandono kusuma jatiBelum ada peringkat
- Tugas SoalDokumen15 halamanTugas SoalIrfan BaharuddinBelum ada peringkat
- Tugas Ke-3 KINKAT Kelompok 2Dokumen5 halamanTugas Ke-3 KINKAT Kelompok 2Novelia Ananda FitrilaBelum ada peringkat
- Tugas04 YonatanDokumen6 halamanTugas04 YonatanJonatan SimbolonBelum ada peringkat
- REAKSI TERMAL CRACKING NONANADokumen29 halamanREAKSI TERMAL CRACKING NONANAMuhammad NazirullahBelum ada peringkat
- 11 - Perhitungan Dan Estimasi NumerikDokumen29 halaman11 - Perhitungan Dan Estimasi NumerikAnnisa IstiqomahBelum ada peringkat
- 6 8Dokumen3 halaman6 8Derlia Mutiara SariBelum ada peringkat
- Latihan Sa - DyDokumen3 halamanLatihan Sa - DyAde YogaBelum ada peringkat
- TuuuDokumen44 halamanTuuuHasbi AsshidiqiBelum ada peringkat
- Simulasi R-Batch (Isothermal & Non Isothermal)Dokumen3 halamanSimulasi R-Batch (Isothermal & Non Isothermal)Lauren RandoBelum ada peringkat
- ADSORPSI CARBON AKTIFDokumen4 halamanADSORPSI CARBON AKTIFlutfiahBelum ada peringkat
- Laprak 3 SisKen - Ramadhan Faddilah - 1903025036Dokumen6 halamanLaprak 3 SisKen - Ramadhan Faddilah - 1903025036Ramadhan Faddilah AkbarBelum ada peringkat
- PP Ganjil 20162017 FelixDokumen6 halamanPP Ganjil 20162017 FelixFebryan CaesarBelum ada peringkat
- Perhitungan Dengan ExcelDokumen34 halamanPerhitungan Dengan ExcelHeartsperienceBelum ada peringkat
- KINETIKA REAKSI GASDokumen4 halamanKINETIKA REAKSI GASkampus merdeka21Belum ada peringkat
- Kinetika ReaksiDokumen49 halamanKinetika ReaksiRenny Eka DhamayantiBelum ada peringkat
- LL Proteksi Arus Lebih 3 Phasa Aditya DacostaDokumen19 halamanLL Proteksi Arus Lebih 3 Phasa Aditya DacostaAditya DacostaBelum ada peringkat
- KINETIKA DAN KATALISISDokumen41 halamanKINETIKA DAN KATALISISANIS SAPUTRIBelum ada peringkat
- PR 2 TRKDokumen26 halamanPR 2 TRKFebryan CaesarBelum ada peringkat
- MATRIKULASIDokumen4 halamanMATRIKULASIIma RachmahBelum ada peringkat
- JUDULDokumen3 halamanJUDULTri YaniBelum ada peringkat
- Dasar Teori Kinetika Saponifikasi Etil AsetatDokumen17 halamanDasar Teori Kinetika Saponifikasi Etil AsetatAlifBelum ada peringkat
- Kinetika Reaksi Kimia Dalam Pengolahan PanganDokumen31 halamanKinetika Reaksi Kimia Dalam Pengolahan PanganNadia PraditasariBelum ada peringkat
- Aplikasi fzero untuk mencari akar fungsiDokumen8 halamanAplikasi fzero untuk mencari akar fungsideka irawanBelum ada peringkat
- Tugas TRK Supariyanto 2Dokumen5 halamanTugas TRK Supariyanto 2SupariyantoBelum ada peringkat
- KINETIKA REAKSIDokumen15 halamanKINETIKA REAKSIhanis mileniaBelum ada peringkat
- p5 Bab3Dokumen9 halamanp5 Bab3PuLung SambadhaBelum ada peringkat
- Soal Dan Jawaban UAS Kimia Fisika 2015Dokumen3 halamanSoal Dan Jawaban UAS Kimia Fisika 2015Fadhillah AnsyariBelum ada peringkat
- Dy Bank Soal Dan Penyelesaian1Dokumen28 halamanDy Bank Soal Dan Penyelesaian1Devina Dwiki100% (2)
- Assignment 3 Reaktor Non-IsotermalDokumen59 halamanAssignment 3 Reaktor Non-Isotermalzio kakaBelum ada peringkat
- Energi AktivasiDokumen8 halamanEnergi AktivasiNur RayyanBelum ada peringkat
- Jawaban TRKDokumen14 halamanJawaban TRKMark PhilipBelum ada peringkat
- Paralel B - Sesi Ganjil - Grup F - Lapres KristalisasiDokumen76 halamanParalel B - Sesi Ganjil - Grup F - Lapres KristalisasiMegawati Setiawan PutriBelum ada peringkat
- Megawati Setiawan Putri - Metode Newton Rhapson Metode Secant Dan Metode IterasiDokumen7 halamanMegawati Setiawan Putri - Metode Newton Rhapson Metode Secant Dan Metode IterasiMegawati Setiawan PutriBelum ada peringkat
- Lapres - Paralel B - Sesi Ganjil - Grup F - deDokumen47 halamanLapres - Paralel B - Sesi Ganjil - Grup F - deMegawati Setiawan PutriBelum ada peringkat
- Tugas IDokumen1 halamanTugas IErza NggaraBelum ada peringkat
- Paralel B - Sesi Ganjil - Grup FDokumen8 halamanParalel B - Sesi Ganjil - Grup FMegawati Setiawan PutriBelum ada peringkat
- MatekkDokumen8 halamanMatekkMegawati Setiawan PutriBelum ada peringkat
- Tes AwalDokumen12 halamanTes AwalMegawati Setiawan PutriBelum ada peringkat
- MatekDokumen6 halamanMatekMegawati Setiawan PutriBelum ada peringkat
- Matekk .Dokumen12 halamanMatekk .Megawati Setiawan PutriBelum ada peringkat
- Megawati Setiawan Putri - Pemrograman Pascal Dan Aplikasi Matlab - LapresDokumen27 halamanMegawati Setiawan Putri - Pemrograman Pascal Dan Aplikasi Matlab - LapresMegawati Setiawan PutriBelum ada peringkat
- Lapres Modul 5 Looping Statement Dalam Bahasa PascalDokumen18 halamanLapres Modul 5 Looping Statement Dalam Bahasa PascalMegawati Setiawan PutriBelum ada peringkat
- Pemrograman Pascal Dan Matlab: Megawati Setiawan Putri 19031010056/PARALEL B/SESI GENAPDokumen9 halamanPemrograman Pascal Dan Matlab: Megawati Setiawan Putri 19031010056/PARALEL B/SESI GENAPMegawati Setiawan PutriBelum ada peringkat
- Megawati Setiawan Putri - Tugas 1 TRK IDokumen1 halamanMegawati Setiawan Putri - Tugas 1 TRK IMegawati Setiawan PutriBelum ada peringkat
- OPTIMASI DAFTAR ISI OTOMATISDokumen16 halamanOPTIMASI DAFTAR ISI OTOMATISMegawati Setiawan PutriBelum ada peringkat
- Megawati Setiawan Putri - Tugas 1 TRK IDokumen1 halamanMegawati Setiawan Putri - Tugas 1 TRK IMegawati Setiawan PutriBelum ada peringkat
- Megawati Setiawan Putri - Tugas 1 TRK IDokumen1 halamanMegawati Setiawan Putri - Tugas 1 TRK IMegawati Setiawan PutriBelum ada peringkat
- Megawati Setiawan Putri - Pemrograman Pascal Dan Aplikasi Matlab - LapresDokumen27 halamanMegawati Setiawan Putri - Pemrograman Pascal Dan Aplikasi Matlab - LapresMegawati Setiawan PutriBelum ada peringkat
- TINJAUAN PUSTAKADokumen4 halamanTINJAUAN PUSTAKAMegawati Setiawan PutriBelum ada peringkat
- Kebersamaan Dalam Pluralitas Agama 2Dokumen15 halamanKebersamaan Dalam Pluralitas Agama 2Megawati Setiawan PutriBelum ada peringkat