BAB III-cetak
Diunggah oleh
Erlangga Aria PratamaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
BAB III-cetak
Diunggah oleh
Erlangga Aria PratamaHak Cipta:
Format Tersedia
BAB III
PENGUMPULAN DAN PENGOLAHAN DATA
3.1. INTERPRETASI
Interpretasi data adalah bagaimana kita mengolah data kinetika dari
hasil suatu percobaan untuk menentukan parameter kinetika (order reaksi dan
konstanta kecepatan reaksi). Data kinetika yang diperlukan untuk
menentukan order reaksi dan konstanta kecepatan reaksi berupa data
konsentrasi (atau tekanan) sebagai fungsi waktu. Metode interpretasi data
kinetika ada berbagai cara, antara lain metode diferensial, metode kecepatan
awal, metode integral, dan metode setengah umur.
3.2. DATA REAKTOR BATCH
Reaktor batch digunakan untuk menentukan parameter kinetika (oder
reaksi dan konstanta kecepatan reaksi) pada reaksi homogen. Data kinetika
tersebut yang dibutuhkan adalah konsentrasi fungsi waktu. Selanjutnya
ditentukan order reaksi dan konstanta kecepatan reaksi dengan menggunakan
metode analisis data secara diferensial atau integral. Jika data yang ada tidak
berupa data konsentrasi (misalnya tekanan) maka neraca mol harus dibuat
berdasarkan parameter yang terukur tersebut.
3.3.1. METODE DIFERENSIAL
3.3.1. Metode Diferensial untuk Data Percobaan Tunggal
Dalam sebuah studi kinetika, seseorang mengukur (langsung atau
tidak langsung) konsentrasi satu atau lebih reaktan dan atau produk sebagai
fungsi waktu. Jika konsentrasi fungsi waktu diplot menjadi sebuah grafik
maka seharusnya didapatkan grafik yang smooth.
Jika reaksi irreversible, kita dapat menentukan order reaksi dan
konstanta kecepatan reaksi dengan diferensiasi numeris pada data konsentrasi
versus waktu. Metode ini dapat diterapkan jika reaksi tersebut hanya
merupakan fungsi satu buah reaktan. Contohnya adalah reaksi dekomposisi :
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 31
A produk
-rA = kCAa (3-1)
Namun demikian, dengan menggunakan metode ekses ,
dimungkinkan untuk menentukan hubungan antara –r A dan konsentrasi
reaktan lainnya. Yaitu pada reaksi irreversible :
A + B produk
Dengan persamaan kecepatan reaksi:
-rA = kCAaCBb (3-2)
dan a dan b belum diketahui. Reaksi pertama-tama dijalankan pada
konsentrasi B berlebihan sehingga CB dapat dianggap konstan. Persamaan
kecepatan reaksi dituliskan sebagai berikut:
-rA = k’CAa (3-3)
dengan, k’ = kCBb = kCB0b
Setelah a ditentukan kemudian reaksi dijalankan pada konsentrasi A
berlebihan sehingga konsentrasi A dapat dianggap konstan. Persamaan
kecepatan reaksi dapat dituliskan sebagai berikut:
-rA = k”CBb (3-4)
Satuan konstanta kecepatan reaksi masing-masing adalah:
rA = mol/dm3.s
k = rA / CAa CBb = (dm3/mol)a+b-1/s
k” = kCAa = kCA0a
k” = (dm3/mol)b-1/s
k’ = kCBb = kCB0b
k’ = (dm3/mol)a-1/s
Baik a maupun b dapat ditentukan dengan metode ekses dan dikombinasikan
dengan analisa diferensial pada data system batch.
Untuk menjelaskan metode diferensial tersebut maka digunakan
reaksi pada volume tetap, reaktor batch, dan data konsentrasi fungsi waktu.
Dicoba persamaan kecepatan reaksi :
(3-5)
32 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
Masing-masing suku dikenakan logaritma natural sehingga diperoleh:
(3-6)
Jika ln(-dCA/dt) diplot versus lnCA maka akan diperoleh garis lurus
dengan slope a. Salah satu cara untuk mendapatkan harga adalah
dengan cara membagi waktu menjadi jarak waktu yang sama, misalnya
waktu dibagi menjadi t0, t1, dan t2 dimana t1-t0 = t2-t1=Δt :
Waktu t0 t1 t2
konsentrasi CA0 CA1 CA2
Formula diferensiasi tiga titik:
(3-7)
(3-8)
(3-9)
dapat digunakan untuk menghitung harga . Persamaan (3-7) dan (3-
9) digunakan untuk titik pertama dan titik terakhir pada data, sedangkan
persamaan (3-8) digunakan secara umum untuk titik-titik yang ada di tengah
data. Setelah itu maka dapat diplot grafik versus ln CA
Contoh soal 3.1
Tentukan order reaksi pada dekomposisi fase gas di-tert-butyl
peroxide, :
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 33
Reaksi ini dijalankan dalam laboratorium dalam system batch secara
isotermal. Tekanan total selama reaksi dicatat pada berbagai waktu. Data
ditampilkan pada Tabel 3.1. Reaksi dijalankan pada komposisi awal hanya
berupa di-tert-butyl peroxide.
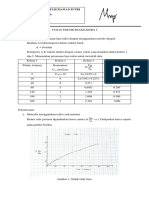
Tabel 3.1. Tabel hubungan waktu reaksi dan tekanan total sistem
Waktu (menit) Tekanan total (mmHg)
0,0 7,5
2,5 10,5
5,0 12,5
10,0 15,8
15,0 17,9
20,0 19,4
Penyelesaian:
Jika tidak ada perubahan mol pada reaksi fase gas, percobaan dianggap
berlangsung pada volume tetap. Jika A mewakili di-tert-butyl peroxide maka
dapat diajukan persamaan reaksi sebagai berikut:
(3E.1-1)
Harga k dan a ditentukan berdasarkan data pada Tabel 3.1. Karena data
disajikan dalam bentuk tekanan total maka konsentrasi harus dinyatakan
dalam bentuk tekanan total.
Untuk reaksi yang berlangsung pada reactor batch maka berlaku persamaan
sebagai berikut:
(3E.1-2)
(3E.1-3)
Jika reaksi berlangsung pada volume konstan dan isotermal, maka persamaan
dapat diubah menjadi:
34 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
(3E.1-4)
(3E.1-5)
dengan PA0 = yA0.P0
Jika disubstitusikan pada persamaan di atas maka:
(3E.1-6)
Karena awalnya berupa di-tert-butyl peroxide murni maka y A0 = 1 sehingga
PA0 = P0. Berdasarkan persamaan reaksi δ = 1+2-1 = 2
(3E.1-7)
(3.E.1-8)
Jika k’ = k(2RT)1-a , maka:
(3E.1-9)
(3E.1-10)
Order reaksi dapat ditentukan dengan melakukan plot grafik antara ln(dP/dt)
versus ln(3P0 – P). Jika a sudah didapatkan maka k’ dapat dihitung dari
persamaan :
(3E.1-11)
pada setiap titik.
dP/dt ditentukan dengan perhitungan dan plotting ∆P/∆t sebagai fungsi
waktu.
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 35
Tabel 3.2. Tabel hubungan waktu dan perubahan tekanan
T (menit) P
(mmHg)
0,0 7,5 1,44
1,20
2,5 10,5 0,95
0,80
5,0 12,5 0,74
0,66
10,0 15,8 0,53
0,42
15,0 17,9 0,34
0,30
20,0 19,4 0,25
Temperatur = 170 oC
Kemudian dP/dt dihitung menggunakan formula:
t = 0 :
t = 2,5 :
t = 5 :
t = 10 :
t = 15 :
36 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
t = 20 :
Selanjutnya dihitung harga ln(dP/dt) dan ln(3P0-P) :
t, menit dP/dt (3P0-P) Ln(dP/dt) Ln(3P0-P)
0 1.4 15 0.336472 2.70805
2.5 1 12 0 2.484907
5 0.78 10 -0.24846 2.302585
10 0.54 6.7 -0.61619 1.902108
15 0.36 4.6 -1.02165 1.526056
20 0.24 3.1 -1.42712 1.131402
Berdasarkan persamaan (3E.1-10) maka dibuat grafik hubungan ln(dP/dt)
fungsi ln(3P0-P) sebagai berikut :
Dari grafik diperoleh:
Slope = a =1,087
Intersep = Ln k’ = -2,6805 , sehingga harga k’= 0,069
3.3.2. Metode Kecepatan Awal
Penggunaan metode diferensial untuk penentuan order reaksi dan
konstanta kecepatan reaksi merupakan langkah yang paling mudah karena
hanya memerlukan satu percobaan. Namun demikian cara ini tidak tepat jika
ada reaksi balik yang cukup signifikan. Jika kondisi ini terjadi maka cara
yang dapat digunakan untuk menentukan order reaksi dan konstanta
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 37
kecepatan reaksi adalah metode kecepatan awal (initial rates). Cara ini
dipakai dengan melakukan percobaan berulang-ulang yang dilakukan pada
konsentrasi awal ,CA0, yang berbeda-beda dan kecepatan reaksi awal (-r A0)
ditentukan untuk masing-masing percobaan. Jika persamaan kecepatan reaksi
:
-rA0 = kCA0a
Jika diplot grafik ln(-rA0) versus lnCA0 maka diperoleh grafik berupa garis
lurus dengan slope a yang menunjukkan order reaksi.
Contoh soal 3.2:
Data kecepatan reaksi awal berikut diambil dari reaksi fase gas pada 114 oC :
B2H6 + 4Me2CO 2(Me2CHO)2BH
Run Tekanan awal (torr) Kec. Awalx103
(torr/sec)
B2H6 Me2CO
1 6,0 20,0 0,5
2 8,0 20,0 0,63
3 10,0 20,0 0,83
4 12,0 20,0 1,00
5 16,0 20,0 1,28
6 10,0 10,0 0,33
7 10,0 20,0 0,80
8 10,0 40,0 1,50
9 10,0 60,0 2,21
10 10,0 100,0 3,33
Jika persamaan kecepatan reaksi diperkirakan berbentuk:
38 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
Tentukan harga n, m, dan k. Pastikan k dalam satuan yang benar.
Jawab:
Harga n ditentukan pada keadaan tekanan Me 2CO konstan (20 torr), sehingga
persamaan kecepatan reaksi dapat ditulis:
Ln(Rate) = Ln k’ + n Ln(PB2H6)
P0 (torr) Rate awal Ln(Rate awal) Ln(P0)
6 0.5 -0.693147181 1.791759
8 0.63 -0.46203546 2.079442
10 0.83 -0.186329578 2.302585
12 1 0 2.484907
16 1.28 0.246860078 2.772589
Dibuat grafik Ln (Rate awal) fungsi Ln (P0) sebagai berikut:
Dari grafik didapatkan :
Slope = n = 0,99
Intersep = ln k’ = -2,4718 , sehingga k’ = 0,084
Karena k’ = k.200,99 maka k = 0,0043
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 39
Untuk menentukan harga m maka dipilih data pada saat tekanan awal B 2H6
konstan yaitu pada P0 = 10 torr. Persamaan kecepatan reaksi dituliskan
sebagai berikut:
Ln (Rate) = ln(k’) + m ln (PMe2CO)
Data diolah pada saat awal reaksi :
P0(torr) Rate awal Ln(Rate awal) Ln(P0)
10 0.33 -1.108662625 2.302585
20 0.8 -0.223143551 2.995732
40 1.5 0.405465108 3.688879
60 2.21 0.792992516 4.094345
100 3.33 1.202972304 4.60517
Selanjutnya dibuat grafik antara Ln (Rate awal) vs Ln(P0)
Berdasarkan grafik di atas maka diperoleh:
Slope = m = 0,995 = 1
Ln(k’) = -3,3084 , sehingga k’ = 0,037
k’ = k.10 maka k = 0,0037
Berdasarkan percobaan 1 dan 2 maka didapatkan bahwa :
Order reaksi terhadap B2H6 = n = 0,99 ~ 1
Order reaksi terhadap Me2CO = m = 995 ~ 1
Konstant kecepatan reaksi k = (0,0043 + 0.0037)/2 = 0,004 (torr.s)-1
3.4. METODE INTEGRAL
40 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
Untuk menentukan order reaksi menggunakan metode integral,
pertama harus kita tebak bentuk persamaan kecepatan reaksi kemudian kita
integralkan persamaan diferensial tersebut pada system batch. Selanjutnya
dilakukan ploting data pada grafik sehingga diperoleh grafik linear yang
sesuai dengan bentuk hubungan pada persamaan.
3.4.1. Reaksi order nol
Misalkan kita tebak reaksi berikut merupakan reaksi order nol:
A Produk
(3-10)
dengan mengintegrasikan dari CA = CA0 pada saat t = 0 sampai CA = CA pada
saat t = t maka didapatkan :
CA = CA0 – kt (3-11)
Jika persamaan (5-11) diplot grafik antara C A versus waktu maka akan
didapatkan garis lurus dengan slope (-k).
3.4.2. Reaksi oder Satu
Persamaan kecepatan reaksi order satu adalah:
(3-
12)
Persamaan (5-12) diintegrasikan dengan harga batas C A = CA0 pada saat t = 0
dan CA = CA pada saat t = t, dan diperoleh persamaan sebagai berikut:
(3-13)
Jika kita plot grafik ln(CA0/CA) versus t maka berdasarkan persamaan (3-13)
akan diperoleh garis lurus dengan slope k.
3.4.3. Reaksi order dua
Persamaan kecepatan reaksi order dua adalah:
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 41
(3-14)
Jika persamaan (5-14) diintegrasikan dengan harga batas CA = CA0 pada
saat t = 0 dan CA = CA pada saat t = t maka akan diperoleh persamaan
berikut:
(3-15)
Berdasarkan persamaan (5-15), jika kita plot grafik 1/C A versus t maka akan
didapatkan garis lurus dengan slope k.
Contoh soal 3.4
Hinshelwood dan Askey telah meneliti dekomposisi dimetil eter fase gas
menurut reaksi seperti berikut:
CH3OCH3 CH4 + CO + H2
E B + C + D
o
Data berikut diperoleh dari reaksi isothermal (552 C) dan volume konstan.
Waktu, detik Tekanan, mmHg
0 420
57 584
85 662
114 743
145 815
182 891
219 954
261 1013
299 1054
Gunakan metode integral untuk menentukan harga order reaksi dan konstanta
kecepatan reaksi !
Jawab:
Kecepatan reaksi diperkirakan memiliki order satu terhadap reaktan (E).
Persamaan kecepatan reaksi order satu adalah:
42 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
(3E.3-1)
Persamaan (3E.3-1) diintegralkan pada harga batas CE = CE0 pada t = 0 dan
CE = CE pada t = t. Hasil integrasi tersebut adalah:
(3E.3-2)
Karena data yang tersedia dalam bentuk tekanan maka konsentrasi harus
diubah dalam bentuk tekanan. Hubungan konsentrasi dengan tekanan
dianggap mengikuti Hukum Gas Ideal, yaitu:
(3E.3-3)
dengan yE adalah fraksi gas E dan Pt adalah tekanan total. Kombinasi
persamaan (3E.3-2) dan (3.E.3-3) menghasilkan persamaan sebagai berikut:
(3E.3-4)
Neraca mol reaksi ,jika ξ menunjukkan jumlah mol E yang bereaksi, adalah
sebagai berikut:
Waktu, t 0 t ~
Jumlah mol
E n0 n0-ξ 0
B 0 ξ n0
C 0 ξ n0
D 0 ξ n0
Jumlah mol n0 n0+2 ξ 3 n0
Tekanan P0 Pt 3P0
Pada fase gas, perbandingan mol = perbandingan tekanan, sehingga:
(3E.3-5)
Fraksi mol ether pada waktu t adalah:
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 43
(3E.3-6)
Kombinasi persamaan (3E.3-5) dan (3E.3-6) menghasilkan persamaan
sebagai berikut:
(3E.3-7)
Substitusi persamaan (3E.3-7) ke persamaan (3E.3-4) menghasilkan
persamaan berikut:
(3E.3-8)
(3E.3-9)
Plotting grafik versus t akan menghasilkan garis lurus dengan
slope –k dan intersep ln 2P0.
T, detik P, mmHg (3P0-Pt) Ln(3P0-Pt)
0 420 840 6.733402
57 584 676 6.516193
85 662 598 6.393591
114 743 517 6.248043
145 815 445 6.098074
182 891 369 5.910797
219 954 306 5.723585
261 1013 247 5.509388
299 1054 206 5.327876
Hasil plotting grafik ln(3P0-Pt) versus t adalah sebagai berikut:
44 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
Dari grafik terlihat bahwa slope = -k = -0,0048 sehingga k = 0,0048 det-1.
3.4.4. Metode Setengah Umur
Setengah umur reaksi adalah waktu dimana reaksi telah berlangsung
sehingga konsentrasi reaktan tinggal setengah konsentrasi awal. Dengan
menentukan setengah umur suatu reaksi, order reaksi dan konstanta
kecepatan reaksi dapat ditentukan. Jika dalam reaksi kimia terlibat dua
reaktan maka digunakan metode ekses sehingga persamaan kecepatan reaksi
dapat diwakili dengan bentuk:
(3-16)
Jika reaksi berlangsung seperti di bawah ini:
A produk
Persamaan kecepatan reaksi dituliskan seperti berikut:
(3-17)
Persamaan (3-17) diintegrasikan dalam harga batas C A = CA0 pada saat t = 0,
sehingga didapat persamaan:
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 45
(3-
18)
Waktu setengah umur adalah waktu yang dibutuhkan agar konsentrasi
reaktan tinggal setengah konsentrasi awal, atau :
t = t1/2 ketika CA = ½ CA0
Jika CA disubstitusikan ke persamaan (3-18) maka akan kita dapatkan:
(3-
19)
Persamaan (3-19) dapat digunakan untuk mengolah data kinetika ketika
konsentrasi reaktan menjadi ½ dari konsentrasi semula. Persamaan (3-19)
dapat dimodifikasi sehingga dapat digunakan untuk mengolah data ketika
konsentrasi reaktan turun menjadi 1/n dari konsentrasi semula. Persamaan (3-
19) menjadi sebagai berikut:
(3-
20)
Jika dikenakan logaritma natural pada persamaan (3-19) maka akan diperoleh
persamaan sebagai berikut:
(3-21)
Jika diplot grafik Ln t1/2 fungsi Ln CA0 akan didapatkan garis lurus dengan
slope (1-a).
3.5. INTERPRETASI DATA REAKTOR DIFERENSIAL
Akuisisi data menggunakan metode kecepatan awal (initial rate) dan
reactor diferensial memiliki kesamaan dalam hal kecepatan reaksi ditentukan
pada posisi konsentrasi reaktan yang masuk. Reaktor diferensial biasanya
digunakan untuk menentukan kecepatan reaksi sebagai fungsi konsentrasi
46 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
pada system heterogen. Reaktor diferensial terdiri dari sebuah pipa yang
berisi sedikit katalis yang berbentuk cakram tipis. Karena katalis yang
digunakan sangat sedikit maka konversi reaktan cukup kecil sehingga
konsentrasi reaktan bisa dianggap konstan dan sama (mendekati) dengan
konsentrasi umpan serta kecepatan reaksi sepanjang katalis dapat dianggap
tetap.
Dalam percobaan dengan reactor diferensial dimonitor kecepatan
volumetric dalam katalis dan konsentrasi pada posisi umpan dan keluar
reactor. Jika diketahui berat katalis adalah W, kecepatan reaksi per unit
massa katalis (rA’) dapat dihitung. Karena reactor diferensial dianggap tidak
ada perubahan sepanjang katalis maka persamaan perancangan sama dengan
persamaan pada reaktor alir tangki berpengaduk.
FAe, Fp, Cp
FA0
CA0
Gambar 3.1. Bed Reaktor Diferensial
Pada keadaan steady state, neraca mol reaktan A disusun sebagai berikut:
[Kec. Alir masuk] – [kec. Alir keuar] + [kec. Pembentukan] = [kec.
Akumulasi]
[FA0] – [FAe] + (+rA’)W = 0
sehingga :
(3.20)
atau dinyatakan dalam konsentrasi seperti berikut:
(3.21)
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 47
atau dinyatakan dalam konversi atau kecepatan produk:
(3-22)
Jika koefisien stoikhiometris A dan P sama maka FA0X berarti kecepatan
pembentukan produk Fp.
Apabila kecepatan volumetric tetap maka persamaan (3-21) dapat
disederhanakan menjadi:
(3-
23)
Karena penggunaan katalis sangat sedikit dan kecepatan volumetric tinggi
maka dapat dianggap bahwa CA0 – Cae sangat kecil dan kecepatan reaksi
yang ditentukan dengan persamaan (3-23) merupakan fungsi konsentrasi
pada katalis, CAb. Persamaan (3-23) berubah menjadi:
(3-24)
Konsentrasi dalam katalis dapat didekati dengan nilai rata-rata konsentrasi
masuk dan keluar katalis:
(3-25)
Namun demikian, karena reaksi yang terjadi dalam katalis sangat sedikit
maka konsentrasi dalam katalis dapat dianggap sama dengan konsentrasi inlet
(CA0). Sehingga
(3-26)
Persamaan (3-26) dapat digunakan untuk menentukan persamaan kecepatan
reaksi menggunakan metode kecepatan awal (initial rate).
3.6. SOAL-SOAL LATIHAN
1. Huang dan Dauerman (ind. Eng. Chem. Product research dan
Development, 8 (227), 1969) telah memperlajari reaksi asetilasi benzyl
chloride dalam larutan encer pada 102 oC.
NaAc + C6H5CH2Cl C6H5CH2Ac + Na+ + Cl-
48 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
Menggunakan konsentrasi ekuimolal sodium asetat dan benzyl chloride
(0,757 kmol/m3), mereka melaporkan data berikut :
Waktu, (ksec) (C6H5CH2Cl)/( C6H5CH2Cl)0
10,80 0,945
24,48 0,912
46,08 0,846
54,72 0,809
69,48 0,779
88,56 0,730
109,44 0,678
126,72 0,638
133,74 0,619
140,76 0,590
Tentukan order reaksi dan konstanta kecepatan reaksi pada temperatur
tersebut.
2. Dekomposisi hexaphenylethane menjadi triphenylmethyl radikal dalam
cairan khloroform telah dipelajari pada suhu 0 oC.
Reaksi berlangsung sebagai berikut:
(C6H5)3CC(C6H5)3 2(C6H5)3C
Hasilnya sebagai berikut:
Waktu, sec. C/Co untuk Hexaphenylethane
0 1,000
17,4 0,941
35,4 0,883
54,0 0,824
174,0 0,530
209 0,471
313 0,324
367 0,265
Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor 49
434 0,206
584 0,118
759 0,059
Tentukan order reaksi dankonstanta kecepatan reaksi baik dengan metode
diferensial maupun integral. Untuk order selain order satu maka diperlukan
Co. Jika ya, gunakan pada konstanta kecepatan reaksi.
50 Reaksi Homogen : Tinjauan Kinetika Reaksi dan Perancangan Reaktor
Anda mungkin juga menyukai
- Tugas 2 TRKDokumen22 halamanTugas 2 TRKNurul RamadhaniBelum ada peringkat
- Orde ReaksiDokumen15 halamanOrde ReaksiAchsan ArfandiBelum ada peringkat
- Kinetika Kimia KF 2 - OseuDokumen10 halamanKinetika Kimia KF 2 - OseuDini RetaniaBelum ada peringkat
- BAB III Interpretasi DataDokumen18 halamanBAB III Interpretasi DataNafilah Insan BestariBelum ada peringkat
- TK2202 - Teknik Reaksi Kimia 1 - UTS 1 - CompiledDokumen29 halamanTK2202 - Teknik Reaksi Kimia 1 - UTS 1 - Compiledpanji rahmanBelum ada peringkat
- Faktor Frekuensi (Ko)Dokumen5 halamanFaktor Frekuensi (Ko)Santi SavitriBelum ada peringkat
- 1010 - Materi Kuliah Kinetika Dan Reaktor Homogen Pertemuan 3 2020 PDFDokumen48 halaman1010 - Materi Kuliah Kinetika Dan Reaktor Homogen Pertemuan 3 2020 PDFRifki Amirul HakimBelum ada peringkat
- Metode Analisis Kinetik DataDokumen32 halamanMetode Analisis Kinetik DataArdha BariqBelum ada peringkat
- Bab 2Dokumen16 halamanBab 2Arif BspBelum ada peringkat
- Dy Bank Soal Dan 1Dokumen29 halamanDy Bank Soal Dan 1Muhammad NazirullahBelum ada peringkat
- Tugas Kinetika KimiaDokumen18 halamanTugas Kinetika Kimiakampus merdeka21Belum ada peringkat
- Bab 2Dokumen16 halamanBab 2Dyah SetyaningrumBelum ada peringkat
- Modul Simulasi Proses Periode 1Dokumen42 halamanModul Simulasi Proses Periode 1Lutfia KhasanahBelum ada peringkat
- Dy Bank Soal Dan Penyelesaian1Dokumen28 halamanDy Bank Soal Dan Penyelesaian1Devina Dwiki100% (2)
- Persamaan Laju Reaksi Metode Integrasi Kelompok 1Dokumen15 halamanPersamaan Laju Reaksi Metode Integrasi Kelompok 1Mitha PratiwiBelum ada peringkat
- Interpretation of Batch Reacktor Data: - Rivatul Haerunnisa (3335210048) - Ghina Zalfa Tsabitha (3335210084)Dokumen30 halamanInterpretation of Batch Reacktor Data: - Rivatul Haerunnisa (3335210048) - Ghina Zalfa Tsabitha (3335210084)Riva HaerunnisaBelum ada peringkat
- Laporan Resmi 1 CSTRDokumen31 halamanLaporan Resmi 1 CSTRAnonymous xAnOZRdBelum ada peringkat
- Percobaan 3 Dan 4Dokumen12 halamanPercobaan 3 Dan 4olindepari7Belum ada peringkat
- Kinetika ReaksiDokumen49 halamanKinetika ReaksiFahmi Achmad SaputraBelum ada peringkat
- Latihan Sa - DyDokumen3 halamanLatihan Sa - DyAde YogaBelum ada peringkat
- 13 - Kimia Fisika - KinetikaKimia - 13-Nop - 2013Dokumen41 halaman13 - Kimia Fisika - KinetikaKimia - 13-Nop - 2013Anonymous O1xkZIN100% (2)
- Pertemuan 10-11Dokumen38 halamanPertemuan 10-11Amar RafliBelum ada peringkat
- Kinetika ReaksiDokumen49 halamanKinetika ReaksiRenny Eka DhamayantiBelum ada peringkat
- 14-15 Kinetika Orde ReaksiDokumen51 halaman14-15 Kinetika Orde ReaksiBela100% (1)
- TuuuDokumen44 halamanTuuuHasbi AsshidiqiBelum ada peringkat
- 05 Handout Kinetika Reaksi Homogen Sistem BatchDokumen13 halaman05 Handout Kinetika Reaksi Homogen Sistem BatchRian Pratama STBelum ada peringkat
- Tugas02 02ADokumen41 halamanTugas02 02ASheva Intania Meilan PutriBelum ada peringkat
- BAB-III Analysis Alat Penukar Kalor PDFDokumen13 halamanBAB-III Analysis Alat Penukar Kalor PDFRonald Febrianto KarosekaliBelum ada peringkat
- 6 Analisis Dan Interpretasi Data Kinetika Batch DyDokumen6 halaman6 Analisis Dan Interpretasi Data Kinetika Batch Dyulfa rusianaBelum ada peringkat
- Hukum Laju ReaksiDokumen16 halamanHukum Laju Reaksihera hmBelum ada peringkat
- Kasus Persamaan Differensial Penerapan Pada Reaksi KimiaDokumen3 halamanKasus Persamaan Differensial Penerapan Pada Reaksi KimiaChristine DesyBelum ada peringkat
- KINETIKA - KEL.3 - KterkaitanLajuDgnKonsReaktanDokumen19 halamanKINETIKA - KEL.3 - KterkaitanLajuDgnKonsReaktanSalsabila LuthfiyahBelum ada peringkat
- Bab 2 Kinetika KimiaDokumen69 halamanBab 2 Kinetika KimiaFitrianti Aamiin100% (2)
- Kinetika Reaksi FRZ Genap 2021-2022Dokumen65 halamanKinetika Reaksi FRZ Genap 2021-2022Annisa Tul MardhiahBelum ada peringkat
- Reaktor Ideal Aliran Kontinyu PDFDokumen16 halamanReaktor Ideal Aliran Kontinyu PDFAdrian WijayaBelum ada peringkat
- Megawati Setiawan Putri - Tugas 2 TRK IDokumen5 halamanMegawati Setiawan Putri - Tugas 2 TRK IMegawati Setiawan PutriBelum ada peringkat
- Buble Point Dew PointDokumen4 halamanBuble Point Dew PointdimasfebriantoBelum ada peringkat
- BAB II Kinetika Reaksi HomogenDokumen15 halamanBAB II Kinetika Reaksi HomogenFatih ChemistBelum ada peringkat
- Tugas Kelompok - TRK 2-03 - Kelompok 7Dokumen25 halamanTugas Kelompok - TRK 2-03 - Kelompok 7Adam Haikal SahadewoBelum ada peringkat
- TRK 1 - Materi 1Dokumen27 halamanTRK 1 - Materi 1Marike Bunga HarfintanaBelum ada peringkat
- 4 Kesetimbangan KimiaDokumen23 halaman4 Kesetimbangan KimiaRima Indah PBelum ada peringkat
- Persamaan Arrhenius Dan Energi AktivasiDokumen10 halamanPersamaan Arrhenius Dan Energi Aktivasikurnia lenggogeniBelum ada peringkat
- Lapres Hidrolisis Etil Asetat-1Dokumen32 halamanLapres Hidrolisis Etil Asetat-1Nonik GabriellaBelum ada peringkat
- 11 - Cara DiferensialDokumen21 halaman11 - Cara DiferensialIndra KurniawanBelum ada peringkat
- 04 05 06 Design-Equations-RbDokumen47 halaman04 05 06 Design-Equations-Rbxyber1Belum ada peringkat
- Tugas TRK Terjemah - Ega Assyifa G - 3EGBDokumen8 halamanTugas TRK Terjemah - Ega Assyifa G - 3EGBega assyifaBelum ada peringkat
- Tugas Matematika Kimia Eni Julita 2016Dokumen13 halamanTugas Matematika Kimia Eni Julita 2016enijulita35Belum ada peringkat
- Tugas-Kinetika-2017Dokumen10 halamanTugas-Kinetika-2017Andrean ZukempotBelum ada peringkat
- Kinetika KimiaDokumen17 halamanKinetika KimiaAgung Prawira Negara0% (1)