Presentation 2
Diunggah oleh
yosua0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
24 tayangan13 halamangeeqg
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inigeeqg
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
24 tayangan13 halamanPresentation 2
Diunggah oleh
yosuageeqg
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 13
THERMODINAMIKA
PERUBAHAN ENTROPI PADA PROSES
REVERSIBEL
S PADA PROSES NON-REVERSIBEL
AZAS ENTROPI SERTA PEMAKAIANNYA
SITI KHOTLINA SARI HARAHAP
FRISCYLIA TAMPUBOLON
LELYANA PANJAITAN
ZULKIFLI GIRSANG
8.1 PERUBAHAN ENTROPI PADA PROSES REVERSIBEL
Proses Reversibel :
Proses
termodinamik
yang
dapat
berlanggsung secara bolak-balik.
Sebuah
sistem yang mengalami idealisasi
proses reversibel selalu mendekati keadaan
kesetimbangan termodinamika antara sistem itu
sendiri dan lingkungannya.
Proses
yang dapat dibalik arahnya dinamakan
proses reversibel.
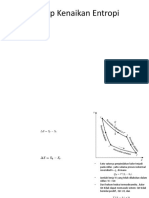
1. PROSES ADIABATIK REVERSIBEL
Proses adiabatis reversibel adalah proses
termodinamika dimana tidak ada kalor yang
masuk atau keluar dari sistem (adiabatis) dan
proses ini mampu balik (reversibel) artinya
tidak ada hambatan atau gesekan. Pada p-V
diagram dapat digambarkan sebagai berikut.
dQ=0, dS=0 ; dS=S=0
2. PROSES ISOTERMAL REVERSIBEL
Pada proses isotermal, temperatur awal proses
akan sama dengan temperatur akhir proses atau
T1 = T2 . kondisi ini menyebabkan dT = 0 sehingga
perubahan energi dalam sistem (dU) = 0.
Suatu
ekspansi
penambahan
entropi
isotermal
dan
menghasilkan
kompresi
menghasilkan pengurangan entropi.
isotermal
3. PROSES ISOKHORIK REVERSIBEL
Pada proses isokhorik, volume awal akan sama
dengan volume akhir gas atau V1 = V2. Bila V1 =
V2 maka dV = 0.
Pada
proses isokhorik atau volume konstan,
tidak ada kerja yang diberikan atau dihasilkan
sistem, karena volume awal dan akhir proses
sama sehingga perubahan volume (dV) adalah
0. Pada proses isokhorik semua kalor yang
diberikan diubah menjadi energi dalam sistem.
4. PROSES ISOBARIK REVERSIBEL
Pada proses tekanan konstan,
tekanan awal proses sama dengan
tekanan akhir proses atau p1= p2 .
Bila p = C maka dp = 0
Usaha yang dilakukan sistem maupun
lingkungan harus memberikan
perubahan volum.Perubahan ini bisa
berupa ekspansi atau kompresi.
5.PERUBAHAN ENTROPI PADA RK
Dengan mengingat sifat RK, bahwa
kalor yang keluar maupun masuk RK
tidak berlangsung secara isotermal,
yakni terjadi pada suhu RK tersebut.
Akan tetapi P dan V RK juga tidak
berubah, maka keadaan
keseimbangannya tidak pernah
terganggu, hingga proses itu selalu
bersifat reversibel.
6.PERUBAHAN ENTROPI SISTEM PERUBAHAN FASE
Perubahan fase adalah proses
isotermal; ia terjadi pada suhu transisi,
selain T yang tidak berubah, biasanya
ada lagi satu kordinat yang tidak
berubah, biasanya tekanan (perubahan
fase pada udara luar). Perubahan
entropi yang diderita sistem dihitung
dari rumus :
8.2 S PADA PROSES NONREVERSIBEL
Proses Non-Reversibel :
Proses termodinamik yang berlanggsung secara
alami seluruhnya disebut proses ireversibel
(irreversibel process).
Proses tersebut berlangsung secara spontan pada
satu arah tetapi tidak pada arah sebaliknya.
Proses yang tidak dapat dibalik arahnya
dinamakan proses irreversibel.
Contohnya kalor berpindah dari benda yang
bersuhu tinggi ke benda yang bersuhu rendah.
Dalam proses non-reversibel, rumus sebagai
berikut tidak berlaku dalam perhitungan :
Apabila dalam suatu proses nonreversibel, i dan f merupakan keadaan
keseimbangan, maka (dalam menghitung
S) jalan non-reversibel tersebut dapat
diganti dengan jalan reversibel.
8.3 AZAS ENTROPI SERTA
PEMAKAIANNYA
Seperti telah diketahui : Sistem + Lingkungan
=Alam Semesta. Apabila perhitungan S dilakukan
pad asistem dan juga padalingkungannya untuk
proses reversibel maupun nono-reversibel, segera
terungkap bahwa :
Yang disebut azas entropi.
PEMAKAIAN AZAS ENTROPI
Azas
entropi
dapat
dipakai
dalam
penyelesaian soal-soal tertentu.
-Teorema carnot
Mesin carnot (yang merupakan mesin yang
paling
mendekati
reversibel)
memiliki
efesiensi tertinggi, diantara mesin-mesin lain
yang dikerjakan antara dua RK yang sama.
Mesin kalor bekerja antara RK-1 yang
bersuhu
T1, RK-2 yang bersuhu T1. Mesin
menyerap kalor Q menghasilkan
sejumlah usaha W.
Anda mungkin juga menyukai
- Proses Reversibel Dan IrreversibelDokumen1 halamanProses Reversibel Dan IrreversibelMuamar MuamarBelum ada peringkat
- TermodinamikaDokumen5 halamanTermodinamikasri astutiBelum ada peringkat
- Makalah Reversibel, IrreversibelDokumen27 halamanMakalah Reversibel, IrreversibelAde Irma67% (3)
- Makalah Reversibel IrreversibelDokumen19 halamanMakalah Reversibel IrreversibelAnonymous qh0h55wBelum ada peringkat
- Makalah Reversibel, IrreversibelDokumen15 halamanMakalah Reversibel, IrreversibelDyvia Rosa Lumbanstone0% (1)
- Grafik Perubahan Keadaan Gas Idea1Dokumen10 halamanGrafik Perubahan Keadaan Gas Idea1angelBelum ada peringkat
- Proses IsotermalDokumen4 halamanProses IsotermalAziz MustofaBelum ada peringkat
- Grafik Perubahan Keadaan Gas IdealDokumen10 halamanGrafik Perubahan Keadaan Gas IdealamijuniaBelum ada peringkat
- ThermodinamikaDokumen18 halamanThermodinamikaAhmad DansBelum ada peringkat
- Grafik Perubahan Keadaan Gas IdealDokumen10 halamanGrafik Perubahan Keadaan Gas IdealM Anggradya Iqbal100% (1)
- PROSESDokumen11 halamanPROSESBUDI SAPUTRABelum ada peringkat
- Aerodinamika Pesawat Terbang IiDokumen13 halamanAerodinamika Pesawat Terbang IiArfandiBelum ada peringkat
- Makalah ReversibleDokumen10 halamanMakalah ReversibleDwi Agus SetiawanBelum ada peringkat
- Proses-Proses Termodinamika: DjukarnaDokumen9 halamanProses-Proses Termodinamika: DjukarnaMuh Fadli AdriyawanBelum ada peringkat
- Proses PolytropicDokumen10 halamanProses PolytropicFadhlul FajriBelum ada peringkat
- Entropi (OKE)Dokumen32 halamanEntropi (OKE)Ayu LestariBelum ada peringkat
- Proses PolytropicDokumen10 halamanProses PolytropicSegarta AntoniusBelum ada peringkat
- Hukum Termodinamika II, Entropi, Entalpi, F, Dan GDokumen35 halamanHukum Termodinamika II, Entropi, Entalpi, F, Dan GlourdesBelum ada peringkat
- Fixx Proses Thermodinamika ShelinapDokumen11 halamanFixx Proses Thermodinamika ShelinapDhevBelum ada peringkat
- Tugas 2 TermodinamikaDokumen6 halamanTugas 2 TermodinamikaSiapaBelum ada peringkat
- Kimia Fisika Hukum II Termodinamika Bagian 1 FikssDokumen7 halamanKimia Fisika Hukum II Termodinamika Bagian 1 FikssNTT53MADE WAHYUNIBelum ada peringkat
- EntropiDokumen42 halamanEntropiAhmad Yusuf Yusuf100% (1)
- Kuliah Termo 2.1 2023Dokumen28 halamanKuliah Termo 2.1 2023rezki0754Belum ada peringkat
- TERMODINAMIKADokumen24 halamanTERMODINAMIKA3dwarnetBelum ada peringkat
- ISOBARIKDokumen8 halamanISOBARIKIsrawatiBelum ada peringkat
- ENTROPIDokumen7 halamanENTROPIMaharany Perangin-AnginBelum ada peringkat
- Proses Reversibel Dan IrreversibelDokumen10 halamanProses Reversibel Dan IrreversibelArina Swastika Maulita100% (1)
- Bab 6 Hukum II TermodinamikaDokumen37 halamanBab 6 Hukum II TermodinamikaAmmar Zaky100% (1)
- Yulia Citra Chartika Sary - TermodinamikaDokumen29 halamanYulia Citra Chartika Sary - TermodinamikaYulia CitraBelum ada peringkat
- Proses ReversibelDokumen2 halamanProses ReversibelRagil SitanggangBelum ada peringkat
- Hukum Termodinamika 2 DAN 3-Dikonversi-DikompresiDokumen16 halamanHukum Termodinamika 2 DAN 3-Dikonversi-DikompresiRifaldi HarfiyantamaBelum ada peringkat
- Example 7Dokumen21 halamanExample 7assuna kids32100% (1)
- Konversi Energi Tugas Temu2Dokumen3 halamanKonversi Energi Tugas Temu2MarisImanBelum ada peringkat
- Tugas TermoDokumen7 halamanTugas TermoSiti widayanaBelum ada peringkat
- Prinsip Kenaikan EntropiDokumen8 halamanPrinsip Kenaikan Entropiasiyah0% (1)
- Hukum Ke-2 Termodinamika Kel 5Dokumen34 halamanHukum Ke-2 Termodinamika Kel 5Siti Aminah Al-HadiBelum ada peringkat
- Bab Iii Termodinamika SmaDokumen63 halamanBab Iii Termodinamika SmaLuthfiansyah RBelum ada peringkat
- Makalah Termodinamika Proses Reversibel Dan IreversibelDokumen13 halamanMakalah Termodinamika Proses Reversibel Dan IreversibelyosuaBelum ada peringkat
- Termodinamika SeninDokumen12 halamanTermodinamika SenintonnyBelum ada peringkat
- Termodinamika SeninDokumen12 halamanTermodinamika SeninAhmad KhafitBelum ada peringkat
- Tugas 03 Termodinamika TeknikDokumen4 halamanTugas 03 Termodinamika TeknikEgoxx klauBelum ada peringkat
- Hukum Kedua TermodinamikaDokumen11 halamanHukum Kedua TermodinamikaPutu Eka100% (1)
- Proses QuasistatikDokumen1 halamanProses QuasistatikHijri DesiBelum ada peringkat
- Kimia Pert 13 PPT Rahdatul NajmiDokumen24 halamanKimia Pert 13 PPT Rahdatul NajmiM RafliBelum ada peringkat
- Kuliah Termo IiDokumen34 halamanKuliah Termo IiIhans23Belum ada peringkat
- Tugas 1 Fisika StatistikDokumen14 halamanTugas 1 Fisika StatistikAnggraenySuciMaharanyBelum ada peringkat
- EntropiDokumen7 halamanEntropiAlexanderTassyaBelum ada peringkat
- Hukum I TermodinamikaDokumen14 halamanHukum I TermodinamikaNirwan AzhariBelum ada peringkat
- Persamaan Gas Non IdealDokumen15 halamanPersamaan Gas Non IdealangelBelum ada peringkat
- Delsa Adeatma (1920209028) TermoDokumen14 halamanDelsa Adeatma (1920209028) TermoDhevBelum ada peringkat
- Materi TermoDokumen7 halamanMateri TermoAchMadBelum ada peringkat
- Prinsip CarnotDokumen13 halamanPrinsip CarnotNatalia Lbn TobingBelum ada peringkat
- Termodinamika (Hukum II Termo)Dokumen19 halamanTermodinamika (Hukum II Termo)Perdi ApriansyahBelum ada peringkat
- Translate Chapter 7Dokumen74 halamanTranslate Chapter 7Dini Istiqomah100% (2)
- Rangkuman Materi - Kelompok 9 - Kimia FisikaDokumen10 halamanRangkuman Materi - Kelompok 9 - Kimia FisikaELSA OKTAVIANI SOPYANBelum ada peringkat
- Proses Adibiatik Reversibel Dan Proses Adibiatik IreversibelDokumen8 halamanProses Adibiatik Reversibel Dan Proses Adibiatik IreversibelSAVAGE KIDZBelum ada peringkat
- Proposal Natal Imaspera Tahun 2021Dokumen11 halamanProposal Natal Imaspera Tahun 2021yosuaBelum ada peringkat
- Kelompok 3 KKNDokumen13 halamanKelompok 3 KKNyosuaBelum ada peringkat
- Analisis Kandungan Logam Berat (Fe, CuDokumen18 halamanAnalisis Kandungan Logam Berat (Fe, CuyosuaBelum ada peringkat
- 5 6087011446426698770Dokumen178 halaman5 6087011446426698770yosuaBelum ada peringkat
- Presentation 2Dokumen13 halamanPresentation 2yosuaBelum ada peringkat
- Presentation 1Dokumen11 halamanPresentation 1yosuaBelum ada peringkat
- Difraksi MakalaDokumen5 halamanDifraksi MakalayosuaBelum ada peringkat
- Makalah Termodinamika Proses Reversibel Dan IreversibelDokumen13 halamanMakalah Termodinamika Proses Reversibel Dan IreversibelyosuaBelum ada peringkat
- Belajar EwbDokumen2 halamanBelajar EwbbecengBelum ada peringkat
- Enhydra FluctuansDokumen20 halamanEnhydra FluctuansyosuaBelum ada peringkat
- UNSURDokumen12 halamanUNSURyosuaBelum ada peringkat