0% menganggap dokumen ini bermanfaat (0 suara)
76 tayangan60 halamanStokiometri
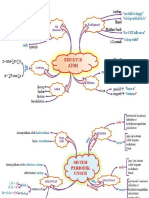
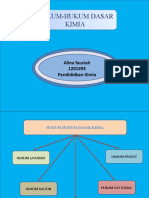
Stoikiometri merupakan studi tentang hubungan kuantitatif dalam reaksi kimia. Terdapat beberapa hukum reaksi kimia seperti hukum kekekalan massa, hukum perbandingan tetap, dan hukum kelipatan perbandingan. Reaksi kimia dapat berupa sintesis, metatesis, penetralan, atau redoks. Pereaksi pembatas menentukan jumlah produk yang dihasilkan.
Diunggah oleh
khusnulHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai PPT, PDF, TXT atau baca online di Scribd
0% menganggap dokumen ini bermanfaat (0 suara)
76 tayangan60 halamanStokiometri
Stoikiometri merupakan studi tentang hubungan kuantitatif dalam reaksi kimia. Terdapat beberapa hukum reaksi kimia seperti hukum kekekalan massa, hukum perbandingan tetap, dan hukum kelipatan perbandingan. Reaksi kimia dapat berupa sintesis, metatesis, penetralan, atau redoks. Pereaksi pembatas menentukan jumlah produk yang dihasilkan.
Diunggah oleh
khusnulHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai PPT, PDF, TXT atau baca online di Scribd