Perkembangan Model Atom
Diunggah oleh
Bun YaminDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Perkembangan Model Atom
Diunggah oleh
Bun YaminHak Cipta:
Format Tersedia
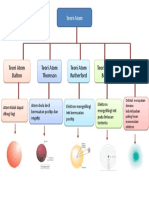
PERKEMBANGAN TEORI ATOM Oleh : Bun Yamin Jurusan Teknik Kimia STTI Bontang Konsep dasar tentang atom
sudah dikenal sejak zaman Yunani kuno yang dipelopori oleh Democritus yang hidup pada akhir abad ke-4 dan awal abad ke-5 Sebelum Masehi. Menurutnya, suatu benda dapat dibagi menjadi bagian-bagian yang sangat kecil yang akhirnya tidak dapat dibagi lagi yang disebut atom. Kata atom berasal dari bahasa Yunani yaitu atomos yang berarti tidak dapat dibagi. Disebutkan bahwa alasan ini berasal dari observasi di mana butiran pasir dapat bersama-sama membentuk sebuah pantai. Dalam analoginya, pasir adalah atom, dan pantai adalah senyawa. Analogi ini kemudian dapat dihubungkan dengan pengertian Democritus terhadap atom yang tidak bisa dibagi lagi: walaupun sebuah pantai dapat dibagi ke dalam butiran-butiran pasirnya, butiran pasir ini tidak dapat dibagi. Democritus juga beralasan bahwa atom sepenuhnya padat, dan tidak memiliki struktur internal. Dia juga berpikir harus ada ruang kosong antar atom untuk memberikan ruang untuk pergerakannya (seperti pergerakan dalam air dan udara, atau fleksibilitas benda padat). Sebagai tambahan, Democritus juga menyebutkan bahwa untuk menjelaskan perbedaan sifat dari material yang berbeda, atom dibedakan ke dalam bentuk, massa dan ukurannya. Konsep atom yang dikemukakan oleh Democritus ini tidak didukung oleh eksperimen yang meyakinkan sehingga tidak dapat diterima oleh ahli ilmu pengetahuan dan filsafat. Baru sekitar tahun 1800an bukti eksperimental muncul. Penelitian-penelitian terbaru menyebabkan
teori dan model atom semakin berkembang dan kebenarannya semakin nyata. Teori dan model atom dimulai dengan penelitian yang dilakukan oleh John Dalton yang selanjutnya dikembangkan oleh Joseph John Thompson, Ernest Rutherford, Niels Bohr dan teori atom menggunakan mekanika gelombang.
A. Model Atom Dalton Pada tahun 1803, John Dalton mengemukakan pendapatnaya tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum Prouts). Lavosier menyatakan bahwa "Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi". Sedangkan Prouts menyatakan bahwa "Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap". Dari kedua hukum tersebut Dalton
mengemukakan pendapatnya tentang atom sebagai berikut: 1. Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi 2. Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda 3. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen 4. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan. Hipotesa Dalton digambarkan dengan model atom sebagai bola pejal seperti pada tolak peluru. Seperti gambar berikut ini:
Percobaan Lavosier
Mula-mula tinggi cairan merkuri dalam wadah yang berisi udara adalah A, tetapi setelah beberapa hari merkuri naik ke B dan ketinggian ini tetap. Beda tinggi A dan B menyatakan volume udara yang digunakan oleh merkuri dalam pembentukan bubuk merah (merkuri oksida). Untuk menguji fakta ini, Lavoisier mengumpulkan merkuri oksida, kemudian dipanaskan lagi. Bubuk merah ini akan terurai menjadi cairan merkuri dan sejumlah volume gas (oksigen) yang jumlahnya sama dengan udara yang dibutuhkan dalam percobaan pertama Percobaan Joseph Pruost Pada tahun 1799 Proust menemukan bahwa senyawa tembaga karbonat baik yang dihasilkan melalui sintesis di laboratorium maupun yang diperoleh di alam memiliki susunan yang tetap. Percobaan Sebelum pemanasan ke1 2 3 (g Mg) 0,62 0,48 0,36 Setelah pemanasan (g MgO) 1,02 0,79 0,60 Perbandingan Mg/MgO 0,62/1,02 = 0,61 0,48/0,79 = 0,60 0,36/0,60 = 0,60
Kelebihan dan Kelemahan Model Atom Dalton Kelebihan Mulai membangkitkan minat terhadap penelitian mengenai model atom Kelemahan Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal dapat menghantarkan arus listrik? padahal listrik adalah elektron yang bergerak. Berarti ada partikel lain yang dapat menghantarkan arus listrik.
B. Model Atom Thomson Berdasarkan penemuan tabung katode yang lebih baik oleh William Crookers, maka J.J.
Thomson meneliti lebih lanjut tentang sinar katode dan dapat dipastikan bahwa sinar katode merupakan partikel, sebab dapat memutar baling-baling yang diletakkan diantara katode dan anode. Dari hasil percobaan ini, Thomson menyatakan bahwa sinar katode merupakan partikel penyusun atom (partikel subatom) yang bermuatan negatif dan selanjutnya disebut elektron.
Atom merupakan partikel yang bersifat netral, oleh karena elektron bermuatan negatif, maka harus ada partikel lain yang bermuatan positif untuk menetralkan muatan negatif elektron tersebut. Dari penemuannya tersebut, Thomson memperbaiki kelemahan dari teori atom dalton dan mengemukakan teori atomnya yang dikenal sebagai Teori Atom Thomson yang menyatakan bahwa: Atom merupakan bola pejal yang bermuatan positif dan di dalamnya tersebar muatan negatif elektron.
Model atom ini dapat digambarkan sebagai jambu biji yang sudah dikelupas kulitnya. Biji jambu menggambarkan elektron yang tersebar marata dalam bola daging jambu yang pejal, yang pada model atom Thomson dianalogikan sebagai bola positif yang pejal. Model atom Thomson dapat digambarkan sebagai berikut:
Percobaan Sinar Katode Berdasarkan eksperimennya Thomson mengukur bahwa kecepatan sinar katoda jauh lebih kecil dibandingkan kecepatan cahaya, jadi sinar katoda ini bukan merupakan REM. Selain itu Ia juga menetapkan perbandingan muatan listrik (e) dengan massa (m). Hasil rata-rata e/m sinar katoda kira-kira : e/m = 1,76 x 108 C g-1 Nilai ini sekitar 2000 kali lebih besar dari e/m yang dihitung dari hidrogen yang dilepas dari elektrolisis air (Thomson menganggap sinar katoda mempunyai muatan listrik yang sama seperti atom hidrogen dalam elektrolisis air). Kesimpulan : Partikel sinar katoda bermuatan negatif dan merupakan partikel dasar suatu benda yang harus ada pada setiap atom. Pada tahun 1874 Stoney mengusulkan istilah elektron.
Percobaan Tetes Minyak Milikan Besarnya muatan dalam elektron ditemukan oleh Robert Andrew Milikan (1908) melalui percobaan tetes minyak Milikan seperti gambar di bawah ini :
Minyak disemprotkan ke dalam tabung yang bermuatan listrik. Akibat gaya tarik gravitasi akan mengendapkan tetesan minyak yang turun. Bila tetesan minyak diberi muatan negatif maka akan tertarik kekutub positif medan listrik. milikan menemukan menemukan bahwa muatan tetes-tetes minyak selalu bulat dari suatu muatan tertentu, yaitu 1.602 x 10-19 coulomb Hasil percobaan Milikan dan Thomson diperoleh muatan elektron 1 dan massa elektron 0, sehingga elektron dapat dilambangkan Data Fisis Elektron : e/m = 1.76 x 108 C g-1 e = 1.602 x 10-19 C maka massa elektron = 9.11 x 10-28 gram Kelebihan dan Kelemahan Model Atom Thomson Kelebihan Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut. C. Model Atom Rutherford Rutherford bersama dua orang muridnya (Hans Geiger dan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar alfa () terhadap lempeng tipis emas. Sebelumya telah ditemukan adanya partikel alfa, yaitu partikel yang bermuatan positif dan bergerak lurus, berdaya tembus besar sehingga dapat menembus lembaran tipis kertas. Percobaan tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni apakah atom itu betulbetul merupakan bola pejal yang positif yang bila dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90o bahkan lebih. Berdasarkan gejala-gejala yang terjadi, diperoleh beberapa kesimpulan beberapa berikut: 1. Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan 2. Jika lempeng emas tersebut dianggap sebagai satu lapisanatom-atom emas, maka didalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif. 3. Partikel tersebut merupakan partikel yang menyusun suatu inti atom, berdasarkan fakta bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka didapatkan
ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran atom keseluruhan. Berdasarkan fakta-fakta yang didapatkan dari percobaan tersebut, Rutherford mengusulkan model atom yang dikenal dengan Model Atom Rutherford yang menyatakan bahwa Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif. Rutherford menduga bahwa didalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak. Model atom Rutherford dapat beriukut: digambarkan sebagai
Percobaan Rutherford Eksperimen ini melibatkan penambakan partikel alfa (inti atom helium atau ion helium dengan muatan positif) yang diemisikan oleh unsur Radium pada lempengan logam emas tipis dan kemudian mendeteksi partikel alfa yang telah melewati lempengan logam emas tersebut dengan menggunakan layar yang dilapisi seng sulfida (ZnS) sebagai dtetektor.
Kelemahan Model Atom Rutherford Kelebihan Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti Kelemahan Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama - kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti. Ambilah seutas tali dan salah satu ujungnya Anda ikatkan sepotong kayu sedangkan ujung yang lain Anda pegang. Putarkan tali tersebut di atas kepala Anda. Apa yang terjadi? Benar. Lama kelamaan putarannya akan pelan dan akan mengenai kepala Anda karena putarannya lemah dan Anda pegal memegang tali tersebut. Karena Rutherford adalah telah dikenalkan lintasan/kedudukan elektron yang nanti disebut dengan kulit.
D. Model Atom Bohr Pada tahun 1913, pakar fisika Denmark bernama Niels Bohr memperbaiki kegagalan percobaannya tentang atom Rutherford atom melalui hidrogen.
spektrum
Percobaannya ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck, diungkapkan dengan empat postulat, sebagai berikut:
1.
Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan melingkar disekeliling inti.
2. Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap. 3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, E = hv. 4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2 atau nh/2, dengan n adalah bilangan bulat dan h tetapan planck. Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasanlintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.
Percobaan Bohr
Kelebihan dan Kelemahan Kelebihan Keberhasilan teori Bohr terletak pada kemampuannya untuk meeramalkan garisgaris dalam spektrum atom hidrogen Salah satu penemuan adalah sekumpulan garis halus, terutama jika atom-atom yang dieksitasikan diletakkan pada medan magnet Kelemahan Struktur garis halus ini dijelaskan melalui modifikasi teori Bohr tetapi teori ini tidak pernah berhasil memerikan spektrum selain atom hydrogen Belum mampu menjelaskan adanya stuktur halus (fine structure) pada spectrum, yaitu 2 atau lebih garis yang sangat berdekatan Belum dapat menerangkan spektrum atom kompleks Itensitas relatif dari tiap garis spektrum emisi. Efek Zeeman, yaitu terpecahnya garis spektrum bila atom berada dalam medan magnet. E. Model Atom Modern Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926). Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg
mengembangkan teori mekanika kuantum yang dikenal
Erwin Schrodinger
dengan prinsip ketidakpastian yaitu Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom. Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger. Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi. Persamaan Schrodinger Werner Heisenberg
Werner Heisenberg x,y dan z = Posisi dalam tiga dimensi Y m E V = Fungsi gelombang = massa = h/2p dimana h = konstanta plank dan p = 3,14 = Energi total = Energi potensial
Model atom dengan orbital lintasan elektron ini disebut model atom modern atau model atom mekanika kuantum yang berlaku sampai saat ini, seperti terlihat pada gambar berikut ini.
Model atom mutakhir atau model atom mekanika gelombang
Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit. Dengan demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama.
Ciri Khas Model Atom Mekanika Gelombang 1. Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi
darikebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom) 2. Bentuk dan ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut) 3. Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang pasti, tetapi boleh jadi merupakan peluang terbesar ditemukannya elektron. Percobaan Chadwick
Kelemahan Model Atom Modern Persamaan gelombang Schrodinger hanya dapat diterapkan secara eksak untuk partikel dalam kotak dan atom dengan elektron tunggal.
F. Kesimpulan 1. Sebelum permulaan abad 19, konsep atom dianggap sebagai mitos , karena gagasan yang diajukan oleh para filosof Yunani hanya dilandasi pemikiran tentang fenomena alam. Perkembangannya menjadi sains normal setelah Dalton mengkonseptualisasikan kembali berdasarkan kajiankajian empirik. Periode sains normal di bawah paradigma Dalton
berlangsung hampir satu abad lamanya (ahir abad 19). 2. Akumulasi anomali yang menggugurkan paradigma Dalton antara lain gejala kelistrikan dan radoaktifitas. 3. Perubahan model atom Thompson, Rutherford, Bohr hingga model atom mekanika kuantum masih berada dalam satu paradigma yang meyakini bahwa atom memiliki sub partikel ; inti atom dan elektron. Perubahan model difokuskan pada penentuan susunan elektron dalam atom 4. Namun ditinjau dari landasan filosofisnya, perubahan Model Atom Bohr ke Model atom mekanika Kuantum dianggap sebagai perubahan paradigma deterministik menjadiUncertainity Principle 5. Penemuan partikel elementer quark , belum dapat dianggap suatu anomali , karena model quark tidak mengubah paradigma namun melengkapinya, 6. Adanya perkembangan pemikiran konsep atom menunjukkan bahwa tidak ada kebenaran yang mutlak dalam IPA, bahkan melalui konsep atom faham determinisme dapat dibantah dengan argumentasi mekanika kuantum. Kemunculan model quark tidak lagi dianggap sesuatu guncangan bagi kebenaran ilmiah, namun dianggap dapat melengkapi khazanah ilmu pengetahuan. Hal ini karena para ilmuwan kini mempunyai pandangan bahwa kebenaran sains bersifat tentatif dan relatif.
Bibliografi
Farida, Ida. 2009, Analisis Sejarah Perkembangan Model Atom berdasarkan Paradigma Kuhn. http://faridach.wordpress.com/2009/12/11/analisis-sejarahmodel-atom-berdasarkan-paradigma-kuhn/ (diakses tanggal 22 September 2011) Setyawati, Arifatun Anifah. Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA, Pusat Perbukuan Departemen Pendidikan Nasional, 2009.
Susanti, Vika. ____, Perkembangan Model Atom. http://kimia.upi.edu/utama/bahanajar/kuliah_web/2007/Vika%20Susanti/model.ht ml (diakses tanggal 22 September 2011)
Makalah : Mikrobiologi
MIKOPROTEIN
Pangan Pengganti Daging Berbasis Miselium Jamur
Oleh : Bun Yamin Arya Nining Sailla
JURUSAN TEKNIK KIMIA SEKOLAH TINGGI TEKNOLOGI INDUSTRI BONTANG 2012
Anda mungkin juga menyukai
- Keterlibatan kuantum dan semua warnanya. Dari mitos gua Plato, ke sinkronisasi Carl Jung, ke alam semesta holografik David Bohm.Dari EverandKeterlibatan kuantum dan semua warnanya. Dari mitos gua Plato, ke sinkronisasi Carl Jung, ke alam semesta holografik David Bohm.Belum ada peringkat
- IKATAN KIMIADokumen32 halamanIKATAN KIMIAEmery Fathan ZwageriBelum ada peringkat
- Contoh Reaksi Eksoterm Dan EndotermDokumen1 halamanContoh Reaksi Eksoterm Dan EndotermTiara RamadhiantiBelum ada peringkat
- OPTIMASI TERMOKIMIADokumen20 halamanOPTIMASI TERMOKIMIAmsy wulandariBelum ada peringkat
- Proposal Praktimum Kimia Hot Ice - AraDokumen11 halamanProposal Praktimum Kimia Hot Ice - AraIrna Diah MumpuniBelum ada peringkat
- Tabel PeriodikDokumen10 halamanTabel PeriodikNi Nyoman Budiartini100% (1)
- Kumpulan Soal PAs Kelas XDokumen6 halamanKumpulan Soal PAs Kelas Xayu irsalinaBelum ada peringkat
- Lembar Kerja Siswa KalorimetriDokumen3 halamanLembar Kerja Siswa KalorimetrikhairinaBelum ada peringkat
- TRY OUT 1Dokumen8 halamanTRY OUT 1Dean HidayatBelum ada peringkat
- Kimia Laporan Penyepuhan Pada Tembaga (II) SulfatDokumen7 halamanKimia Laporan Penyepuhan Pada Tembaga (II) SulfatAndri AgapeBelum ada peringkat
- Laporan Praktikum Kimia ElektrolisisDokumen4 halamanLaporan Praktikum Kimia ElektrolisisDestya UciuciBelum ada peringkat
- Asam Karboksilat, Kuliah KO IDokumen28 halamanAsam Karboksilat, Kuliah KO INuklir Energi Massa DepanBelum ada peringkat
- Pembahasan Soal Kimia OSKDokumen17 halamanPembahasan Soal Kimia OSKAal AwaliahBelum ada peringkat
- SISTEM PERIODIK UNSURDokumen5 halamanSISTEM PERIODIK UNSURFielda Ayu AmasfaBelum ada peringkat
- LKS Penurunan Titik BekuDokumen3 halamanLKS Penurunan Titik BekuLovely SooBelum ada peringkat
- 3.10 Tata Nama SenyawaDokumen11 halaman3.10 Tata Nama Senyawawawat resnawatiBelum ada peringkat
- Bab 6 BenzenaDokumen15 halamanBab 6 BenzenaRBelum ada peringkat
- Soal Struktur AtomDokumen4 halamanSoal Struktur AtomannitaBelum ada peringkat
- Asam KuatDokumen2 halamanAsam KuatLiana HerditaBelum ada peringkat
- RPP TermokimiaDokumen25 halamanRPP TermokimiaAbAnKLABBelum ada peringkat
- Pengaruh FaktorDokumen7 halamanPengaruh Faktorazril febrianBelum ada peringkat
- Soal Pre TestDokumen7 halamanSoal Pre TestArdiansyah YayanBelum ada peringkat
- PTS BAHASA SUNDA KELAS X DI MA AR-ROSUDINIYAHDokumen2 halamanPTS BAHASA SUNDA KELAS X DI MA AR-ROSUDINIYAHNha AzzeinBelum ada peringkat
- Dialog Diskusi AdelDokumen5 halamanDialog Diskusi AdeladeliaBelum ada peringkat
- TERMOKIMIADokumen14 halamanTERMOKIMIAIzzul MuttaqinBelum ada peringkat
- AlkanaDokumen6 halamanAlkanamirfizaBelum ada peringkat
- Konfigurasi Elektron IonDokumen17 halamanKonfigurasi Elektron IonRivan GunawanBelum ada peringkat
- Latihan Soal Sifat Koligatif LarutanDokumen1 halamanLatihan Soal Sifat Koligatif LarutanHanika Zahrah Fahmawati100% (2)
- Jawaban Soal Kuis 13 Mei 2023Dokumen4 halamanJawaban Soal Kuis 13 Mei 2023Fáża ÀżizanBelum ada peringkat
- Soal Laju ReaksiDokumen5 halamanSoal Laju Reaksisuarni panaiBelum ada peringkat
- Soal PersilanganDokumen18 halamanSoal PersilanganSariiRizkyBelum ada peringkat
- Kelarutan Dan Hasil Kali KelarutanDokumen12 halamanKelarutan Dan Hasil Kali Kelarutanagus muliadiBelum ada peringkat
- Perkembangan Sistem Periodik UnsurDokumen22 halamanPerkembangan Sistem Periodik UnsurNazshaNayyazshaBelum ada peringkat
- Konsep Mol 2Dokumen51 halamanKonsep Mol 2YulfitrinBelum ada peringkat
- Materi Kesetimbangan KimiaDokumen64 halamanMateri Kesetimbangan KimiarindaBelum ada peringkat
- TERMOKIMIADokumen12 halamanTERMOKIMIAJatmiko Eko Saputro0% (1)
- Senyawa HidratDokumen2 halamanSenyawa HidratPenggemmar AgitaBelum ada peringkat
- Mind MappingDokumen11 halamanMind MappingyolandBelum ada peringkat
- Rangkuman RedoksDokumen3 halamanRangkuman RedoksRahayu Maulida R50% (2)
- Beberapa Mineral Bijih LogamDokumen7 halamanBeberapa Mineral Bijih LogamRizqi MubarokBelum ada peringkat
- Penurunan Titik Beku LarutanDokumen4 halamanPenurunan Titik Beku LarutanArif YuniartoBelum ada peringkat
- Lagu KimiaDokumen9 halamanLagu KimiaSri SuryaniBelum ada peringkat
- Hubungan Polusi Udara & KoloidDokumen14 halamanHubungan Polusi Udara & KoloidMaria HebiBelum ada peringkat
- KarbonSenyawaDokumen5 halamanKarbonSenyawaAglin MaghfiraBelum ada peringkat
- LKS Senyawa Kov Pola Dan Non PolDokumen8 halamanLKS Senyawa Kov Pola Dan Non PolMenunggu Bintang JatuhBelum ada peringkat
- 5.bab 3 Laju Reaksi NewDokumen28 halaman5.bab 3 Laju Reaksi NewRatuBelum ada peringkat
- Laporan PraktikumDokumen6 halamanLaporan PraktikumSabda Bake100% (1)
- Laporan KegiatanDokumen3 halamanLaporan Kegiatanrein kanazlin67% (6)
- Peta Konsep Teori AtomDokumen1 halamanPeta Konsep Teori AtomPrima Tampubolon0% (1)
- Indium PresentasiDokumen12 halamanIndium PresentasiMuh Amal PratamaBelum ada peringkat
- Aplikasi Senyawa KompleksDokumen6 halamanAplikasi Senyawa KompleksKhairul EBelum ada peringkat
- Pembuatan Halogen Skala IndustriDokumen2 halamanPembuatan Halogen Skala IndustriIka Favia AnggraeniBelum ada peringkat
- Alkali TanahDokumen9 halamanAlkali Tanahsalfany try nBelum ada peringkat
- StoikiometriDokumen17 halamanStoikiometriJessi Eka100% (1)
- BAB 7 REAKSI REDOKS. Proses Perkaratan BesiDokumen23 halamanBAB 7 REAKSI REDOKS. Proses Perkaratan BesiMelly Tri RahmiBelum ada peringkat
- Sejarah Model AtomDokumen19 halamanSejarah Model AtomHaamim Sajdah Sya'baniBelum ada peringkat
- Teori AtomDokumen14 halamanTeori AtomBrian SalviantonoBelum ada peringkat
- AtomDokumen15 halamanAtomdhea okta vianaBelum ada peringkat
- Makalah Karakteristik Syariah IslamDokumen7 halamanMakalah Karakteristik Syariah IslamHazirman Hamruddin0% (1)
- Makalah Teori AtomDokumen10 halamanMakalah Teori AtomMivyBelum ada peringkat
- Sastra Lisan BugisDokumen196 halamanSastra Lisan BugisBun YaminBelum ada peringkat
- SDP PL Konsultansi Perorangan (Perpres 16 2018)Dokumen39 halamanSDP PL Konsultansi Perorangan (Perpres 16 2018)Bun Yamin0% (1)
- Dok PL 16-2018 New ModifiedDokumen17 halamanDok PL 16-2018 New ModifiedBun YaminBelum ada peringkat
- Lakin Minerba 2015Dokumen92 halamanLakin Minerba 2015Danu Putra100% (1)
- Reaktor Fixed Bed 37Dokumen1 halamanReaktor Fixed Bed 37Bun YaminBelum ada peringkat
- Migrasi Ke Scilab Untuk Visualisasi Serta Penyelesaian Model MatematisDokumen6 halamanMigrasi Ke Scilab Untuk Visualisasi Serta Penyelesaian Model MatematisBun YaminBelum ada peringkat
- KPC SR 2015 Layout Design 5Okt2015-LowRes 1Dokumen121 halamanKPC SR 2015 Layout Design 5Okt2015-LowRes 1Chandra RiadyBelum ada peringkat
- Batubara Indonesia PDFDokumen10 halamanBatubara Indonesia PDFIndah PratiwiBelum ada peringkat
- Panduan SciLabDokumen17 halamanPanduan SciLabBun YaminBelum ada peringkat
- Media Penilai September 2013Dokumen61 halamanMedia Penilai September 2013artha_perdanaBelum ada peringkat
- Lakin Minerba 2016Dokumen112 halamanLakin Minerba 2016Bambang ParikesitBelum ada peringkat
- PP 18 Tahun 2016 TTG Perangkat Daerah Pasal Khusus Kecamatan KelurahanDokumen3 halamanPP 18 Tahun 2016 TTG Perangkat Daerah Pasal Khusus Kecamatan KelurahanBun YaminBelum ada peringkat
- Panduan SciLabDokumen17 halamanPanduan SciLabBun YaminBelum ada peringkat
- Analisis Batubara PDFDokumen19 halamanAnalisis Batubara PDFRelly SBelum ada peringkat
- OHSAS 8001-2007 Dual LanguageDokumen19 halamanOHSAS 8001-2007 Dual LanguageMeisya KusumaningtiasBelum ada peringkat
- Harga Bappeda - Pms PDFDokumen1 halamanHarga Bappeda - Pms PDFBun YaminBelum ada peringkat
- Muhammad Tambrin - IMPLEMENTASI UNDANG-UNDANG NOMOR 33 TAHUN 2014 TENTANG JAMINAN PRODUK HALALDokumen30 halamanMuhammad Tambrin - IMPLEMENTASI UNDANG-UNDANG NOMOR 33 TAHUN 2014 TENTANG JAMINAN PRODUK HALALBun YaminBelum ada peringkat
- Billing Rate Inkindo 2017 PDFDokumen33 halamanBilling Rate Inkindo 2017 PDFPejabat Pengadaan88% (8)
- Modul 3 Persiapan Pengadaan Barang - Jasa Pemerintah - Bagian IIDokumen70 halamanModul 3 Persiapan Pengadaan Barang - Jasa Pemerintah - Bagian IIBun YaminBelum ada peringkat
- Fatwa Mui Tentang Hukum TradingDokumen6 halamanFatwa Mui Tentang Hukum TradingBun YaminBelum ada peringkat
- FMKMLMDokumen26 halamanFMKMLMDianSwaraPiliangBelum ada peringkat
- Batubara Indonesia PDFDokumen10 halamanBatubara Indonesia PDFIndah PratiwiBelum ada peringkat
- Panduan SPSE v4.1.1 User PanitiaDokumen124 halamanPanduan SPSE v4.1.1 User PanitiaBun YaminBelum ada peringkat
- Billing Rate Inkindo 2017 PDFDokumen33 halamanBilling Rate Inkindo 2017 PDFPejabat Pengadaan88% (8)
- Ditjen Minerba - Produksi BatubaraDokumen1 halamanDitjen Minerba - Produksi BatubaraBun YaminBelum ada peringkat
- Fluidized Catalytic Cracker With Active Stripper and Methods Using SameDokumen10 halamanFluidized Catalytic Cracker With Active Stripper and Methods Using SameBun YaminBelum ada peringkat
- Proposal Tugas AkhirDokumen42 halamanProposal Tugas AkhirBun YaminBelum ada peringkat
- Lakip Kelurahan Berbas PantaiDokumen25 halamanLakip Kelurahan Berbas PantaiBun YaminBelum ada peringkat
- PFR2Dokumen49 halamanPFR2Indra SetiawanBelum ada peringkat
- Materi Ujian Dinas Tingkat IDokumen1 halamanMateri Ujian Dinas Tingkat IBun YaminBelum ada peringkat