Termo 1 Tugas
Diunggah oleh
Andi Cahyo EnelisDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Termo 1 Tugas
Diunggah oleh
Andi Cahyo EnelisHak Cipta:
Format Tersedia
Persamaan keadaan gas ideal dan diagram P-v-T Dari hasil eksperimen, nilai besaran-besaran termodinamika bergantung satu
sama lain. Volume dikecilkan Suhu dinaikkan
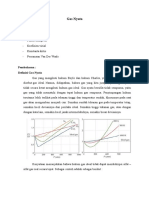
Apabila volume (V), suhu (T) dan massa (m) diatur dengan nilai tertentu, maka nilai tekanan (P) tidak bisa sebarang. Ada hubungan antara besaran-besaran ini sbb: f(P, V, T, m) = 0 Hubungan ini disebut persamaan keadaan Biasanya persamaan keadaan dituliskan berdasarkan sifat-sifat alam bukan berapa banyak material berada, sehingga besaran ekstensif diganti dengan nilai spesifiknya. Seperti V menjadi v =mV , sehingga persamaan keadaan menjadi: f(P, v, T) = 0 Persamaan ini bervariasi dari satu zat ke zat yang lain. Hubungan antar satu sama lain biasanya tidak sederhana. Untuk mempermudah, sering dipakai ilustrasi grafik. Contoh eksperimen untuk 1 mole gas karbon dioksida: Plot antara Pv/T vs. P untuk tiga temperatur yang berbeda.
Ilustrasi grafik tersebut menunjukkan: Tampak bahwa nilai Pv/T tidak konstan Pada tekanan rendah ketiga kurva menyatu pada nilai Pv/T = R dengan R merupakan konstanta gas universal. Pada suhu tinggi, kurva mendekati garis lurus Pada tekanan yang cukup rendah, untuk semua gas: Pv/T = R atau Pv = RT Oleh karena itu seringkali digunakan pendekatan gas ideal yang mengasumsikan bahwa rasio Pv/T selalu sama dengan R untuk semua tekanan dan temperatur. Kita tahu bahwa di alam tidak ada gas ideal semacam itu, gas yang mendekati gas ideal terjadi pada tekanan rendah dan suhu tinggi, namun studi tentang gas ideal sangat bermanfaat sebagai salah satu pendekatan untuk mengetahui sifat-sifat gas sesungguhnya.
Persamaan gas ideal:
disini Pv = RT = konstan, sering disebut sebagai Hukum Boyle.
Pendekatan Persamaan Keadaan Gas Real Cukup banyak usulan tentang hubungan P-v-T pada gas real yang lebih akurat daripada gas ideal. Beberapa didapatkan dari fakta empiris murni, lainnya berasal dari asumsi-asumsi mengenai sifatsifat molekul. Van der Waals (1873) mengusulkan persamaan:
Disini a dan b merupakan konstanta. Dengan fitting data eksperimen, kedua konstanta ini dapat dihitung.
Apabila volume spesifik, v, sangat besar (secara fisis berarti total mole gas kecil sekali sehingga tidak ada interaksi antar molekul) maka suku v2/a dapat diabaikan terhadap P, dan juga suku b diabaikan terhadap v, hal ini membuat persamaan van der Waals menjadi gas ideal.
Permukaan P-v-T suatu zat (real) yang menyusut pada saat membeku:
Permukaan P-v-T suatu zat (real) yang mengembang pada saat membeku:
Ekspansi dan Kompresibilitas Sebagaimana koefisien muai linear/volume (lihat kembali bukubuku SMU), secara umum dapat didefinisikan koefisien ekspansi volume:
Fisis? Perubahan volume terhadap kenaikan temperatur persatuan volume pada tekanan tetap. Koefisien ekspansi volume menunjukkan seberapa jauh material berkembang terhadap agitasi termal. Untuk gas ideal:
Tanda negatif disebabkan karena volume selalu menyusut bila
tekanan naik, jadi (V/P)T secara inheren bernilai negatif. Sehingga kompresibilitas merupakan besaran bernilai positif. Untuk gas ideal:
Konstanta Kritis Gas Van der Waals Meskipun pendekatan gas van der Waals cukup sederhana, gas ini menunjukkan adanya titik kritis dan berkorespondensi dengandaerah cair-uap pada gas real. Nilai titik kritis terjadi ketika:
Anda mungkin juga menyukai
- Evaluasi Sifat TermodinamikaDokumen12 halamanEvaluasi Sifat TermodinamikaAndi Cahyo EnelisBelum ada peringkat
- TermoDokumen13 halamanTermoKurnia AnindyaBelum ada peringkat
- Makalah Persamaan KeadaanDokumen21 halamanMakalah Persamaan Keadaankiki_riana31100% (1)
- Gas NyataDokumen6 halamanGas NyataPriska Jesika MonanginBelum ada peringkat
- Teori Dasar Termodinamika Pembahasan Tentang EkspansiDokumen13 halamanTeori Dasar Termodinamika Pembahasan Tentang EkspansiKang AryoBelum ada peringkat
- Buku KFDokumen207 halamanBuku KFFaradila RahmadhaniBelum ada peringkat
- Evaluasi Sifat TermoDokumen3 halamanEvaluasi Sifat TermoMiqdadBelum ada peringkat
- Hukum Gas Persamaan Keadaan Gas Pada Tekanan Rendah Dibentuk Dengan Menggabungkan Serangkaian Hukum EmpirisDokumen9 halamanHukum Gas Persamaan Keadaan Gas Pada Tekanan Rendah Dibentuk Dengan Menggabungkan Serangkaian Hukum EmpirisYuliantari YuliantariBelum ada peringkat
- Persamaan KeadaanDokumen4 halamanPersamaan KeadaanTaufik SukmanaBelum ada peringkat
- Gas NyataDokumen10 halamanGas NyataFianti DamayantiBelum ada peringkat
- Resume Kimia Dasar IDokumen60 halamanResume Kimia Dasar IMUHAMMAD RAMLIBelum ada peringkat
- KLPK 2 Termodinamika 2Dokumen6 halamanKLPK 2 Termodinamika 2merilaaja46Belum ada peringkat
- Persamaan Keadaan Fix BangetDokumen14 halamanPersamaan Keadaan Fix Bangetsinta wulanBelum ada peringkat
- Tugas 9 KimdasDokumen11 halamanTugas 9 KimdasFirdianiBelum ada peringkat
- Tugas Pers Van Der Walls PipiDokumen2 halamanTugas Pers Van Der Walls PipiEffa BaraqbahBelum ada peringkat
- Rangkuman Materi Persamaan Keadaan Kelompok 2 MUTIDokumen16 halamanRangkuman Materi Persamaan Keadaan Kelompok 2 MUTImutiaBelum ada peringkat
- Gas Ideal 1Dokumen11 halamanGas Ideal 1Handika PrawiraBelum ada peringkat
- Perilaku PVT GasDokumen10 halamanPerilaku PVT GasJihan MutiahBelum ada peringkat
- Termodinamika Kelompok 3Dokumen16 halamanTermodinamika Kelompok 3Jantri Syah putra SembiringBelum ada peringkat
- PBL KimfisDokumen6 halamanPBL Kimfisyuliarahmi02Belum ada peringkat
- Persamaan Keadaan Gas IdealDokumen4 halamanPersamaan Keadaan Gas IdealAgah NugrahaBelum ada peringkat
- Persamaan KeadaanDokumen12 halamanPersamaan Keadaanoselucky100% (1)
- KF Gas Tidak IdealDokumen4 halamanKF Gas Tidak IdealArdhiaPramestiRigitaBelum ada peringkat
- Makalah Kimfis Properties of GasDokumen25 halamanMakalah Kimfis Properties of GasNovy CendianBelum ada peringkat
- Arianda Pratama - Materi 7 - Resume Gas IdealDokumen11 halamanArianda Pratama - Materi 7 - Resume Gas IdealMeilody IndreswariBelum ada peringkat
- Jawaban 20Dokumen1 halamanJawaban 20NTT53MADE WAHYUNIBelum ada peringkat
- Gas NyataDokumen10 halamanGas NyataYusuf EfendiBelum ada peringkat
- Hukum Gas IdealDokumen6 halamanHukum Gas IdealTri Yos100% (11)
- Worksheets 4: Persamaan Keadaan Alokasi Waktu: 2 X 3 Sks Materi Pokok Indikator KompetensiDokumen13 halamanWorksheets 4: Persamaan Keadaan Alokasi Waktu: 2 X 3 Sks Materi Pokok Indikator Kompetensimella karlinaBelum ada peringkat
- Persamaan KeadaanDokumen13 halamanPersamaan KeadaanKomang SuardikaBelum ada peringkat
- TUKIMINDokumen23 halamanTUKIMINRomega ManullangBelum ada peringkat
- Ketetapan Dalam Memahami Persamaan Gas Ideal, Keadaan Gas Nyata Dan Keadaan Lain Pada Gas NyataDokumen6 halamanKetetapan Dalam Memahami Persamaan Gas Ideal, Keadaan Gas Nyata Dan Keadaan Lain Pada Gas Nyatarinda kasihBelum ada peringkat
- Gas 2Dokumen42 halamanGas 2Galang LBelum ada peringkat
- Bab 12 Gas Dan TermodinamikaDokumen96 halamanBab 12 Gas Dan TermodinamikaSara Senzi Aurelia100% (1)
- Persamaan TekananDokumen8 halamanPersamaan TekananHengki JuntakBelum ada peringkat
- Persamaan TekananDokumen13 halamanPersamaan TekananGood Job BatrouBelum ada peringkat
- Persamaan Van Der WaalsDokumen4 halamanPersamaan Van Der WaalsMeyda AstriaBelum ada peringkat
- Gas NyataDokumen5 halamanGas Nyatayuri windayaniBelum ada peringkat
- Kelompok 4a Indralaya - PPT Tugas 3 Termodinamika DasarDokumen56 halamanKelompok 4a Indralaya - PPT Tugas 3 Termodinamika DasarM.rangga PerdanaBelum ada peringkat
- Hukum Boyle AdalahDokumen9 halamanHukum Boyle AdalahEvisa Ze AlysBelum ada peringkat
- Gas Dan Teori KinetikDokumen24 halamanGas Dan Teori KinetikBAHRUNBelum ada peringkat
- Hukum Gas IdealDokumen6 halamanHukum Gas IdealRirin JuliasriBelum ada peringkat
- (Modul 03 - Kelompok 67) Muhammad Alfayed Okto Riendi - 10217111Dokumen6 halaman(Modul 03 - Kelompok 67) Muhammad Alfayed Okto Riendi - 10217111AlfayedOktoBelum ada peringkat
- Hukum GASDokumen8 halamanHukum GASFauzan FatahillahBelum ada peringkat
- Hukum Gas IdealDokumen9 halamanHukum Gas IdealYulia Utami PutriBelum ada peringkat
- Bab 2Dokumen37 halamanBab 2Teplox 24Belum ada peringkat
- Gas Dan TermodinamikaDokumen96 halamanGas Dan TermodinamikaDaniel TobingBelum ada peringkat
- Persamaan Keadaan Van Der WaalsDokumen2 halamanPersamaan Keadaan Van Der WaalsGunturXie100% (1)
- Bab VDokumen22 halamanBab VMarlin Sari100% (1)
- 1 Hukum Termodinamika NolDokumen39 halaman1 Hukum Termodinamika NolAlfiansyah DarmawanBelum ada peringkat
- Hukum Boyle AdalahDokumen9 halamanHukum Boyle AdalahEvisa Ze AlysBelum ada peringkat
- Bab 18 Sifat Thermal MaterialDokumen25 halamanBab 18 Sifat Thermal MaterialMufid Hadi RaharjoBelum ada peringkat
- Gas IdealDokumen7 halamanGas IdealKhalidBelum ada peringkat
- Oret OretanDokumen8 halamanOret OretanAtik isdarwatiBelum ada peringkat
- KOMPAKSIDokumen28 halamanKOMPAKSIAndi Cahyo EnelisBelum ada peringkat
- 168-Makalah M. GoparDokumen5 halaman168-Makalah M. GoparMaulizar Ilyas Bin AliBelum ada peringkat
- Peralatan Kerja BangkuDokumen31 halamanPeralatan Kerja Bangkubudi_ummBelum ada peringkat
- Tugas Matematika 4Dokumen28 halamanTugas Matematika 4Andi Cahyo EnelisBelum ada peringkat
- Barisan Aritmetika Dan Deret AritmetikaDokumen1 halamanBarisan Aritmetika Dan Deret AritmetikaAndi Cahyo EnelisBelum ada peringkat
- Makalah Metrologi IndustriDokumen28 halamanMakalah Metrologi IndustriAndi Cahyo Enelis100% (1)
- Maklah Kerja PlatDokumen34 halamanMaklah Kerja PlatAndi Cahyo EnelisBelum ada peringkat