Jawaban 20
Diunggah oleh
NTT53MADE WAHYUNIJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Jawaban 20
Diunggah oleh
NTT53MADE WAHYUNIHak Cipta:
Format Tersedia
Jawaban
20.
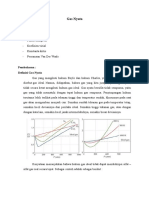
Hukum gas yang ideal memperlakukan molekul gas sebagai partikel titik yang tidak berinteraksi
kecuali dalam tumbukan elastis. Dengan kata lain, mereka tidak mengambil ruang apa pun, dan tidak
tertarik atau ditolak oleh molekul gas lainnya.Hukum gas ideal menyatakan bahwa volume (V) yang
ditempati oleh n mol dari setiap gas memiliki tekanan (P) pada suhu (T) dalam Kelvin. Hubungan
untuk variabel-variabel ini, P V = n R T, di mana R diketahui sebagai konstanta gas, disebut sebagai
hukum atau persamaan keadaan gas ideal.
Untuk memperhitungkan volume yang dibutuhkan molekul gas nyata, persamaan van der Waals
menggantikan V dalam hukum gas ideal dengan (V-b), di mana b adalah volume per mol yang
ditempati oleh molekul. Ini mengarah pada:
P(Vm-b)=RT
Modifikasi kedua yang dibuat untuk perhitungan hukum gas ideal untuk fakta bahwa molekul-
molekul gas memang menarik satu sama lain dan bahwa gas nyata karenanya lebih mudah
dikompresi daripada gas ideal. Van der Waals disediakan bagi tarik antarmolekul dengan
menambahkan tekanan yang diamati P dalam istilah persamaan keadaan a/V2m di mana a adalah
konstanta yang nilainya bergantung pada gas.
Persamaan van der Waals karenanya dituliskan sebagai;
( P + a/V2m ) ( Vm – b )= RT
Dan dapat pula ditulis sebagai
( P + an2 / V2 ) ( V – nb ) = nRT
Di mana Vm adalah volume molar gas, R adalah tetapan gas universal, T adalah suhu, P adalah
tekanan, dan V adalah volume. Ketika volume molar Vm besar, b menjadi dapat diabaikan
dibandingkan dengan Vm, a/Vm2 menjadi diabaikan terhadap P, dan persamaan van der Waals
direduksi menjadi hukum gas ideal, PVm=RT.
Persamaan ini tersedia melalui penurunan rumus tradisionalnya (suatu persamaan keadaan
mekanika), atau melalui penurunan rumus berdasarkan termodinamika statistik, yang terakhir
menyediakan fungsi partisi pada sistem dan memungkinkan fungsi termodinamika untuk ditentukan.
Ini berhasil mendekati perilaku cairan nyata di atas suhu kritis dan secara kualitatif masuk akal untuk
keadaan cairan dan tekanan gas rendah mereka pada suhu rendah. Namun, di dekat transisi antara
gas dan cair, dalam kisaran p, V, dan T di mana fase cairan dan fase gas berada dalam
kesetimbangan, persamaan van der Waals gagal untuk secara akurat memodelkan perilaku
eksperimental yang diamati, khususnya bahwa p adalah fungsi konstan dari V pada suhu yang
diberikan. Dengan demikian, model van der Waals tidak hanya berguna untuk perhitungan yang
dimaksudkan untuk memprediksi perilaku nyata di daerah dekat titik kritis.
Anda mungkin juga menyukai
- Tugas Pers Van Der Walls PipiDokumen2 halamanTugas Pers Van Der Walls PipiEffa BaraqbahBelum ada peringkat
- Evaluasi Sifat TermodinamikaDokumen12 halamanEvaluasi Sifat TermodinamikaAndi Cahyo EnelisBelum ada peringkat
- KLPK 2 Termodinamika 2Dokumen6 halamanKLPK 2 Termodinamika 2merilaaja46Belum ada peringkat
- Perilaku PVT GasDokumen10 halamanPerilaku PVT GasJihan MutiahBelum ada peringkat
- Termo 1 TugasDokumen12 halamanTermo 1 TugasAndi Cahyo EnelisBelum ada peringkat
- KF Gas Tidak IdealDokumen4 halamanKF Gas Tidak IdealArdhiaPramestiRigitaBelum ada peringkat
- Sifat Gas Ideal Dan Gas NyataDokumen10 halamanSifat Gas Ideal Dan Gas NyatasitiBelum ada peringkat
- Gas NyataDokumen10 halamanGas NyataFianti DamayantiBelum ada peringkat
- Gas NyataDokumen6 halamanGas NyataPriska Jesika MonanginBelum ada peringkat
- Teori Dasar Termodinamika Pembahasan Tentang EkspansiDokumen13 halamanTeori Dasar Termodinamika Pembahasan Tentang EkspansiKang AryoBelum ada peringkat
- Persamaan Keadaan Fix BangetDokumen14 halamanPersamaan Keadaan Fix Bangetsinta wulanBelum ada peringkat
- TermoDokumen13 halamanTermoKurnia AnindyaBelum ada peringkat
- Energi DalamDokumen7 halamanEnergi DalamCindy NoveriaaBelum ada peringkat
- Arianda Pratama - Materi 7 - Resume Gas IdealDokumen11 halamanArianda Pratama - Materi 7 - Resume Gas IdealMeilody IndreswariBelum ada peringkat
- Gas NyataDokumen5 halamanGas Nyatayuri windayaniBelum ada peringkat
- Persamaan Van Der WaalsDokumen4 halamanPersamaan Van Der WaalsMeyda AstriaBelum ada peringkat
- Persamaan KeadaanDokumen4 halamanPersamaan KeadaanTaufik SukmanaBelum ada peringkat
- Gas NyataDokumen10 halamanGas NyataYusuf EfendiBelum ada peringkat
- Persamaan Keadaan Dan Kompresibilitas tjt0m54005Dokumen68 halamanPersamaan Keadaan Dan Kompresibilitas tjt0m54005Fierdy AkasyaBelum ada peringkat
- PBL KimfisDokumen6 halamanPBL Kimfisyuliarahmi02Belum ada peringkat
- Gas 2Dokumen42 halamanGas 2Galang LBelum ada peringkat
- Bab VDokumen22 halamanBab VMarlin Sari100% (1)
- Gas Ideal 1Dokumen11 halamanGas Ideal 1Handika PrawiraBelum ada peringkat
- Gas NyataDokumen18 halamanGas NyataNurul Kholidah Ahmad Tontowi100% (1)
- Ketetapan Dalam Memahami Persamaan Gas Ideal, Keadaan Gas Nyata Dan Keadaan Lain Pada Gas NyataDokumen6 halamanKetetapan Dalam Memahami Persamaan Gas Ideal, Keadaan Gas Nyata Dan Keadaan Lain Pada Gas Nyatarinda kasihBelum ada peringkat
- 7 Gas Nyata Dan Persamaan Van Der WaalsDokumen5 halaman7 Gas Nyata Dan Persamaan Van Der WaalsRamaBelum ada peringkat
- Makalah Persamaan KeadaanDokumen21 halamanMakalah Persamaan Keadaankiki_riana31100% (1)
- Hukum Gas Persamaan Keadaan Gas Pada Tekanan Rendah Dibentuk Dengan Menggabungkan Serangkaian Hukum EmpirisDokumen9 halamanHukum Gas Persamaan Keadaan Gas Pada Tekanan Rendah Dibentuk Dengan Menggabungkan Serangkaian Hukum EmpirisYuliantari YuliantariBelum ada peringkat
- Tugas 9 KimdasDokumen11 halamanTugas 9 KimdasFirdianiBelum ada peringkat
- Makalah Kimfis Properties of GasDokumen25 halamanMakalah Kimfis Properties of GasNovy CendianBelum ada peringkat
- Persamaan Keadaan Van Der WaalsDokumen2 halamanPersamaan Keadaan Van Der WaalsGunturXie100% (1)
- Termodinamika Gas Ideal Dan Gas NyataDokumen26 halamanTermodinamika Gas Ideal Dan Gas NyatayogiBelum ada peringkat
- Sifat Termal MateriDokumen21 halamanSifat Termal MateriLukman AgungBelum ada peringkat
- Persamaan Keadaan Gas IdealDokumen4 halamanPersamaan Keadaan Gas IdealAgah NugrahaBelum ada peringkat
- Kelompok 4a Indralaya - PPT Tugas 3 Termodinamika DasarDokumen56 halamanKelompok 4a Indralaya - PPT Tugas 3 Termodinamika DasarM.rangga PerdanaBelum ada peringkat
- TUKIMINDokumen23 halamanTUKIMINRomega ManullangBelum ada peringkat
- Kelompok 3 KFDokumen10 halamanKelompok 3 KFpopymeylani19Belum ada peringkat
- Persamaan Keadaan Van Der WaalsDokumen2 halamanPersamaan Keadaan Van Der WaalsAsep SalahudinBelum ada peringkat
- Persamaan Van Der WaalsDokumen4 halamanPersamaan Van Der WaalsFaridah SalmaBelum ada peringkat
- Rangkuman Materi Persamaan Keadaan Kelompok 2 MUTIDokumen16 halamanRangkuman Materi Persamaan Keadaan Kelompok 2 MUTImutiaBelum ada peringkat
- (Modul 03 - Kelompok 67) Muhammad Alfayed Okto Riendi - 10217111Dokumen6 halaman(Modul 03 - Kelompok 67) Muhammad Alfayed Okto Riendi - 10217111AlfayedOktoBelum ada peringkat
- Persamaan Van Der WaalsDokumen4 halamanPersamaan Van Der WaalsBagas Ramadhan AnantoBelum ada peringkat
- Gas Nyata-Sulies PDFDokumen11 halamanGas Nyata-Sulies PDFIqbal DachiBelum ada peringkat
- Makalah Thermodinamika PersamaanVirialKoefKubik KEL2Dokumen7 halamanMakalah Thermodinamika PersamaanVirialKoefKubik KEL2FAJAR FERDIAN TelaumbanuaBelum ada peringkat
- Persamaan KeadaanDokumen12 halamanPersamaan Keadaanoselucky100% (1)
- Makalah Termo 2Dokumen9 halamanMakalah Termo 2merilaaja46Belum ada peringkat
- Termo Gas NyataDokumen18 halamanTermo Gas NyataIqbalFanshuriBelum ada peringkat
- A. Indentitas Buku A. Buku UtamaDokumen18 halamanA. Indentitas Buku A. Buku UtamaFitri handayaniBelum ada peringkat
- Termodinamika (Beberapa Konsekuensi Dari Hukum Pertama)Dokumen9 halamanTermodinamika (Beberapa Konsekuensi Dari Hukum Pertama)Ayu Tri AstutiBelum ada peringkat
- KF 1Dokumen128 halamanKF 1Winda Regita Pratiwi100% (1)
- Kimia Fisika 1Dokumen128 halamanKimia Fisika 1Dona PermataAyuBelum ada peringkat
- Gas NyataDokumen38 halamanGas NyataIkrar AbdillahBelum ada peringkat
- KF 1Dokumen127 halamanKF 1IndahLestariBelum ada peringkat
- Termodinamika Kelompok 3Dokumen16 halamanTermodinamika Kelompok 3Jantri Syah putra SembiringBelum ada peringkat
- Keadaan GasDokumen7 halamanKeadaan GasAbdullah Ibnu Ma'sumBelum ada peringkat
- Worksheets 4: Persamaan Keadaan Alokasi Waktu: 2 X 3 Sks Materi Pokok Indikator KompetensiDokumen13 halamanWorksheets 4: Persamaan Keadaan Alokasi Waktu: 2 X 3 Sks Materi Pokok Indikator Kompetensimella karlinaBelum ada peringkat
- KKC KK FKM Giz 00-20 Azi PDokumen159 halamanKKC KK FKM Giz 00-20 Azi PNTT53MADE WAHYUNIBelum ada peringkat
- Fiks Susunan Panitia Pelaksana GebyarDokumen9 halamanFiks Susunan Panitia Pelaksana GebyarNTT53MADE WAHYUNIBelum ada peringkat
- Ad Art HMJ Fisipa 2023Dokumen29 halamanAd Art HMJ Fisipa 2023NTT53MADE WAHYUNIBelum ada peringkat
- Permasalahan Sumber Daya Mineral Dan EnergiDokumen7 halamanPermasalahan Sumber Daya Mineral Dan EnergiNTT53MADE WAHYUNIBelum ada peringkat
- DPK KEBUMIAN-IPAS120304-B-2022-GanjilDokumen2 halamanDPK KEBUMIAN-IPAS120304-B-2022-GanjilNTT53MADE WAHYUNIBelum ada peringkat
- Pengembangan Ensiklopedia Ilmuwan Kimia Sebagai Buku Pengayaan Bagi Siswa Sma/Ma Dan SederajatDokumen92 halamanPengembangan Ensiklopedia Ilmuwan Kimia Sebagai Buku Pengayaan Bagi Siswa Sma/Ma Dan SederajatNTT53MADE WAHYUNIBelum ada peringkat
- DPK Statistika IPAS120406 A 2022 Genap - PDF 1Dokumen1 halamanDPK Statistika IPAS120406 A 2022 Genap - PDF 1NTT53MADE WAHYUNIBelum ada peringkat
- TATIB Raker 2022Dokumen2 halamanTATIB Raker 2022NTT53MADE WAHYUNIBelum ada peringkat
- Universitas Pendidikan Ganesha Fakultas Matematika Dan Ilmu Pengetahuan AlamDokumen6 halamanUniversitas Pendidikan Ganesha Fakultas Matematika Dan Ilmu Pengetahuan AlamNTT53MADE WAHYUNIBelum ada peringkat
- Materi 12 PDFDokumen21 halamanMateri 12 PDFNTT53MADE WAHYUNIBelum ada peringkat
- RPS Kimia FisikaDokumen10 halamanRPS Kimia FisikaNTT53MADE WAHYUNIBelum ada peringkat
- Materi 5Dokumen20 halamanMateri 5NTT53MADE WAHYUNIBelum ada peringkat
- Materi 3Dokumen14 halamanMateri 3NTT53MADE WAHYUNIBelum ada peringkat
- Materi 2Dokumen17 halamanMateri 2NTT53MADE WAHYUNIBelum ada peringkat
- Review Literatur Kel 5 - Kesetimbangan KimiaDokumen6 halamanReview Literatur Kel 5 - Kesetimbangan KimiaNTT53MADE WAHYUNIBelum ada peringkat
- Materi 4Dokumen14 halamanMateri 4NTT53MADE WAHYUNIBelum ada peringkat
- Aplikasi Termodinamika 1 - Kel 5 PDFDokumen7 halamanAplikasi Termodinamika 1 - Kel 5 PDFNTT53MADE WAHYUNIBelum ada peringkat
- Makalah Sistem Ekskresi Pada Manusia - Kelompok 2Dokumen36 halamanMakalah Sistem Ekskresi Pada Manusia - Kelompok 2NTT53MADE WAHYUNIBelum ada peringkat
- Presentasi Sistem Ekskresi Pada Manusia - Kelompok 2Dokumen35 halamanPresentasi Sistem Ekskresi Pada Manusia - Kelompok 2NTT53MADE WAHYUNIBelum ada peringkat
- Tugas Uji ValiditasDokumen4 halamanTugas Uji ValiditasNTT53MADE WAHYUNIBelum ada peringkat
- Hukum III TermodinamikaDokumen1 halamanHukum III TermodinamikaNTT53MADE WAHYUNIBelum ada peringkat
- LKM-5 Erosi Dan PelapukanDokumen9 halamanLKM-5 Erosi Dan PelapukanNTT53MADE WAHYUNIBelum ada peringkat
- Kimia Fisika Hukum II Termodinamika Bagian 1 FikssDokumen7 halamanKimia Fisika Hukum II Termodinamika Bagian 1 FikssNTT53MADE WAHYUNIBelum ada peringkat
- Review Literatur Kel 5 - Kesetimbangan KimiaDokumen7 halamanReview Literatur Kel 5 - Kesetimbangan KimiaNTT53MADE WAHYUNIBelum ada peringkat
- IPA TERAPAN - TUGAS AKHIRR FixxxDokumen28 halamanIPA TERAPAN - TUGAS AKHIRR FixxxNTT53MADE WAHYUNIBelum ada peringkat
- LKM-7 Efek RKC & Pemanasn GlobalDokumen4 halamanLKM-7 Efek RKC & Pemanasn GlobalNTT53MADE WAHYUNIBelum ada peringkat
- NurF LAPAN - HubunganPemanasanDokumen8 halamanNurF LAPAN - HubunganPemanasanNTT53MADE WAHYUNIBelum ada peringkat
- LAPORAN PEMUAIAN PANJANG BENDA - MADEWAHYUNI - 1B - s1 Pendidikan IPA - KELOMPOK 2Dokumen9 halamanLAPORAN PEMUAIAN PANJANG BENDA - MADEWAHYUNI - 1B - s1 Pendidikan IPA - KELOMPOK 2NTT53MADE WAHYUNIBelum ada peringkat
- Review Literatur - Kelompok 5Dokumen17 halamanReview Literatur - Kelompok 5NTT53MADE WAHYUNIBelum ada peringkat
- Kelompok 5 - LATIHAN SOAL HUKUM II TERMODINAMIKADokumen19 halamanKelompok 5 - LATIHAN SOAL HUKUM II TERMODINAMIKANTT53MADE WAHYUNIBelum ada peringkat