JFI (Jurnal Farmasi Indonesia)
Diunggah oleh
Yeni AdhaningrumHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
JFI (Jurnal Farmasi Indonesia)
Diunggah oleh
Yeni AdhaningrumHak Cipta:
Format Tersedia
Diterbitkan oleh Pengurus Pusat
Ikatan Apoteker Indonesia
Terbit 2 kali setahun pada bulan Januari dan Juli
Jurnal Farmasi Indonesia adalah jurnal ilmiah resmi Ikatan Apoteker
Indonesia. Isi Jurnal mencakup semua aspek dalam ilmu pengetahuan dan
teknologi kefarmasian antara lain farmakologi, farmakognosi, fitokimia,
farmasetika, kimia farmasi, biologi molekuler, bioteknologi, farmasi klinik,
farmasi komunitas, farmasi pendidikan, dan lain-lain.
Jurnal mengundang makalah ilmiah dari teman sejawat, baik apoteker
maupun bukan apoteker yang isinya dapat memacu kemajuan ilmu
pengetahuan dan teknologi di bidang kefarmasian dan bidang-bidang lain
yang berkaitan. Makalah dapat berupa laporan hasil penelitian atau telaah
pustaka.
Jurnal Farmasi Indonesia dapat diperoleh di Sekretariat PP IAI atau Redaksi
Jurnal Farmasi Indonesia
ISSN: 1412-1107
Copyright 2013 Ikatan Apoteker Indonesia
Gambar cover oleh: Arry Yanuar
Printing : PT ISFI Penerbitan
Gambar cover:
Adalah struktur Xanthin Oksidase yang diambil dari protein databank dengan kode 3EUB
dengan judul Crystal Structure of Desulfo-Xanthin Oxidase with Xanthin
Gambar struktur 3EUB diolah menggunakan Visual Molecular Dynamics (VMD), kemudian
rendering dilakukan dengan POV-RAY.
Harga Berlangganan:
Rp. 100.000,- per tahun (2 Nomor)
Dipersembahkan Untuk Kemajuan
Ilmu Pengetahuan dan Teknologi Kefarmasian
di Indonesia
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
iii
Tim Redaksi
Pemimpin Umum/
Penanggung Jawab
Drs. M. Dani Pratomo, MM, Apt
Wakil Pemimpin Umum
Drs. Wahyudi U. Hidayat, MSc, Apt
Ketua Dewan Editor
Prof. Dr. Ernawati Sinaga, MS, Apt
Editor Pelaksana
Dr. Christina Avanti MSi, Apt
Anggota Dewan Editor
Prof. Dr. Shirly Kumala, MBiomed, Apt
Prof. Dr. Eddy Meiyanto, Apt
Prof. Dr. Daryono Hadi Tjahono, MSc, Apt
Pharm. Dr. Joshita Djajadisastra, MS, PhD, Apt
Dr. Umi Athijah, MS, Apt
Dr. Arry Yanuar, MSc, Apt
Raymond R. Tjandrawinata, PhD, MS, MBA
Manajer Administrasi
Dra. Chusun Hamli, MKes, Apt
Manajer Sirkulasi
Drs. Azwar Daris, MKes, Apt
Staf Administrasi dan Sirkulasi
Evita Fitriani, SFarm, Apt
Dani Rachadian, SSos
Siti Kusnul Khotimah, SSos
Desain & layout
Ramli Badrudin
Alamat Redaksi/Penerbit
Jl. Wijayakusuma No.17
Tomang - Jakarta Barat
Telepon/Fax 021- 5671800
jfi@ikatanapotekerindonesia.net
jurnalfarmasiindonesia@gmail.com
online submission website:
jfi.iregway.com
iv
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Daftar Isi
Aktivitas Antioksidan dan Penghambat Xantin Oksidase dari
Ekstrak Buah Andaliman (Zanthoxylum acanthopodium DC.)
Ruth Elenora Kristanty, Abdul Munim, dan Katrin
122 - 128
Uji Sifat Fisikokimia Mocaf (Modified Cassava Flour)
dan Pati Singkong Termodifikasi untuk Formulasi Tablet
Wira Noviana Suhery, Auzal Halim, dan Henny Lucida
129 - 137
Penetapan Kadar Alkaloid Ekstrak dari Etanolik
Bunga Kembang Sepatu (Hibiscus rosa- sinensis L.)
Mimiek Murrukmihadi, Subagus Wahyuono,
Marchaban, dan Sudibyo Martono
138 -141
Analisis Adverse Drug Reactions Pada Pasien Asma
di Suatu Rumah Sakit, Surabaya
Amelia Lorensia, Beny Canggih, dan Rizka Indra Wijaya
142 - 150
Pengaruh Pemberian Ekstrak Etanol Umbi Mahakaan
terhadap Waktu Perdarahan, Pembekuan,
dan Jumlah Trombosit Darah Mencit Putih Betina
Surya Dharma, Dachriyanus, dan Zikra Sartika
151 - 158
Penentuan Kadar Rubraxanton pada Ekstrak Kulit Batang
Garcinia spp.
Meri Susanti, Dachriyanus, Deddy Prima Putra,
dan Fatma Sriwahyuni
159 - 165
Alga Merah sebagai Bahan Bakto Agar
Shirly Kumala, Ros Sumarny, Rum Rachmani,
dan Atut Ruswita
166 -171
Karakteritik Fisik dan Displacement Value Supositoria
Neomicin Sulfat Berbasis PEG
Alasen Sembiring Milala, Aditya Triaspradana,
dan Andrew Pierce Boehe
172-176
A Model of Rat Thrombocytopenia Induced by
Cyclophosphamide
Hery Kristiana, Florensia Nailufar, Imelda L. Winoto, and
Raymond R. Tjandrawinata
177 - 183
Petunjuk bagi Penulis
Instructions for Authors
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Artikel Penelitian
Aktivitas Antioksidan dan Penghambat Xantin Oksidase dari
Ekstrak Buah Andaliman (Zanthoxylum acanthopodium DC.)
Ruth Elenora Kristanty1, Abdul Munim2, Katrin2
ABSTRACT: The fruits of andaliman (Zanthoxylum acanthopodium DC.) are well
known in North Sumatera and commonly used as seasoning for Batak traditional
cuisine. Aims of this study were to determine the scavenging activity of free radicals and xanthine oxidase inhibitory activity from the andaliman fruit extracts
after macerated gradually in petroleum ether, dichloromethane, ethyl acetate,
n-butanol, and methanol. Activity assays were evaluated in vitro by using DPPH
and enzyme xanthine oxidase. The results showed that n-butanol extract has medium antioxidant activity with IC50 values of
53.51 g/mL and methanol extract
has strong antioxidant activity with IC50 values of
26.39 mg/mL. Xanthine oxidase
inhibitory activity of the extract given by n-butanol and methanol are very strong
with IC50 values of
3.69 g/ mL and 4.03 g/ mL.
Keywords : antioxidant, free radical, xanthine oxidase, Zanthoxylum acanthopodium DC.
Jurusan Analisa Farmasi dan
Makanan, Politeknik Kesehatan
Kemenkes Jakarta II, Indonesia.
Fakultas Farmasi, Universitas
Indonesia, Depok.
ABSTRAK: Andaliman (Zanthoxylum acanthopodium DC.) adalah tanaman
liar yang tumbuh di daerah Sumatera Utara, umumnya digunakan sebagai
rempah-rempah untuk bumbu masakan tradisional masyarakat Batak.
Penelitian ini bertujuan untuk mengetahui aktivitas peredaman radikal
bebas dan penghambatan xantin oksidase dari ekstrak buah andaliman
setelah dimaserasi secara bertingkat dengan petroleum eter, diklorometana, etil asetat, n-butanol, dan metanol. Pengujian aktivitas dilakukan secara
in vitro menggunakan DPPH dan enzim xantin oksidase. Hasil penelitian
menunjukkan bahwa ekstrak n-butanol memiliki aktivitas antioksidan yang
menengah dengan nilai IC50 sebesar 53,51 g/mL dan ekstrak metanol memiliki aktivitas antioksidan yang kuat dengan nilai IC50 sebesar 26,39 g/
mL. Aktivitas penghambatan xantin oksidase yang diberikan oleh ekstrak
diklorometana, n-butanol, dan metanol sangat kuat dengan nilai IC50 sebesar 3,9 g/mL, 3,69 g/mL, dan 4,03 g/mL.
Kata kunci: Antioksidan, radikal bebas, xantin oksidase, Zanthoxylum acanthopodium DC.
Korespondensi:
Ruth Elenora Kristanty
Email : ruth.elenora@yahoo.com
122
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Ruth Elenora Kristanty, Abdul Munim, dan Katrin
PENDAHULUAN
Radikal bebas dihasilkan secara normal di
dalam tubuh oleh metabolisme sel, peradangan,
atau ketika tubuh terpapar polusi lingkungan (1).
Jika terjadi paparan radikal yang melebihi daya
proteksi endogen maka tubuh membutuhkan
antioksidan eksogen untuk mengatasi masalahmasalah seperti penyakit degeneratif (2). Kerja
antioksidan dapat dibagi melalui dua mekanisme
utama yaitu dengan meredam radikal bebas dan
meniadakan sumber inisiasi oksidatif seperti
dengan menghambat enzim (3). Penghambatan
pembentukan radikal bebas melalui mekanisme
penghambatan xantin oksidase dapat menurun
kan jumlah radikal bebas dan melindungi tubuh
dari kerusakan jaringan (4).
Berbagai macam antioksidan sintetik seperti
butylated hydroxytoluene (BHT) telah dilaporkan memiliki beberapa efek samping seperti
kerusakan hati dan mutagenesis (5). Alopurinol
sebagai obat sintetik yang telah lama digunakan
untuk mengobati penyakit gout (6) dengan mekanisme kerja menghambat xantin oksidase (7),
juga dilaporkan memberikan banyak efek sam
ping seperti reaksi alergi pada kulit dan diare
(8). Dengan demikian, diperlukan obat alternatif
yang memiliki aktivitas pengobatan lebih baik
dan aman, yaitu dari bahan alam atau tumbuhan.
Dalam masyarakat Batak, dikenal rempah
yang tergolong tanaman liar yakni andaliman (Zanthoxylum acanthopodium DC.) yang
merupakan tanaman khas daerah Sumatera
Utara (9,10) tetapi belum dimanfaatkan seba
gai tanaman obat. Tanaman-tanaman dari genus
Zanthoxylum (bagian kulit kayu dan daun) biasanya
digunakan secara luas untuk mengobati inflamasi
dan rematik (8). Buah andaliman telah dilaporkan
memiliki aktivitas anti inflamasi (11) dan juga telah
diteliti aktivitas antioksidan ekstrak etanol buah andaliman dalam beberapa sistem pangan (11) serta
aktivitas antiradikal ekstrak etanol buah andaliman
konsentrasi 200 ppm yang menunjukkan daya inhibisi sebesar 61,81% (12). Penelitian antioksidan
terhadap buah andaliman yang telah dilaporkan
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
masih terbatas pada pengujian terhadap ekstrak
kasar dan penelitian yang mengungkap aktivitas
buah andaliman dalam menghambat xantin oksidase belum pernah dilaporkan sampai saat ini.
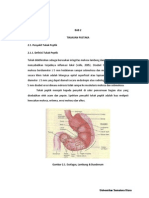
METODE PENELITIAN
Bahan Uji
Buah segar andaliman diperoleh dari Kabupaten Dairi, Sumatera Utara. Tanaman andaliman
dideter-minasi di Lembaga Ilmu Pengetahuan
Indonesia, Pusat Penelitian Biologi, Cibinong. Bagian tanaman yang digunakan sebagai simplisia
adalah buah yang berwarna hijau. Buah sebanyak
13 kg disortasi, dicuci, dan dikeringkan di lemari
pengering pada suhu 40oC. Selanjutnya simplisia
dihaluskan menggunakan blender hingga menjadi serbuk.
Bahan Kimia
Bahan kimia yang digunakan antara lain petroleum eter, n-heksana, diklorometana, etil asetat,
metanol, dan n-butanol teknis (Brataco Chemika,
Indonesia) yang telah didestilasi, kloroform p.a,
metanol p.a, dan n-heksana p.a (Merck, Jerman),
air suling demineral (Brataco Chemika, Indonesia),
dimetil sulfoksida atau DMSO (Merck, Jerman), Alopurinol (Pyridam Farma, Indonesia), silika gel G-60
(Merck, Jerman), DPPH (Sigma Aldrich, Singapura),
BHT (Sigma Aldrich, Singapura), Kuersetin (Sigma
Aldrich, Singapura), Xantin (Sigma Aldrich, Singapura), Xantin oksidase (Sigma Aldrich, Singapura).
Ekstraksi
Sebanyak 3 kg serbuk simplisia buah andaliman
dimaserasi secara bertingkat mulai dari pelarut
petroleum eter, diklorometana, etil asetat, n-butanol, dan metanol, kemudian dikocok selama 6 jam
dengan pengaduk mekanik. Campuran didiamkan
24 jam lalu disaring dan filtrat dikumpulkan dalam
suatu wadah. Total pemakaian pelarut adalah 9 L
petroleum eter, 8 L diklorometana, 8 L etil asetat,
10 L n-butanol, dan 7 L metanol. Masing-masing filtrat diuapkan menggunakan rotavapor pada suhu
123
Aktivitas Antioksidan dan Penghambat Xantin Oksidase dari Ekstrak Buah Andaliman
Tabel 1. Data Rendemen Ekstrak Buah Andaliman
No.
Ekstrak
1.
Petroleum eter
100
4.
n-butanol
65
2.
Diklorometana
3.
Etil asetat
5.
Metanol
Bobot ekstrak (g)
60
50
Uji Aktivitas Antioksidan Ekstrak
Pengujian aktivitas antioksidan secara kuantitatif melalui peredaman radikal DPPH terhadap
masing-masing ekstrak kental dilakukan menggunakan metode Blois (1958) yang dimodifikasi.
Sebanyak 1,0 mL diambil dari masing-masing
larutan uji yang telah dibuat dengan konsentrasi
10, 20, 50, 100, dan 200 ppm, dicampur dengan
1,0 mL larutan DPPH 100 g/mL dan 2,0 mL
metanol p.a serta dihomogenkan dan didiamkan
selama 30 menit pada suhu 37C terlindung dari
cahaya. Serapan larutan diukur pada panjang
gelombang 517 nm. Pengujian dilakukan duplo.
Prosedur yang sama juga dilakukan terhadap
BHT sebagai larutan standar dengan konsentrasi
1, 2, 4, 10, dan 16 ppm.
Persentase inhibisi terhadap radikal DPPH
dari masing-masing konsentrasi larutan sampel
dapat dihitung dengan persamaan :
100%
Keterangan :
Q = persentase inhibisi (%)
A0 = serapan kontrol (pelarut + DPPH)
A1 = serapan larutan uji (pelarut + DPPH + sampel)
124
3000
30
50-60C kecuali ekstrak n-butanol pada suhu 75C
sehingga diperoleh ekstrak kental petroleum eter,
diklorometana, etil asetat, n-butanol dan metanol,
lalu ditimbang dan dihitung rendemennya terhadap bobot simplisia awal (tabel 1).
Bobot Simplisia (g)
Rendemen (%)
3,33
2,00
1,67
2,17
1,00
Semakin kecil nilai IC menunjukkan semakin
50
tinggi aktivitas antioksidannya (7). Ekstrak yang
mempunyai nilai IC50 antara 10-50 g/mL adalah
ekstrak dengan aktivitas antioksidan yang kuat (13).
Uji Aktivitas Penghambatan Xantin Oksidase
oleh Ekstrak
Pada penelitian ini, dilakukan pengujian aktivitas penghambatan xantin oksidase oleh ma
sing-masing ekstrak kental dengan metode Owen
dan Johns (1999) yang dimodifikasi. Pengujian
sampel dilakukan duplo.
Larutan yang disiapkan untuk pengujian terdiri dari larutan xantin sebagai substrat, larutan
enzim (xantin oksidase), dan larutan uji. Larutan
substrat yang digunakan adalah larutan xantin
0,15 mM yang diperoleh dari pengenceran larutan stok 1 mM dengan menimbang 15,21 mg
xantin dan diencerkan dengan air demineralisasi
dalam labu ukur 100 mL. Larutan xantin oksidase
0,1 unit/mL dibuat dengan menimbang 9,09 mg
xantin oksidase dan dilarutkan dengan larutan
dapar fosfat sampai 10,0 mL. Larutan uji diperoleh dengan menimbang 10,0 mg ekstrak kental
dan dilarutkan dalam sedikit DMSO kemudian
dilarutkan dalam dapar fosfat menggunakan labu
ukur 10 ml sebagai larutan induk (1000 ppm) lalu
diencerkan dengan dapar fosfat hingga diperoleh
konsentrasi akhir larutan sampel sebesar 100,
50, 20, 10, 5 dan 1 ppm.
Kondisi optimum pengujian mengacu pada
optimasi yang telah dilakukan sebelumnya, yaitu
pada waktu inkubasi 40 menit, suhu 30oC, pH 7,8,
dan konsentrasi substrat (xantin) 0,15 mM. Masing-masing sampel sebanyak 1,0 mL dimasukkan
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Ruth Elenora Kristanty, Abdul Munim, dan Katrin
ke dalam tabung reaksi terpisah dengan variasi
konsentrasi tertentu. Selanjutnya ke dalamnya ditambahkan 2,9 mL larutan dapar fosfat dan 2,0 mL
xantin lalu diprainkubasi pada suhu 30oC selama
10 menit. Xantin oksidase 0,1 unit/mL sebanyak
0,1 mL ditambahkan lalu diinkubasi kembali pada
suhu 30oC selama 30 menit. Setelah masa inkubasi, ke dalam campuran dengan segera ditambahkan asam klorida 1N sebanyak 1,0 mL untuk
menghentikan reaksi dan dihomogenkan. Campuran larutan uji selanjutnya diukur serapannya
menggunakan spektrofotometer UV pada panjang
gelombang hasil optimasi (284 nm) untuk melihat besarnya pembentukan asam urat yang terjadi
dalam larutan uji kemudian ditentukan seberapa
besar persen hambatan ekstrak yang diujikan terhadap xantin oksidase.
Persentase hambatan xantin oksidase (XO) dihitung dengan persamaan berikut (14):
% hambatan xantin oksidase = 1
Keterangan :
100%
A = selisih serapan blanko dengan kontrol blanko (A1-A0)
B = selisih serapan sampel dengan kontrol sampel (B1-B0)
Nilai IC50 diperoleh melalui analisis regresi
linier yang diplot antara konsentrasi sampel terhadap persentase hambat (1). Pengujian juga
dilakukan terhadap blanko, kontrol blanko, dan
kontrol sampel.
Penapisan Fitokimia
Terhadap ekstrak yang aktif menurut hasil uji
peredaman radikal DPPH dan uji penghambatan
xantin oksidase, dilakukan pemeriksaan kandungan kimia dengan beberapa pereaksi kimia antara
lain pereaksi untuk alkaloid, flavonoid, triterpenoid/steroid, glikosida, saponin, dan tanin.
HASIL DAN PEMBAHASAN
Serbuk buah andaliman dimaserasi secara
bertingkat mulai dari pelarut non polar sampai
dengan pelarut polar yang bertujuan untuk mem-
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Tabel 2. Hasil uji antioksidan ekstrak buah
andaliman
Sampel
Konsentrasi
%
IC50
(g/mL) inhibisi (g/mL)
200 14,92
Ekstrak
100
14,61
petroleum
50
8,19 220,67
eter
20 6,83
10 6,29
200 33,71
Ekstrak
100
18,27
88,26
diklorometana 50 11,44
20 12,12
10 12,44
Ekstrak
etil asetat
200 29,91
100
18,34
83,50
50
9,18
20 5,99
10 1,82
Ekstrak
metanol
100 47,66
50
24,87
20 12,71
10 7,27
Ekstrak
n-butanol
BHT
200 46,97
100
25,89
50
14,43 53,51
20 8,95
10 6,27
26,39
16 37,09
10 26,65
4
15,22 5,52
2 9,23
1 6,87
peroleh ekstrak dengan rentang kepolaran yang
berbeda. Diperoleh ekstrak petroleum eter dan
ekstrak n-butanol dengan rendemen yang lebih
besar dibandingkan ekstrak lainnya dan ekstrak
metanol sebagai ekstrak dengan rendemen paling
kecil.
Uji Aktivitas Antioksidan Ekstrak Buah Andaliman
Pengujian aktivitas antioksidan secara kuantitatif terhadap masing-masing ekstrak buah andaliman dengan metode peredaman radikal DPPH
menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum larutan DPPH yaitu
125
Aktivitas Antioksidan dan Penghambat Xantin Oksidase dari Ekstrak Buah Andaliman
Tabel 3. Hasil uji penghambatan xantin oksidase oleh ekstrak buah andaliman
Sampel
Konsentrasi %
IC50
(g/mL)
inhibisi
(g/mL)
Ekstrak
1
31,1
petroleum
5
37,8
eter
10 53,6 9,9
20 57,1
50 48,5
100 49,9
1 47,3
Ekstrak
5
56,6
diklorometana 10
54,0
3,9
20 27,7
50
50,6
100 67,8
1 49,7
Ekstrak etil
5
53,1
asetat
10 32,1 9,54
20 42,9
50 47,3
100 55,0
Ekstrak
n- butanol
1 39,5
5
41,3
10
46,4
3,69
20 46,4
50 66,4
100 69,9
1 41,6
Ekstrak
5
50,7
metanol 10 49,6 4,03
20 48,7
50 54,7
100 56,6
517 nm. Pengujian larutan sampel dan standar
dilakukan untuk mengetahui kemampuan anti
oksidan yang diberikan oleh ekstrak dan standar .
Hasil pengujian terhadap sampel menunjukkan bahwa ekstrak n-butanol dan metanol memiliki nilai IC50 lebih kecil dibandingkan ekstrak
lainnya yaitu dengan nilai IC50 sebesar 53,51 dan
26,39 g/mL. Ekstrak yang mempunyai nilai IC50
antara 50-100 g/mL adalah ekstrak dengan aktivitas antioksidan menengah dan ekstrak yang
mempunyai nilai IC50 antara 10-50 g/mL adalah
ekstrak dengan aktivitas antioksidan yang kuat
(13). Berdasarkan rentang tersebut, ekstrak n-
126
Tabel 4. Hasil uji penghambatan xantin oksidase oleh alopurinol
Sampel Konsentrasi %
(g/mL)
inhibisi
Alopurinol 0,1
0,25
0,5
1
IC50
(g/mL)
45,11
55,42 0,02
74,6
87,56
butanol memiliki aktivitas antioksidan menengah
dan ekstrak metanol memiliki aktivitas antioksidan yang kuat. Diduga ekstrak buah andaliman
mengandung senyawa yang memiliki aktivitas
antioksidan. BHT sebagai antioksidan sintetik
memiliki nilai IC50 5,5 g/mL yang menunjukkan
bahwa senyawa standar tersebut memiliki aktivitas antioksidan yang sangat kuat (<10g/mL). Nilai IC50 setiap ekstrak dapat dilihat pada Tabel 2.
Uji Aktivitas Penghambatan Xantin Oksidase
Pengujian aktivitas penghambatan masing-ma
sing ekstrak buah andaliman terhadap xantin oksidase dilakukan secara in vitro. Prinsip dasar pengujian ini adalah mengukur serapan dari asam
urat sebagai produk akhir dari reaksi katalisis xantin oksidase terhadap substratnya yaitu xantin (17)
menggunakan spektrofotometer UV-Vis pada panjang gelombang hasil optimasi, suhu optimum, pH
optimum dan konsentrasi substrat yang optimum.
Panjang gelombang maksimum yang digunakan
adalah 284 nm. Dari hasil pengukuran, kondisi optimum ditunjukkan pada suhu 30OC dan pH 7,8 dan
konsentrasi substrat yang digunakan pada uji penghambatan aktivitas xantin oksidase adalah 0,15 mM.
Pengujian larutan blanko dan kontrol blanko
dilakukan untuk mengetahui aktivitas enzim tanpa penambahan ekstrak, pengujian larutan sampel
dan alopurinol sebagai standar dilakukan untuk
mengetahui kemampuan penghambatan aktivitas
enzim yang diberikan oleh ekstrak dan senyawa
standar, sedangkan kontrol sampel dan kontrol
alopurinol dilakukan sebagai faktor koreksi terhadap larutan sampel dan senyawa standar.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Ruth Elenora Kristanty, Abdul Munim, dan Katrin
Ekstrak yang tidak dapat larut dengan air bebas karbondioksida P dilarutkan terlebih dahulu
dengan 5 tetes DMSO (dimetil sulfoksida). Sebagai
standar digunakan senyawa alopurinol. Hasil pengujian menunjukkan bahwa alopurinol memiliki
efek penghambatan aktivitas xantin oksidase de
ngan nilai IC50 0,02 g/mL (tabel 4). Hasil pengujian aktivitas penghambatan xantin oksidase oleh
masing-masing ekstrak menunjukkan ekstrak
n-butanol memiliki nilai IC50 paling kecil diban
dingkan ekstrak lainnya yaitu 3,69 g/mL (Tabel
3) yang menunjukkan ekstrak n-butanol memiliki
kemampuan penghambatan enzim yang sangat
kuat.
Diduga ekstrak buah andaliman ini mengandung senyawa yang memiliki aktivitas penghambat xantin oksidase.
Penapisan Fitokimia
Penapisan fitokimia dilakukan terhadap ekstrak n-butanol dan metanol sebagai ekstrak yang
memiliki aktivitas antioksidan dan penghambatan
xantin oksidase. Penapisan fitokimia bertujuan
untuk mengetahui keberadaan senyawa berda
sar
kan golongannya sebagai informasi
a
wal kandungan senyawa yang terdapat pada
ekstrak aktif. Hasil identifikasi menunjukkan
bahwa ekstrak n-butanol mengandung senyawa
golongan alkaloid, flavonoid, glikosida, tanin,
DAFTAR PUSTAKA
1. Langseth L. Oxidant, Antioxidant, and Disease Prevention. Belgium: International Life Science Institute press 1995.
2. Suryanto E, Sastrohamidjojo H, Raharjo S, Tranggono. Antiradical activity of andaliman (Zanthoxy-
antrakuinon, dan terpenoid kecuali saponin dan
tanin. Diduga bahwa komponen yang aktif dari
ekstrak n-butanol dan metanol berasal dari golongan senyawa tersebut.
KESIMPULAN DAN SARAN
Berdasarkan hasil pengujian aktivitas antioksidan ekstrak buah andaliman (Zanthoxylum acanthopodium DC.) melalui peredaman radikal bebas DPPH, diperoleh nilai IC50 ekstrak n-butanol
sebesar 53,51 g/mL dan ekstrak metanol sebesar
26,39 g/mL. Berdasarkan hasil pengujian penghambatan xantin oksidase, ekstrak n-butanol dan
metanol memiliki aktivitas yang kuat dengan nilai
IC50 sebesar 3,69 g/mL dan 4,03 g/mL.
Perlu dilakukan isolasi lebih lanjut senyawa
murni dari ekstrak n-butanol maupun dari ekstrak
metanol buah andaliman (Zanthoxylum acanthopodium DC.) yang memiliki aktivitas antioksidan
dan penghambat xantin oksidase.
UCAPAN TERIMA KASIH
Penelitian ini dilaksanakan di Universitas Indonesia dan dibiayai oleh beasiswa program magister dari Politeknik Kesehatan Kementerian Kesehatan Jakarta II.
4. Lin CN, Huang AM, Lin KW, Hour TC, Ko HH, Yang
SC, Pu YS. Xanthine oxidase inhibitory terpenoids
of Amentotaxus formosana protect cisplatin-induced cell death by reducing reactive oxygen species (ROS) in normal human urothelial and blad-
der cancer cells. Phytochemistry 2010; 71(1718):
21402146.
lum acantho-podium DC.) fruit extract. Indonesian
5. Sahgal G, Ramanathan S, Sasidharan S, Mordi MD,
AT, Remyaraju A. In vitro xanthine oxidase inhibitory
lic Swietenia mahagoniseed extracts. Molecules
Food and Nutrition Progress 2004; II (1): 15-19.
3. Umamaheswari M, Asokkumar K, Sivashanmugam
activity of the fractions of Erythrina stricta Roxb.
Journal of Ethnopharmacology 2009; 124: 646-648.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Ismail S, Mansor SM. In vitro antioxidant and xanthine oxidase inhibitory activities of methano2009; 14: 4476-4485.
6. Pacher P, Nivorozhkin A, Szabo C. Therapeutic ef-
127
Aktivitas Antioksidan dan Penghambat Xantin Oksidase dari Ekstrak Buah Andaliman
fects of xanthine oxidase inhibitors: renaissance
half a century after the discovery of allopurinol.
Pharmacology Review 2006; 58(1): 87114.
7. Marks DB, Marks AD, Smith CM. Basic Medical
13. Apaya KL, Chichioco-Hernandez CL. Xanthine oxi-
dase inhibition of selected Philippine medicinal
plants. Journal of Medicinal Plants Research 2011;
5(2): 289-292.
Biochemistry: AClinical Approach. Brahm UP. Bio
14. Blois MS. Antioxidant determinations by the use
8. McInnes GT, Lawson DH, Jick H. Acute adverse re-
15. Siregar BL. Andaliman (Zanthoxylum acanthopo-
ki
mia Kedokteran Dasar [Terjemahan] Jakarta.
Buku Kedokteran EGC; 2000.
actions attributed to allopurinol in hospitalised
patients. Annals of the Rheumatic Disease 1981;
40: 245-249.
9. Owen P, Johns T. Xanthine oxidase inhibitory activity of northeastern North American plant reme-
dies used for gout. Journal of Ethnopharmacology
1999; 64: 149-160.
10. Tahir I, Wijaya K, Widianingsih D. Terapan Analisis
Hansch Untuk Aktivitas Antioksidan senyawa Turunan Flavon/Flavonol; 2003.
11. Yanti, Pramudito, TE, Nuriasari N, Juliana K. Lemon
1200.
dium DC.) di Sumatera Utara: Deskripsi dan Perkecambahan. Jurnal Hayati 2002; 10(1): 38-40.
16. Negi JS, Bish VK, Bhandari AK, Singh P, Sundriyah
RC.. Chemical constituents and biological activities of the genus Zanthoxylum: A review. African
Journal of Pure and Applied Chemistry 2011;
5(12): 412-416.
17. Molyneux, P The use of the stable free radical diphenyl picryl-hydrazyl (DPPH) for estimating antioxidant activity. Journal of Science and Techno
logy 2004; 26(2): 211-219.
pepperfruitextract (Zanthoxylumacanthopodium
18. Tensiska C, Wijaya H, Nuri Andarwulan. Aktivitas
phagesin vitro. American Journal of Biochemistry
pangan dan kestabilan aktivitasnya terhadap
DC.) suppresses the expression of inflammatorymediators in lipopolysaccharide-inducedmacroand Biotechnology 2011; 7(4): 176-186.
12. Phongpaichit S, Nikom J, Rungjindamai N.,
antioksidan ekstrak buah andaliman (Zanthoxylum acanthopodiumDC) dalam beberapa sistem
kondisi suhu dan pH. Jurnal teknologi dan industri
pangan 2003; 16 (1): 29-39.
Sakayaroj, J., Hutadilok-Towatana, N., Rukachai-
19. Vaya J, Aviram M. Nutritional antioxidants : mecha
cinia plants. FEMS Immunology and Medical Mi-
munology, Endocrine & Metabolic Agents 2001; 1:
sirikul, V., Kirtikara, K. Biological activities of ex-
tracts from endophytic fungi isolated from garcrobiology 2007; 51: 517-525.
128
of a stable free radical. Nature 1958; 181:1199-
nism of action, analyses of activities and medical
applications. Current Medicinal ChemistryIm99-117.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Artikel Penelitian
Uji Sifat Fisikokimia Mocaf (Modified cassava Flour)
dan Pati Singkong Termodifikasi
untuk Formulasi Tablet
Wira Noviana Suhery1, Auzal Halim2, Henny Lucida2
ABSTRACT: Utilization of cassava starch as an excipient in the tablet formulation
is still very limited. Various modifications to the cassava starch has been carried out
to obtain a better starch properties. The aim of this study was to examine the physicochemical properties of MOCAF and modified cassava starch as an excipient for
tablet formulation, especially for direct compression method. MOCAF and modified
cassava starch is a product of flour and cassava starch is modified mainly by lactic acid bacteria (Lactobacillus sp). Then the results of these modifications will be
evaluated physicochemical properties, including examination of the surface shape
of starch granules using SEM, thermal analysis by DTA, the pattern of starch crystallographic by X-ray diffraction, adsorption isotherm, and the content of amylose.
The results showed that MOCAF and modified cassava starch granule were rougheroccurred some holes presented distinctively- and more crystalline than Starch 1500.
Meanwhile, the result of adsorption isotherms MOCAF and modified cassava starch
showed a model type II of adsorption isotherms. Another results show that the amylose content of cassava starch modified 48 hours has the highest amylose content
that is equal to 33.5714%.
Keywords: MOCAF, Modified Cassava Starch, Lactic Acid Bacteria, Tablets
Akademi Farmasi Ranah
Minang, Padang
2
Universitas Andalas , Padang
1
Korespondensi :
Wira Noviana Suhery
Email : noviara23@gmail.com
ABSTRAK: Penggunaan pati singkong sebagai bahan tambahan dalam formulasi
tablet masih sangat terbatas. Berbagai modifikasi terhadap pati singkong telah
dilakukan untuk mendapatkan sifat pati yang lebih baik. Tujuan penelitian ini
adalah untuk menguji sifat fisikokimia MOCAF dan pati singkong termodifikasi
sebagai bahan tambahan dalam formulasi tablet khususnya untuk metoda cetak
langsung. MOCAF dan pati singkong termodifikasi merupakan produk tepung dan
pati singkong yang dimodifikasi terutama oleh bakteri asam laktat (Lactobacillus
sp). Kemudian hasil modifikasi ini akan dievaluasi sifat fisikokimianya, diantaranya pemeriksaan bentuk permukaan granula pati menggunakan SEM (Scanning
Electron Microscope), analisis panas dengan DTA, pola kristalografi pati dengan
difraksi sinar X, adsorpsi isoterm, dan kadar amilosa. Hasilnya menunjukkan bahwa MOCAF dan pati singkong termodifikasi mengalami perlubangan pada permukaan granulanya, dan lebih bersifat kristal jika dibandingkan dengan Starch 1500.
Sementara itu, dari hasil pemeriksaan adsorpsi isoterm MOCAF dan pati singkong
termodifikasi menunjukkan model adsorpsi isoterm tipe II. Hasil lainnya menunjukkan bahwa kadar amilosa pati singkong termodifikasi 48 jam mempunyai kadar amilosa paling tinggi yaitu sebesar 33,5714%.
Kata kunci: MOCAF, Pati Singkong Termodifikasi, Bakteri Asam Laktat, Tablet
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
129
Sifat Fisikokimia Mocaf dan Pati Singkong Termodifikasi untuk Formulasi Tablet
PENDAHULUAN
Produk olahan singkong telah banyak digunakan sebagai bahan baku eksipien dalam industri farmasi. Diantaranya adalah pati singkong
(amylum manihot) sebagai bahan pengikat dan
penghancur pada formulasi tablet, maltodekstrin
sebagai bahan penyalut lapis tipis tablet ataupun
sorbitol, manitol dan dekstrosa pada formulasi
sirup dan berbagai produk makanan dan minuman lainnya (1,2).
Berbagai teknologi pengembangan telah banyak dilakukan untuk menghasilkan produk yang
memiliki kualitas tinggi. Salah satu pengembang
an produk dari singkong sebagai eksipien dalam
bidang farmasi adalah dengan semakin banyaknya dilakukan modifikasi terhadap pati, mulai
dari modifikasi secara kimia, fisika ataupun secara enzimatis yang bertujuan untuk mendapatkan sifat fisikokimia yang lebih baik. Pada bidang
pangan pun telah berhasil dilakukan modifikasi
terhadap tepung singkong dengan cara fermentasi menggunakan bakteri asam laktat (Lactobacillus sp) yang umum dikenal sebagai tepung
MOCAF/MOCAL (3, 4, 5, 6).
Penggunaan MOCAF dalam bidang makanan
telah banyak digunakan dan memberikan hasil
yang memuaskan. Seperti penggunaannya dalam
industri roti, mie instan, dan produk makanan
lainnya sebagai bahan pengganti terigu yang
dapat memberikan dampak positif dalam menurunkan biaya produksi. Namun penggunaannya
dalam bidang farmasi khususnya sebagai eksi
pien dalam formulasi tablet belum dilakukan (4).
MOCAF (Modified Cassava Flour) adalah pro
duk tepung dari singkong (Manihot esculenta
Crantz) yang diproses menggunakan prinsip
modifikasi sel singkong secara fermentasi, terutama oleh mikroba bakteri asam laktat (4).
Pada proses fermentasi ini akan menghasilkan enzim pektinolitik dan sellulolitik yang dapat
menghancurkan dinding sel singkong sedemikian
rupa sehingga terjadi liberasi granula pati. Hal
ini akan menyebabkan perubahan karakteristik
dari tepung yang dihasilkan berupa naiknya viskositas, kemampuan gelasi, dan daya rehidrasi.
130
Selain itu terjadi pula perlubangan dari granula
pati MOCAF, sehingga menyebabkan permukaan
yang tidak rata dari granula pati yang akan memperkuat ikatan antar butiran (4).
Berdasarkan itulah penulis tertarik untuk
menguji sifat fisikokimia MOCAF untuk formulasi
tablet. Dalam penelitian ini juga akan digunakan
pati singkong termodifikasi yaitu pati singkong
yang difermentasi menggunakan mikroba yang
sama dengan fermentasi MOCAF, sehingga dapat
dibandingkan mana yang memberikan hasil yang
paling baik. Sebagai pembanding akan digunakan pati singkong murni (amylum manihot) dan
Starch 1500 yang telah lazim digunakan sebagai
eksipien dalam formulasi tablet.
METODE PENELITIAN
Bahan
MOCAF, umbi singkong segar (Manihot esculenta Crantz) yang di ambil dari Gurun Panjang,
Kel. Gunung Sarik Kec. Kuranji Padang. MOCAF
diperoleh dari Koperasi Gemah Ripah Loh Jinawi
Kabupaten Trenggalek Jawa Timur., Media, Starter fermentasi (Lactobacillus sp), Starch 1500,
Aquadest.
Cara Kerja
Pembuatan pati asli (amylum manihot)
Lakukan sortasi pada singkong, kupas kulitnya, cuci dengan air mengalir dan rendam selama
2 jam. Singkong (2,5 kg) yang telah direndam kemudian dihaluskan, suspensikan dalam 10 kali
volume aquadest, stirrer selama 5 menit dan saring melalui 2 lapis kain katun tipis. Filtrat didiamkan selama 1 jam untuk mendapatkan sedimen pati. Endapan dicuci 1 kali dengan aquadest
dan dikeringkan pada 40C selama 12 jam dalam
oven. Pati dihaluskan dalam lumpang untuk
mencegah penggumpalan granul dan memperkecil ukuran partikelnya (3).
Pembuatan Pati Singkong Termodifikasi
a. Pembuatan Starter Fermentasi
Siapkan chips ketela sebanyak 50 g letakJurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Wira Noviana Suhery, Auzal Halim, dan Henny Lucida
kan pada beker glass, tambahkan dengan air
sebanyak kurang lebih 500 ml, semua chips
singkong harus terendam, tambahkan inokulat mikroba (Lactobacillus sp) sebanyak 2 g
dan kultur media sebanyak 7 g dan biarkan
selama 24 jam.
b. Proses fermentasi
Semua alat disterilkan terlebih dahulu menggunakan autoklaf. Sebanyak 200 gram pati
singkong dimasukkan kedalam erlenmeyer
yang telah berisi media (50 mg) dan starter
fermentasi (2 ml) dalam 500 ml aquadest yang
telah disterilkan. Dilakukan fermentasi dalam
shaker dengan kecepatan 120 rpm selama 48
jam dan 72 jam. Setelah proses fermentasi selesai, buang airnya. Cuci pati dengan aqudest
sebanyak 2 kali, kemudian endapkan dan ke
ringkan pada suhu 40C selama 24 jam. Pati
kemudian dihaluskan untuk memperkecil
ukuran partikel.
Evaluasi Sifat Fisika dan Kimia Partikel
1. Analisis Swelling Power. Pati dengan konsentrasi 1% dipanaskan pada waterbath dengan
suhu 60C, selama 30 menit, kemudian di
sentrifus dengan kecepatan 3000 rpm selama
30 menit, lalu supernatan dipisahkan dari
endapan. Nilai swelling power diukur dengan
membagi berat endapan (pasta) dengan berat pati kering sebelum dipanaskan (g/g).
2. Suhu gelatinisasi. Suhu dimana terjadinya
pembengkakan pati secara irreversible (viskositas meningkat tajam) disebut dengan
suhu gelatinisasi. Ditentukan dengan membuat kurva antara viskositas vs suhu. Suhu
gelatinisasi merupakan titik potong kurva antara suhu dan viskositas pati.
3. Densiti Benar ditentukan dengan metoda pikno-meter (7).
4. Density Nyata (n) /Bulk Density Untapped
dan Densiti Mampat (m)/Bulk Density Tapped
di ukur menggunakan tap volumeter (7).
5. Faktor Hausner (7). Faktor Hausner (Hf)
adalah perbandingan antara bobot jenis
mampat (m) dengan bobot jenis nyata (n).
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
6. Kompresibilitas dan Porositas (E) (8). Peme
riksaan sudut angkat (7). Sebanyak 30 gram
zat uji dimasukkan ke dalam silinder dengan
diameter dan tinggi tertentu. Kemudian di
letakkan di atas bidang datar yang telah di
alas dengan kertas grafik. Zat uji diratakan,
silinder logam di angkat secara perlahan-
lahan dan tegak lurus sampai semua zat tertinggal. Tinggi puncak tumpukan dan diame
ternya di ukur. Sudut angkat () dihitung de
ngan persamaan:
tinggi puncak tumpukan (h)
tg =
r
7. Distribusi Ukuran partikel (7, 8).
8. Distribusi ukuran partikel ditentukan dengan
mikroskop inverted Zeiss Axiovert 40 CFL.
9. Daya Penyerapan Air menggunakan alat Enslin (7,8).
10. Adsorpsi Isoterm (7). Sejumlah serbuk dimasukkan dalam botol timbang dan dikeringkan
sampai bobot konstan didalam oven vacum,
kemudian disimpan dalam desikator pada
kelembaban relatif tertentu (0-100%) pada
suhu konstan selama 5 hari. Untuk mendapatkan kelembaban relatif yang diinginkan digunakan metode desikator dengan mengguna
kan larutan asam sulfat pekat pada konsentrasi tertentu. Jumlah uap air yang diserap
dapat ditentukan dari pertambahan berat
serbuk setelah penyimpanan.
11. Analisis Bentuk dan Permukaan Partikel.
Bentuk dan permukaan partikel diperiksa
dengan alat Scanning Electron Microscope
(SEM).
12. Analisis panas dengan Differential Thermal
Analysis (DTA).
13. Difraksi X-Ray.
14. Mikroskop polarisasi. Bentuk dan ukuran pati
diamati dengan menggunakan Olympus BX05 Polarized Light Microscope.
15. Penetapan kadar amilosa dilakukan secara
iodometri berdasarkan reaksi antara amilosa
dengan senyawa iod yang menghasilkan warna biru, kemudian diukur dengan spektrofotometer pada panjang gelombang 625 nm.
131
Sifat Fisikokimia Mocaf dan Pati Singkong Termodifikasi untuk Formulasi Tablet
Kadar amilosa dihitung berdasarkan persamaan kurva standar amilosa.
HASIL DAN PEMBAHASAN
Berdasarkan hasil analisis sifat fisika dan kimia partikel masing-masing bahan baku didapatkan sifat yang berbeda dari masing-masing ba
han baku seperti yang terlihat pada Tabel 1. Hasil
pemeriksaan kompresibilitas dan faktor Hausner
bahan baku menunjukkan bahwa masing-masing
bahan baku mempunyai sifat alir sedang sampai
buruk. Sifat ini juga ditunjang oleh faktor Hausner masing-masing partikel yang berkisar antara 1,2401 - 1,4413. Dari hasil yang diperoleh
Starch 1500 yang memiliki harga faktor Hausner
dan kompresibilitas yang paling kecil, sedangkan
MOCAF memiliki harga faktor Hausner dan kompresibilitas yang paling besar. Sementara pati termodifikasi 72 memiliki nilai faktor Hausner dan
kompresibilitas yang lebih kecil daripada pati
singkong. Hal ini menunjukkan bahwa dengan
adanya fermentasi terdapat perbaikan dari sifat
alir pati singkong walaupun tidak sebaik Starch
1500. Sedangkan MOCAF memiliki harga faktor Hausner dan kompresibilitas yang besar, hal
ini disebabkan oleh adanya komponen selain
pati (serat) yang terdapat didalam MOCAF yang
mengakibatkan adanya pengaruh terhadap sifat
aliran dan kemampuan termampatkannya. Hal
ini juga didukung oleh hasil pemeriksaan sudut
angkat bahan baku yang menunjukkan bahwa
pati singkong dan MOCAF mempunyai sifat alir
yang kurang baik (sudut angkat 30-40). Sementara pati termodifikasi dan Starch 1500 mempunyai sifat alir yang baik (sudut angkat 25-30)
(7,9). Kadar amilosa pati singkong, MOCAF, pati
singkong termodifikasi 48 jam, pati singkong
termodifikasi 72 jam, Starch 1500 berkisar antara 17,3571% - 33,5714%. Hasil ini menunjukkan bahwa kadar amilosa tertinggi dimiliki
oleh pati termodifikasi 48 jam, hal ini disebabkan karena aktivitas bakteri yang optimal pada
lama fermentasi 48 jam (awal fase stationer).
Kemungkinan besar bahwa peningkatan yang
tampak pada kandungan amilosa pati singkong
termodifikasi disebabkan oleh intensifikasi dari
Tabel.1. Hasil pemeriksaan sifat fisika dan kimia partikel pati singkong, MOCAF, pati singkong
termodifikasi, dan Starch 1500
No
Parameter
Pati
Singkong
MOCAF
Pati Modifikasi 48
Pati Modifikasi 72
Starch
1500
Densiti benar (g/ml)
1,4954
1,4733
1,5316
1,4857
1,5158
Densiti mampat (g/ml)
0,6451
0,5882
0,6896
0,7547
0,8000
2
4
5
6
7
8
9
10
11
132
Densiti nyata (g/ml)
Faktor Hausner
Kompresibilitas (%)
Porositas (%)
Sudut Angkat ()
Kandungan air (%)
Swelling power (g)
Kadar Amilosa (%)
Suhu gelatinisasi (C)
0,4651
1,3870
27,9026
35,7696
38,75
14,56
5,998
24,9285
59,17
0,4081
1,4413
30,6188
40,1751
31,05
8,91
7,909
17,3571
53,36
0,5000
1,3792
27,4942
32,6455
29,74
11,44
6,605
33,5714
60,91
0,5714
1,3207
24,2877
28,8483
29,12
13,08
6,657
26,1428
60,54
0,6451
1,2401
24,0117
23,4133
28,07
6,38
9,442
28,7857
58,47
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Wira Noviana Suhery, Auzal Halim, dan Henny Lucida
a. Starch 1500
d. Pati modifikasi 48 jam
Gambar 1. Foto SEM
b. Pati Singkong
c. MOCAF
e. Pati modifikasi 72 jam
Gambar 2. Diaftogram Sinar X
(A.b = pati singkong; B.b = Starch 1500; C.b = Mocaf; D.d = Pati termodifikasi)
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
133
Sifat Fisikokimia Mocaf dan Pati Singkong Termodifikasi untuk Formulasi Tablet
a. Starch 1500
b. Pati Singkong
d. Pati modifikasi 48 jam
jam
Gambar 3. Foto Mikroskop Polarisasi
warna biru oleh fraksi linier yang dihasilkan oleh
enzim/hidrolisis asam amilopektin pada daerah
amorf dari granula pati selama fermentasi. Kadar
amilosa ini akan berkaitan dengan berbagai sifat
pati (3, 10, 11, 12).
Hasil pemeriksaan swelling power pati singkong, pati termodifikasi, MOCAF dan Starch 1500
menunjukkan bahwa Starch 1500 memiliki nilai
swelling power yang paling tinggi yaitu 9,442 g,
MOCAF; 7,909 g, pati termodifikasi 72 jam; 6,657
g, pati termodifikasi 48 jam; 6,605 g; pati singkong
5,998 g. Nilai swelling power berkaitan dengan sifat amilosa yang terkandung dalam pati. Semakin
tinggi kadar amilosa pada pati maka semakin rendah nilai swelling power yang dimilikinya (8, 13).
Hasil pemeriksaan temperatur gelatinisasi
menunjukkan bahwa temperatur gelatinisasi
tertinggi dimiliki oleh pati termodifikasi 48 jam
yaitu 60,91C, diikuti oleh pati termodifikasi 72
jam (60,54C), pati singkong (59,17C), starch
134
c. MOCAF
e. Pati modifikasi 72 jam
jam
1500 (58,47C) dan MOCAF (53,36C). Hasil ini
menunjukkan sifat gelatinisasi suatu pati, artinya
semakin rendah temperatur gelatinisasi maka
akan semakin cepat suatu pati mengalami proses
gelatinisasi, demikian pula sebaliknya sehingga
dari sifat ini kita bisa mengetahui kisaran suhu
aman untuk perlakuan bahan baku pati (10).
Hasil foto SEM (Scanning Electron Microscope)
pada MOCAF, pati termodifikasi 48 dan 72 jam
memperlihatkan adanya perubahan struktur dari
permukaan granula pati (perlubangan) yang dihasilkan pada proses fermentasi. Namun jumlah
banyaknya granula pati yang dilubangi bervariasi
antara MOCAF, pati termodifikasi 48 jam dan pati
termodifikasi 72 jam. Hal ini disebabkan karena
adanya perbedaaan waktu fermentasi antara
MOCAF, pati termodifikasi 48 jam dan pati termodifikasi 72 jam. Dimana dari hasil foto SEM
terlihat bahwa pati termodifikasi 48 jam menghasilkan perlubangan pati yang lebih banyak
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Wira Noviana Suhery, Auzal Halim, dan Henny Lucida
Kurva Adsorpsi Isoterm
KurvaD
Kurva
50
48
46
44
42
40
38
36
34
32
30
28
26
24
22
20
18
16
14
12
10
8
6
4
2
0
0,9
0,8
Pati 48
48 jam
Jam
Pati
Pati 72
72 jam
Jam
Pati
Pati singkong
Singkong
Pati
Starch
Starch 1500
1500
Jumlah Air yang diserap (ml)
MOCAF
MOCAF
Jumlah air yang diserap (ml)
Jumlah
Uap
(%)
Jumlah
uap
airyang
yang diserap
diserap (%)
Kurva Adsorpsi Isoterm
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
0
10
20
30
40
50
60
70
80
Kelembaban Relatif
Kelembaban
relatif(%)
(%)
10 20 30 40 50
90 100 110
Gambar 4. Kurva adsorpsi isoterm
erm
KurvaDaya
DayaPenyerapan
Penyerapan Air
Kurva
Air
soterm
0,9
Pati 48 jam
Pati 72 jam
Pati singkong
Starch 1500
Jumlah Air yang diserap (ml)
MOCAF
Jumlah air yang diserap (ml)
0,8
0,7
Ibuprofen
0,6
Pati singkong
0,5
Ibuprofen
MOCAF
Pati Singkong
MOCAF
Pati modifikasi 48
jam Modifikasi
Pati
Pati modifikasi 72
48
jam
jam
Pati
Modifikasi
Starch
1500
72 jam
Starch 1500
0,4
0,3
0,2
0,1
0
0
10 20 30 40 50 60 70 80 90 100 110 120 130
Waktu (menit)
100 110
Waktu (menit)
Gambar 5. Daya penyerapan air
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
135
Sifat Fisikokimia Mocaf dan Pati Singkong Termodifikasi untuk Formulasi Tablet
dan jelas dibandingkan dengan MOCAF dan pati
termodifikasi 72 jam. Ini disebabkan karena pati
termodifikasi 48 jam merupakan saat optimum
dari aktivitas mikroba (berada pada awal fase
stasioner). Sementara pada pati termodifikasi 72
jam aktivitas bakteri sudah mulai menurun (fase
kematian). Sedangkan pada MOCAF karena proses fermentasi dilakukan pada singkong bukan
langsung pada pati maka hasil perlubangan pati
akibat aktivitas mikroba pun menjadi berkurang.
Dari beberapa penelitian sebelumnya fermentasi
pati singkong dengan bakteri asam laktat akan
menghasilkan sejumlah lubang dangkal dengan
diameter yang besar (4, 6, 14).
Dari diaftogram spektrum sinar X terlihat
bahwa antara pati singkong, MOCAF, pati termodifikasi 48 jam telah terjadi perubahan pola
kristalografinya. Hal ini juga didukung dari hasil
pemeriksaan analisis panas menggunakan Differential Thermal Analysis (DTA) yang menunjukkan bahwa pada pati singkong memperlihatkan
adanya puncak pada temperatur 153,8C. Puncak
ini diidentifikasikan sebagai temperatur leleh
pati singkong dengan terjadi penurunan temperatur (endoterm). Sementara MOCAF dan pati
termodifikasi 48 jam memperlihatkan terjadinya
penurunan puncak pada temperatur 151,8C dan
146,1C dengan terjadi penurunan temperatur
(endoterm). Hasil ini menunjukkan bahwa adanya perubahan yang terjadi akibat adanya proses
fermentasi pada pati singkong. Sementara Starch
1500 memperlihatkan pola amorf pada diaftogram spektrum sinar X dan menunjukkan adanya
puncak pada temperatur dan 154,2C dengan terjadi penurunan temperatur (endoterm). Hasil ini
disebabkan karena starch 1500 telah mengalami
gelatinisasi sebagian sehingga telah kehilangan
bentuk kristalnya.
Pada hasil foto mikroskop polarisasi menun-
DAFTAR PUSTAKA
1. Loftsson, T., Duchene, D. Cyclodextrins and their
136
pharmaceutical applications. International Jour-
jukkan adanya daerah terang (kristal) pada granula pati. Pada pati singkong termodifikasi 48
dan 72 jam terlihat banyaknya daerah terang
(kristal) yang menunjukkan bahwa dengan adanya fermentasi menggunakan bakteri asam laktat terdapat peningkatan jumlah daerah kristal
dibandingkan dengan pati singkong. Hal ini disebabkan karena adanya peningkatan amilosa dari
pati termodifikasi 48 dan 72 jam. Sementara
pada starch 1500 yang merupakan pati terpregelatinisasi sebagian terlihat sedikitnya granula
pati yang memiliki daerah terang (kristal) yang
disebabkan karena proses gelatinisasi, yang menyebabkan sebagian granula pati pecah sehingga
kehilangan daerah kristal (10, 15).
Hasil pemeriksaan adsorpsi isoterm MOCAF,
pati termodifikasi 48 dan 72 jam, pati singkong
dan starch 1500 menunjukkan adsorpsi isoterm
tipe II. Dimana pada kelembaban relatif antara
0-40% telah terjadi penyerapan monolayer. Pada
kelembaban relatif 40%-60% telah terjadi penyerapan multilayer, dan pada kelembaban relatif 60%-100% terjadi kondensasi kapiler. Artinya
bila semua pati ini akan diformulasi dalam bentuk
tablet maka harus disimpan dibawah kelembaban 60% untuk mencegah terjadinya kondensasi
kapiler yang akan menyebabkan tablet mengembang pada waktu penyimpanan (7).
KESIMPULAN DAN SARAN
MOCAF dan pati singkong termodifikasi de
ngan menggunakan bakteri asam laktat (Lactobacillus sp) sebagai starter fermentasi dapat
menghasilkan pati dengan perubahan bentuk
pada permukaan granulanya, disertai dengan perubahan sifat fisikokimia yang lebih baik dari pati
singkong.
nal of Pharmaceutics 329. 2007: 1-11.
2. Anwar, Effionora. Pemanfaatan maltodekstrin dari pati singkong sebagai bahan penyalut lapis tipis
tablet. Makara Sains. 2002.6.(1).
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Wira Noviana Suhery, Auzal Halim, dan Henny Lucida
3. Numfor, F. A., Walter, W. M., Jr., Schwartz, J. Physi-
cochemical changes in cassava starch and flour
associated with fermentation: Effect on textural
properties. Starch/starke 47. (3,S) 1995: 86-91.
4. Subagio, A. Produk bakery dengan singkong. Food
Review Indonesia. 2008.3 (8).
8. Voight R, Buku Pelajaran Teknologi Farmasi. Diter-
jemahkan oleh Soendani Noerono. Gadjah Mada
University Press. Yogyakarta. 1994.
9. Swarbrick .J. Encyclopedia Of Pharmaceutical Technology. Volume 6. Third Edition. Informa Healthcare USA . New York. 2007.
5. Juheini. Iskandarsyah. Animat, J.A., Jenny. Penga-
10. Winarno, F.G. Kimia Pangan dan Gizi. PT. Gramedia.
teofilin. Majalah Ilmu Kefarmasian. 2004.I (1):
Granule Structure and Hydrolysis. Review. Trends
ruh kandungan pati singkong terpregelatinasi terhadap karakteristik fisik tablet lepas terkontrol
21-26.
6. Chinsamran, K., Piyachomkwan, K., Santisopasri,
V., Sriroth, K. Effect of lactic acid fermentation
on physico-chemical properties of starch derived
from cassava, sweet potato and rice. Kasetsart University.
7. Halim, A. Penelitian Terhadap Daya Penyerapan
Air Beberapa Tepung yang Digunakan dalam Bidang Farmasi. Jurnal Penelitian dan Pengabdian
Masyarakat. No. 6. III. Universitas Andalas. 1991:
578-579.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Jakarta. 1984.
11. Oates, C. G. Towards an Understanding of Starch
in Food Science and Technology. 1997. 8: 375-382
12. Planchot, V., Colonna, P., Gallant, D.J., and Bouchet,
B. Extensive degradation of native starch granules
by -amylase from Aspergillus fumigatus. J. Cereal
Sci. 1995: 21.
13. Troy, B.D. Remington The Science and Practice
of Pharmacy. 21 edition. Lippincott Williams &
Wilkins. United States of America. 2005.
14. Parija, S.C. Tetxbook of Microbiology & Immunology.
Elsevier. India. 2009.
15. Chaplin, M. Starch. http// : www.sbu.ac.uk. 2002.
137
Artikel Penelitian
Penetapan Kadar Alkaloid Ekstrak dari Etanolik Bunga
Kembang Sepatu (Hibiscus rosa- sinensis L.)
Mimiek Murrukmihadi, Subagus Wahyuono,
Marchaban, dan Sudibyo Martono
ABSTRACT: Kembang sepatu flower (Hibiscus rosa-sinensis L.) was fractionally used as expectorant. Based on Bioassay Guided fractionation, an active fraction was separated, and the fraction was identified is Alkaloid was the major
compound based on TLC analysis. Viscosity value measured by viscometer was
used as a Bioassay model of expectorant activity in vitro and acetyl cysteine
was used as positive control. Alkaloid content determination of the ethanolic
extract was measured by TLC-Densitometric compared with standard curve of
isolated alkaloid as the selected marker (Y=12,1360X+2901,4474). The alkaloid content in the ethanolic extract was determined as 2.35 0,67 %.
Keywords: alkaloid, ethanolic extract, Hibiscus rosa-sinensis L.
Fakultas Farmasi Universitas Gadjah
Mada Yogyakarta
ABSTRAK: Bunga kembang sepatu (Hibiscus rosa-sinensis L.) secara tradisional digunakan sebagai peluruh dahak. Berdasarkan atas Bioassay Guided Fractionation, fraksi aktif berhasil dipisahkan dan alkaloid merupakan kandungan utama fraksi. Oleh karena itu alkaloid digunakan sebagai
senyawa penanda (marker) ekstrak etanol Hibiscus rosa-sinensis L. Nilai
viskositas digunakan sebagai model untuk aktivitas peluruh dahak, dengan
asetil sistein sebagai kontrol positif. Selanjutnya penetapan kadar alkaloid
dalam ekstrak etanol dilakukan secara KLT-Densitometri (n=5), kadar alkaloid dibandingkan dengan kurva baku dari alkaloid (marker) hasil isolasi
(Y=12,1360X+2901,4474). Kadar alkaloid dalam ekstrak etanol kembang sepatu (Hibiscus rosa-sinensis L.) sebagai 2,35 0,67 %.
Kata kunci: alkaloid, ekstrak etanolik, kembang sepatu
Korespondensi:
Mimiek Murrukmihadi
Email : mimiekmurrukmihadi@ymail.com
138
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Mimiek Murrukmihadi, Subagus Wahyuono, Marchaban, dan Sudibyo Martono
PENDAHULUAN
Herbal merupakan obat alternatif yang telah
dimanfaatkan oleh nenek moyang. Salah satu
yang digunakan adalah bunga kembang sepatu
(Hibiscus rosa-sinensis L.), sebagai peluruh dahak (1). Untuk mendapatkan efek yang konsisten, ekstrak harus terstandar dan dapat menjadi referensi material bagi peningkatan produk
herbal Indonesia (2).
Murrukmihadi menyatakan bahwa didalam
ekstrak bunga kembang sepatu terdapat alkaloid dapat digunakan sebagai marker untuk standar produk bunga kembang sepatu (3). Senya
wa marker dapat sebagai senyawa aktif, pe
nanda analitik maupun penanda negatif. Bunga
kembang sepatu dilaporkan dapat digunakan
sebagai obat batuk (4), sehingga alkaloid dalam
kembang sepatu dapat digunakan sebagai marker/senyawa penanda.
Penetapan kadar suatu senyawa dapat dilakukan dengan mengukur kerapatan noda dari
senyawa yang bersangkutan dan telah dipisahkan dengan cara kromatografi lapis tipis deng
an menggunakan KLT-Densitometer. Penampakan noda menunjukkan hasil positif alkaloid
dengan munculnya noda berwarna jingga-kecoklatan pada lempeng KLT ketika ditampakkan denagn pereaksi Dragendorff. (5).
METODE PENELITIAN
Bahan
Bunga kembang sepatu dikoleksi dari Taman Graha Sabha Pramana, Universitas Gadjah
Mada, Sleman, Daerah Istimewa Yogyakarta,
dan di-identifikasi di Bagian Biologi Farmasi, Fakultas Farmasi, Universitas Gadjah Mada
pada bulan September sampai dengan Oktober
tahun 2008. Bunga kembang sepatu dicuci dan
dikeringkan dengan oven yang temperaturnya
diatur antara 40-50 0C. Bunga kering diserbuk
dan disimpan di almari es (40C) sampai saat untuk diekstraksi.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Metode
1. Ekstraksi untuk Penetapan Kadar Alkaloid
Ekstraksi isolat untuk penetapan kadar dilakukan berdasarkan penelitian yang sudah dilakukan (6).
2. Penentuan kadar alkaloid
Penentuan kadar alkaloid dilakukan secara
KLT-Densitometri yang meliputi 2 langkah se
bagai berikut:
a. Pembuatan kurva baku alkaloid
Pembuatan kurva baku alkaloid dilakukan
dengan cara 390 mg isolat kering dilarutkan
dalam metanol 1 mL (larutan stok), kemudian dibuat seri konsentrasi 24, 49, 98, 130,
dan 293 g/L, dengan volume penotolan
15 L. Cara pembuatannya yaitu, dari larutan stok diambil 751 L dilarutkan dalam
metanol sampai 1 mL, sehingga didapat
konsentrasi 293 g/L (dalam 15 L berisi
293x15=4395 g). Dari larutan ini diambil
500 L dilarutkan dalam metanol sampai 1
mL, kemudian diambil 667 g/L dilarut
kan dalam metanol sampai 1 mL, sehingga
didapat konsentrasi 130 g/L (dalam 15
L berisi 130x15=1950 g). Kemudian diambil 500 L dilarutkan dalam metanol
sampai 1 mL, didapat konsentrasi 98 g/
L (dalam 15 L berisi 98x15=1470g).
Dari larutan ini diambil 500 L dilarut
kan dalam metanol sampai 1 mL, didapat
konsentrasi 49 g/L (dalam 15 L berisi
49x15=735g). Terakhir diambil 500 L
dari larutan tersebut kemudian diencerkan
dengan metanol sampai 1 mL, sehingga didapat konsentrasi 24 g/L (dalam 15 L
berisi 24x15=360 g).
b. Penentuan alkaloid dalam ekstrak etanolik
Penentuan alkaloid dilakukan dengan cara
menimbang ekstrak etanol 3 g dilarutkan
dalam 1 mL metanol dan ditotolkan pada
pelat KLT sebanyak 5 kali replikasi deng
an volume masing-masing 10 L. Setelah
pengembangan pelat KLT, bercak yang diperoleh diukur dengan KLT-Densitometer
untuk mendapatkan AUC.
139
Kadar Alkaloid Ekstrak dari Etanolik Bunga Kembang Sepatu
Tabel 1. Nilai Kadar Isolat vs AUC hasil densitometri untuk kurva baku ekstrak
No
Kadar baku (g/L)
24
360
98
1470
293
4395
2
4
5
Kadar baku dala 15 L
49
130
12034,4
1950
24416,7
18605,2
57654,4
No
Kadar (mg/10L)
AUC
30
21725,7
3,45
30
12729,6
1,80
2
4
5
30
30
30
SD
Analisis Hasil
Data luas area yang didapatkan dari isolat dibuat persamaan regresi linier sebagai persamaan kurva baku. Persamaan garis kurva baku : Y =
a+bx, dengan Y = AUC, X = kadar isolat (g/15L).
Harga AUC sampel kemudian dimasukkan ke dalam persamaan garis kurva baku, maka didapatkan kadar dari masing-masing sampel (persen
kadar alkaloid dalam ekstrak).
HASIL DAN PEMBAHASAN
Pembuatan kurva baku
Penentuan panjang gelombang dilakukan
pada scanning panjang gelombang 200-700 nm
untuk senyawa alkaloid dan memberikan maks
pada 200 nm. Tabel 1 menunjukkan kadar isolat
versus AUC hasil densitometri untuk kurva baku
ekstrak.
140
9928,6
735
Keterangan : Persamaan garis regresi kurva baku adalah Y =12,1360 X + 2901,4474
r = 0,9939, X = kadar alkaloid (g/ 15L), Y = AUC
Tabel 2. Nilai Kadar alkaloid dalam sampel ekstrak etanolik
AUC
16560,2
15516,2
12156,1
Kadar (%)
2,50
2,31
1,70
2,35
0,67
Kenaikan konsentrasi atau kadar isolat tertentu sebanding dengan kenaikan nilai AUC pada
densitometer. Hal ini sesuai dengan apa yang didapat, semakin tinggi kadar isolat, semakin besar
AUC (Tabel 1). Setelah dilakukan perhitungan secara regresi linier, maka didapat persamaan garis
regresi linier sebagai kurva baku alkaloid yaitu Y
=12,1360 X + 2901,4474 dengan r = 0,9939. Linieritas merupakan salah satu parameter untuk
menilai kesahihan metode analisis dengan melihat nilai hubungan respon dari berbagai konsentrasi zat baku pada suatu kurva baku yang dilihat
sebagai nilai koefisien korelasi (r).
Penetapan kadar alkaloid dalam ekstrak etanol
Sampel ekstrak sebesar 3 g dilarutkan dalam metanol sampai 1 mL, sehingga didapatkan
konsentrasi 3 mg/L. Sebanyak 10 L ditotolkan
(n=5) pada plat silika gel F254 (Merck) tebal 0,25
mm sebanyak lima replikasi. Kemudian plat KLT
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Mimiek Murrukmihadi, Subagus Wahyuono, Marchaban, dan Sudibyo Martono
dikembangkan dengan fase gerak etil asetat:metanol (1:5 v/v).
Karena bercak yang diharapkan tidak terdeteksi dengan UV 254 maupun 366 nm, maka
bercak ditandai pada tepi plat sesuai dengan
KLT isolat yang telah dilakukan sebelumnya dan
dideteksi dengan pereaksi semprot Dragendorff.
Bercak yang telah ditandai atau sesuai Rf dengan
Dragendorff ditentukan AUC (luas dibawah kurva) pada maks 200 nm menggunakan KLT-Densitometer.
Nilai AUC sampel ekstrak etanolik bunga kembang sepatu dengan kadar 30 mg/ 10L. Nilai AUC
replikasi sampel memenuhi rentang nilai AUC pada
isolat yaitu pada 9928,6 hingga 57654,4 (Tabel 2).
Tabel 2 menunjukkan bahwa dalam ekstrak
etanolik bunga kembang sepatu terdapat alkaloid
yang dapat diisolasi dan sebagai senyawa penanda dengan kadar sebesar 2,35 0,67 %.
DAFTAR PUSTAKA
5. Anonim. Memodernkan Obat Tradisional dari Tana-
KESIMPULAN
Bunga kembang sepatu memiliki kandungan
alkaloid yang dapat diisolasi dan dapat dijadikan
sebagai senyawa penanda. Kadar alkaloid dari
ekstrak etanolik bunga kembang sepatu adalah
2,35 0,67 %.
man.http://www.kimia.lipi.net/index.php?pilihan=
1. Anonim. Tanaman Obat Indonesia. Jilid I. Departemen Kesehatan Republik Indonesia. Jakarta. 1985.
2. Eye. Memodernkan Obat Tradisional dari Tanaman.
Republika. 23 November 2007 cit. 2007.
3. Murrukmihadi, M. Aktivitas Mukolitik Ekstrak eta-
nolik dan Fraksi Aktif Bunga Kembang Sepatu (Hibiscus rosa-sinensis L.) pada Mukus Usus Sapi secara
In Vitro. Laporan Penelitian Program Hibah Penelitian Berkualitas Prima Fakultas Farmasi Universitas
Gadjah Mada. Yogyakarta. 2009
4. Dalimartha, S. Atlas Tumbuhan Obat Indonesia.
Ungaran : Trubus Agriwidya. 1999.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
berita&id=58. 1 Juli 2009.
6. Murrukmihadi, M. Isolasi dan Penetapan Kadar
Alkaloid Dalam Ekstrak Etanolik, Fraksi Tidak larut Etil Asetat dan Fraksi Hasil VLC Dalam Bunga
Kembang Sepatu (Hibiscus rosa-sinensis L.). Disam-
paikan pada Kongres Ikatan Apoteker Indonesia di
Manado. 2011.
7. Anonim. Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Departemen Kesehat
an Republik Indonesia Direktorat Jenderal Pengawasan Obat dan Makanan Direktorat Pengawasan Obat
Tradisional. Jakarta. 2000: 3, 9-11.
141
Artikel Penelitian
Analisis Adverse Drug Reactions pada Pasien Asma
di Suatu Rumah Sakit, Surabaya
Amelia Lorensia, Beny Canggih, dan Rizka Indra Wijaya
ABSTRACT: Asthma is a chronic inflammatory disease of the respiratory tract.
Treatment of asthma can lead to ADRs (adverse drug reactions), which can aggravate asthma symptoms. The purpose of this study was to analyze the incidence of
ADRs in patients with asthma. The study design is divided into retrospective studi
es, for hospitalized patients and cross-sectional with purposive sampling to outpatient. Any actual ADRs that occurred was calculated using the Naranjo probability
scale. The number of hospitalized patients were 60 people and outpatients were 22
people. The number of ADRs that occur were 39 cases, consisted of 36 cases of ADRs
in hospitalized patients with asthma and 3 cases of ADRs in outpatient asthma
patients. Drug groups most involved in ADRs was B2-agonist group. Naranjo scale
calculations on ADRs that occurred that the possibility of ADRs. The most common
ADRs are in asthma therapy, so it takes the role of pharmacists in monitoring ADRs
in asthma treatment to prevent and minimize the occurrence of ADRs.
Keywords: asthma, naranjo scale, hospitalized patient, outpatient
Faculty of Pharmacy, University of
Surabaya, Indonesia
ABSTRAK: Asma merupakan penyakit inflamasi kronik pada saluran pernafasan.
Pengobatan asma dapat menyebabkan terjadinya ADRs (adverse drug reactions),
yang dapat memperburuk gejala asma. Tujuan penelitian ini adalah menganalisa
ADRs pada pasien asma. Desain penelitian dibagi menjadi dua, yaitu retrospektif,
untuk data pasien rawat inap serta cross-sectional untuk data pasien rawat
jalan. Setiap ADRs aktual yang terjadi dihitung probabilitasnya dengan naranjo
scale. Jumlah pasien rawat inap sebanyak 60 orang dan rawat jalan sebanyak 22
orang. Jumlah ADR yang terjadi sebanyak 39 kasus, terdiri dari 36 kasus ADRs
pada pasien asma rawat inap dan 3 kasus ADRs pada pasien asma rawat jalan.
Kelompok obat yang paling banyak terlibat dalam ADRs pasien asma adalah
golongan B2-agonis, aminofilin, kortikotseroid, dan antikolonergik. ADRs yang
paling sering terjadi adalah pada terapi asma, oleh karena itu dibutuhkan peran
farmasis dalam memonitor kemungkinan terjadinya ADRs secara rutin terhadap
pengobatan pasien asma dapat digunakan untuk mencegah dan meminimalkan
terjadinya ADRs.
Kata kunci: asma, naranjo scale, pasien asma rawat inap, pasiena asma rawat
jalan
Korespondensi:
Amelia Lorensia
Email : amelia.lorensia@gmail.com
142
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Amelia Lorensia, Beny Canggih, dan Rizka Indra Wijaya
PENDAHULUAN
Latar Belakang
Asma adalah gangguan inflamasi kronik saluran pernafasan, yang menyebabkan episode
berulang dari wheezing, sesak, chest thightness,
dan batuk. WHO menyatakan sebesar 15 juta jiwa
mengalami disability-adjusted life years (DALYs)
per tahunnya disebabkan asma, mewakili 1%
dari total beban penyakit global (1). Pada terapi
asma, pasien dapat mengalami adverse drug reactions (ADRs), karena pasien asma memiliki risiko
lebih besar terhadap perkembangan asma, karena pasien asma dapat mengalami serangan asma
akibat penggunaan obat lain (2), atau mengalami
ADR akibat penggunaan jangka panjang dari pengobatan asma.
Laporan dari Pusat Pharmacovigilance Daerah di Rumah Sakit Universitas Inha, Korea Selatan, selama 4 bulan, menyatakan bahwa dari
228 pasien asma, terdapat 25 kasus ADRs yang
terjadi pada 19 pasien asma. ADRs yang biasanya
terjadi adalah glukokortikosteroid inhalasi yang
dikombinasikan dengan long-acting beta-2 agonist (LABA) (63.2%), theobromine (10.5%), LABA
oral (10.5%), doxofylline (5.3%), acetylcysteine
(5.3%), dan montelukast (5.3%). Keparahan dari
ADRs yang terjadi pada sebagian besar sampel
tergolong ringan (68.5%), dan tidak ada ADRs
parah yang terjadi. Frekuensi ADRs berbeda berdasarkan status kontrol asma pasien (3).
Dalam penanganan terapi pasien asma, farmasis berperan dalam pelaksanaan proses pharmaceutical care untuk meningkatkan terapi obat
yang komplek dan nilai signifikan dari obat yang
berkaitan dengan morbiditas dan mortalitas akibat penggunaan obat (4), karena pharmaceutical
care dapat memberi dampak positif pada outcomes terapi asma (5,6,7,8,9).
Berdasarkan latar belakang di atas, tujuan
penelitian ini adalah menganalisa kejadian adverse drug reactions (ADRs) pada terapi asma di
suatu rumah sakit di Surabaya, pada pengobatan
asma rawat inap dan rawat jalan, dengan menggunakan naranjo scale untuk mengetahui probabiliJurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
tas ADRs yang terjadi disebabkan oleh obat, dan
bukan karena faktor lain. Data ADRs yang didapat
dapat digunakan oleh farmasis dalam pharmaceutical care sebagai data untuk monitoring pengobatan pasien asma sehingga dapat mencegah
dan meminimalkan terjadinya ADRs pada terapi
pasien asma.
TINJAUAN TEORI
Asma
The National Asthma Education and Prevention Program (NAEPP) mendifinisikan asma
sebagai gangguan inflamasi kronik dari saluran
pernafasan dimana banyak sel dan elemen
selular yang berperan. Pada individu dengan
asma, inflamasi menyebabkan episode berulang
dari wheezing, sesak, chest thightness, dan batuk
(1,10).
Eksaserbasi asma merupakan episode dari
peningkatan progresif pada sesak nafas, batuk,
wheezing, chest tightness, atau kombinasi. Terapi utama eksaserbasi meliputi pemberian
berulang bronkodilator inhalasi aksi cepat,
glukokortikosteroid sistemik, dan oksigen (1,
10). Pada asma kronis, pengobatannya dapat
diklasifikasikan sebagai reliever dan controller
(1). Pengobatan untuk asma kronis dibagi dalam
5 stage dengan kombinasi reliever dan controller
sesuai dengan Tabel 1.
Adverse Drug Reactions (ADRs)
WHO mendefinisikan adverse drug reactions
(ADRs) adalah respon terhadap suatu obat yang
berbahaya dan tidak diharapkan serta terjadi
pada dosis lazim yang dipakai oleh manusia
untuk tujuan profilaksis, diagnosis, maupun
terapi (11). ADRs dibagi menjadi 2 yaitu: (1)
Reaksi tipe A (augmented), yaitu reaksi yang
dapat diperkirakan sebelumnya dan bergantung
pada dosis obat; dan (2) Reaksi tipe B (bizzare),
reaksi yang terjadi tidak berhubungan dengan
respon farmakologi, seringkali terjadi karena
faktor imunologi dan farmakogenetik. Reaksi tipe
143
Adverse Drug Reactions pada Pasien Asma
Tabel 1. Terapi pada Asma Kronis (1)
Step 1
Step 2
Step 3
Step 4
Step 5
Asthma education
Environmental control
As needed rapidacting 2-agonist
As needed rapid-acting 2-agonist
Select one
Controller
options
Low-dose inhaled ICS*
Leukotriene
modifer U
Select one
Add one or more
Low-dose ICS plus
long-acting
2-agonist
Add one or both
Medium-or high-dose
ICS plus long-acting
2-agonist
Medium-or
high-dose ICS
Oral glucocortico steroid
(lowest dose)
Anti-IgE
treatment
Leukotriene
modifer
Sustained release
theophyline
Low-dose ICS plus
leukotriene modifer
Low-dose ICS plus
sustained release
theophyline
Tabel 2. Perhitungan Naranjo Scale (15)
No.
Perhitungan
Pertanyaan
Score pada Naranjo
Ya
Tidak
N/A
1. Apakah pasti telah ada laporan mengenai ADRs tersebut sebelumnya?
3. Apakah ADRs membaik saat obat dihentikan / diberi antagonis spesifiknya?
2. Apakah ADRs muncul setelah obat yang dicurigai tersebut diberikan?
4. Apakah ADRs makin parah jika dosis dinaikkan/ membaik jika dosis diturunkan?
5. Apakah ada penyebab ADRs tersebut selain karena obat?
6. Apakah ADRs tersebut muncul saat diberikan placebo?
9. Apakah pasien pernah mengalami ADRs sejenis saat menggunakan obat/ golongan
10. Apakah ADRs tersebut didukung dengan bukti yang meyakinkan?
144
0
0
-1 2 0
1
8. Apakah ADRs muncul lagi saat obat diberikan kembali?
B ini tidak berhubungan dengan dosis obat yang
diberikan, dan meskipun kasus ini jarang terjadi
namun dapat menyebabkan penyakit yang serius
atau bahkan kematian (12). Waktu kejadian, pola
penyakit, dan hasil investigasi, dan rechallenge
dapat membantu kausalitas untuk memprediksi
kejadian ADR pada pasien (13). Pada penelitian ini
tidak dapat diketahui jenis dari ADR yang terjadi,
dikarenakan keterbatasan data yang diperoleh
dari rekam medik.
-1
-1 1 0
7. Apakah kadar obat dalam darah termasuk kadar toksik?
obat tertentu?
-1
Respon obat tergantung dari setiap individu,
yang dapat disebabkan oleh beberapa faktor seperti penyakit, genetik, dan faktor lingkungan
dan variabilitas dalam respon target obat (respon
farmakodinamik) atau respon idiosinkrasi (14).
Naranjo Scale
Salah satu cara untuk menghitung kemungkinan terjadinya ADRs adalah dengan cara naranjo scale. Ada beberapa pertanyaan pada naranjo
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Amelia Lorensia, Beny Canggih, dan Rizka Indra Wijaya
scale yang dapat dilihat pada Tabel 2.
Penafsiran nilai total :
Lebih dari 9 : definite ADR (pasti ADR)
Antara 5-8 : probable ADR (kemungkinan besar ADR)
Antara 1-4 : possible ADR (kemungkinan ADR)
0
: doubtful ADR (bukan ADR)
Keterangan :
N/A
: not available (tidak dapat diterapkan pada situasi tsb/tidak diketahui)
METODE PENELITIAN
Jenis Penelitian
Metode penelitian ini dibagi menjadi dua, yaitu
crossectional non experimental untuk data pasien
rawat jalan dan secara retrospektif untuk data
pasien rawat inap di rumah sakit.
Populasi dan Sampel Penelitian
Populasi penelitian pada asma rawat inap
adalah pasien asma yang pernah menjalani rawat
inap di rumah sakit selama bulan November
2008-November 2010. Dan sampel penelitian
adalah semua populasi. Populasi penelitian pada
pasien asma rawat jalan adalah pasien asma yang
menjalani rawat jalan di Klinik Penyakit Dalam
Adi Husada Undaan Wetan Surabaya. Selama periode November 2010 sampai dengan Januari
2011 (3 bulan). Sampel penelitian adalah pasien
asma yang memenuhi kriteria inklusi, yaitu berusia 18 tahun dan bersedia berpartisipasi dalam
penelitian.
Teknik Pengambilan Sampel Penelitian
Teknik pengambilan sampel pada pasien asma rawat inap adalah semua sampel penelitian
adalah populasi penelitian. Dan teknik pengambilan sampel pada pasien asma rawat jalan adalah
purposive sampling sesuai dengan kriteria inklusi.
Perhitungan perkiraan jumlah sampel peneli-
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
tian pada pasien asma rawat jalan dengan Persamaan 1 (16):
n=
()
(1)
dimana:
n = jumlah sampel minimal yang diperlukan
d = limit dari error atau presisi absolut (25%)
Z1-2 = nilai Z tabel 1,96 (tingkat kepercayaan 95%)
p = proporsi pasien asma (p=0,5)
Jadi besar sampel penelitian dalam penelitian
ini adalah 18 orang pasien asma yang memenuhi
kriteria inklusi dan eksklusi.
Teknik Pengumpulan dan Analisis Data
Teknik pengumpulan data pada data pasien
asma rawat inap dengan menggambil data dari
rekam medis pasien yang telah ada sebelumnya.
Sedangkan pada data pasien asma rawat jalan
dengan melakukan wawancara secara langsung,
disertai dengan pengamatan terhadap pasien.
Untuk melengkapi data yang diperoleh dilakukan juga konsultasi singkat dengan dokter dan
perawat yang menangani serta dari rekam medik
pasien. Data informasi pengobatan pasien yang
telah dikumpulkan kemudian dianalis menggunakan pustaka dan dijabarkan secara deskriptif.
Kemudia setiap ADRs aktual yang terjadi dihitung
probabilitasnya dengan menggunakan naranjo
scale.
HASIL PENELITIAN DAN PEMBAHASAN
Karakteristik Sampel Penelitian
Jumlah sampel dalam penelitian ini adalah 60
orang, terdiri dari 22 orang pasien laki-laki dan
38 orang adalah pasien perempuan. Jumlah sampel penelitian pada asma rawat jalan sebanyak 22
orang, terdiri dari 10 orang laki-laki dan 12 orang
perempuan. Stage asma ditentukan berdasarkan
145
Adverse Drug Reactions pada Pasien Asma
pengobatan rawat jalan yang diterima pasien saat
diwawancara oleh peneliti, berdasarkan Global
Initiative for Asthma tahun 2011. Dari hasil pene
litian terlihat variasi stage asma yang dialami sampel penelitian (tabel 3). Sampel penelitian paling
banyak berada pada stage 1 (68,18%), 13,64%
pada stage 3; 9,09% pada stage 2; 9,09% tidak
diketahui; dan 0% pada stage 4 dan 5. Dua orang
sampel penelitian digolongkan sebagai stage asma
yang tidak diketahui karena pengobatan yang digunakan tidak dapat digolongkan berdasarkan
Global Initiative for Asthma tahun 2011.
Kejadian ADRs pada Pasien Asma dan Outcomes
Klinis yang Terjadi
Jumlah ADR yang terjadi pada pasien asma sebanyak 39 kasus yang terdiri dari 36 kasus ADRs
pada pasien asma rawat inap (asma akut) dan 3
kasus ADRs pada pasien asma rawat jalan (asma
kronis) (tabel 4).
ADR yang terjadi pada pasien asma dapat
disebabkan oleh obat terapi asma dan obat non
terapi asma. Kelompok obat terapi asma yang pa
ling banyak menyebabkan terjadinya ADRs adalah
golongan B2-agonis (10 kasus ADRs yang terdiri
Tabel 3. Data Demografi dan Karakteristik dari Sampel Penelitian Pada Pasien Asma Rawat Inap dan
Asma Rawat Jalan
Variabel
Asma Rawat Inap
(n=60)
Jenis Kelamin
-
Laki-laki
22
- Perempuan
38
Usia (tahun)
-
Usia terkecil
20
-
Usia tertua
82
-
Rata-rata
Lama menderita asma (tahun)
-
< 1
2
- 2 - 5
3
- 6 - 10
6
- 11 - 20
10
-
> 20
4
-
Tidak diketahui
34
Lama dirawat di rumah sakit (hari)
-
< 5
35
- 6 - 10
23
-
> 10
2
Penyakit penyerta yang didapat
- Bronkitis kronis
6 dari 60
- Sinusitis
1 dari 60
- Diabetes melitus tipe 2
9 dari 60
-
CVD (cardiovascular disease)
11 dari 60
- Infeksi saluran pernapasan atas
7 dari 60
- Infeksi lain
10 dari 60
- Gastritis
8 dari 60
- Gangguan fungsi hati
2 dari 60
- Gangguan fungsi saraf
3 dari 60
Stage pengobatan asma kronis
(Global Initiative for Asthma, 2011)
-
Stage 1
-
Stage 2
-
Stage 3
-
Tidak diketahui
146
Asma Rawat Jalan
(n=22)
10
12
19
70
35,10
1
5
1
10
5
15
2
3
2
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Amelia Lorensia, Beny Canggih, dan Rizka Indra Wijaya
Tabel 4. Kejadian ADRs Pada Pasien Asma Rawat Inap dan Asma Rawat Jalan
Jenis DRPs
Asma Rawat Inap
Asma Rawat Jalan
a. Adverse drug event (non allergic) 3
b. Adverse drug event (allergic) 0
c. Toxic adverse drug-event 0
Total
a. Adverse drug event (non allergic) 36
b. Adverse drug event (allergic) 0
c. Toxic adverse drug-event 0
TOTAL
39
Tabel 5. Kelompok Obat yang Terlibat dalam ADRs yang dialami Pasien Asma Rawat Inap dan Rawat Jalan
Golongan
Obat yang terlibat
dalam ADRs
Xanthin
- Aminofilin menyebabkan hipotensi
- Aminofilin menyebabkan hipertensi
- Aminofilin menyebabkan kemerahan kulit
- Aminofilin/Theofilin menyebabkan Takikardi
- Aminofilin menyebabkan mual
1
2
1
4
1
B2 Agonis
- Salbutamol menyebabkan efek hipotensi
- Salbutamol menyebabkan efek takikardi
- Terbutalin menyebabkan hipokalemia
- Fenoterol menyebabkan hipokalemia
2
7
3
1
1
- Ipraptropium menyebabkan hipertensi Alis-
kiren (Rasilez) menyebabkan gatal-gatal di -
seluruh tubuh
- Codein menyebabkan konstipasi
- Epinefrin menyebabkan dada terasa berdebar
1
3
1
Kortikosteroid
B2 Agonis +
Antikolinergik
Antikolinergik
Penghambat
Renin Opioid
Adrenalin
Diuretik
Antibiotik
ADRs pada Asma Rawat Inap
ADRs yang terjadi
- Metilprednisolon menyebabkan hipotensi
- Metilprednisolon menyebabkan hipertensi
- Fluticasone menyebabkan hipertensi
- BUdesonide dan metilprednisolon (duplikasi),
menyebabkan hipertensi
1
2
1
1
- Salbutamol + Iprapropium (Combiven)
1
menyebabkan hipertensi
- Salbutamol + Iprapropium (Combiven)
2
menyebabkan takikardi
- Furosemide menyebabkan hipokalemia
- Furosemide menyebabkan gatal-gatal di selu-
ruh tubuh
- Furosemide menyebabkan hipotensi
1
1
TOTAL
9
- Cefpirome menyebabkan gatal-gatal di seluruh 1
tubuh
- Ceftriaxone menyebabkan sakit kepala
1
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
- Salbutamol menyebabkan mulut kering
- Salbutamol menyebabkan pusing
Losartan menyebabkan kelelahan
2
1
1
ADRs pada Asma Rawat Jalan
ADRS yang terjadi
TOTAL
147
Adverse Drug Reactions pada Pasien Asma
dari 2 kasus pada asma rawat inap dan 2 kasus
pada asma rawat jalan), kemudian kelompok
aminofilin (9 kasus pada asma rawat inap), kortikosteroid (5 kasus pada asma rawat inap), dan
antikolonergik (3 kasus pada asma rawat inap)
(tabel 5).
Kelompok obat non-terapi asma yang menyebabkan terjadinya ADR sebanyak 13 kasus. Kelompok obat yang paling banyak menyebabkan
terjadinya ADR adalah diuretik (4 kasus pada
rawat inap), antibiotik (2 kasus pada asma rawat
inap), dan penghambat renin (1 kasus pada asma
rawat inap dan 1 kasus pada asma rawat jalan)
(tabel 5).
Golongan xanthin menyebabkan efek hipotensi
atau hipertensi, karena meningkatkan tingkat
katekolamin, yang menstimulasir reseptor 2
adrenergik vaskular dengan penurunan resistensi pembuluh darah perifer. Vasodilatasi
perifer dan hipotensi terjadi pada toksisitas
teofilin signifikan. Intraseluler pergeseran hasil
kalium dalam hipokalemia (17). Xanthin menyebabkan kemerahan kulit, akibat sensitif terhadap
ethylenediamine salt dalam aminofilin (18).
Takikardi yang disebabkan oleh xanthin karena
relaksasi otot polos saluran pernafasan dan juga
mencegah sel mast di sekitar bronkus untuk
melepaskan senyawa bronkokonstriksi seperti
histamin dan bradikinin, yang dapat menyebabkan
bronkospasmodik. Kondisi ini dapat menyebabkan
kontraksi pada jantung dan menurunkan tekanan
darah di arteri paru. Manfaat bronkodilator
xanthine dalam pengobatan asma sering dibatasi
oleh efek samping mual muntah. Mekanisme
emesis kemungkinan dengan penghambatan satu
atau lebih bentuk PDE (phosphodiesterase) bukan
dari antagonisme adenosin (19).
Kortikosteroid menyebabkan peningkatan
tekanan darah, dengan menyebabkan retensi
Na+, air dan peningkatan ekskresi K+ yang
dapat mengakibatkan terjadinya hipertensi dan
hipokalemia (19). Hal ini menjadi perhatian
pada pasien asma yang juga mendapat terapi
antihipertensi karena efek hipo-kalemia akan
menjadi semakin parah (20).
148
B2-agonis dapat memperparah hipokalemia
karena memiliki efek hipokalemia. Hipertensi
dilaporkan juga pernah terjadi pada 1% pasien
yang pernah memakai salbutamol pada dosis
normal (20). ADR berupa pusing yang ditimbulkan
oleh Salbutamol kemungkinan diakibatkan
oleh efek relaksasi otot polos dari Salbutamol,
karena stimulasi reseptor 2. Reseptor 2 tidak
hanya terdapat di saluran pernafasan namun
juga terdapat di otot tulang dan pembuluh
darah jantung. Stimulasi yang berlebihan
terhadap reseptor 2 (terutama yang terdapat
pada otot polos pembuluh darah jantung) akan
menyebabkan vasodilatasi pembuluh darah yang
ada di jantung sehingga dapat menyebabkan
tekanan darah turun, salah satu manifestasinya
adalah pusing.
Ipratropium bromida dapat menyebabkan
vasodilatasi sehingga terjadi penurunan tekanan
darah yang cukup tajam dan dihasilkan efek
hipotensi. Sebagai mekanisme kompensasi, tubuh
kita akan meningkatkan denyut jantung sehingga
muncul efek takikardia, selain itu ada pula
pengaruh dari potensiasi reseptor 2 di jantung
oleh pemakaian salbutamol (20). Dari 60 orang
pasien asma, 40% diantaranya menggunakan
kombinasi ipratropium bromida dan salbutamol,
hal inilah yang membuat perlunya pengawasan
yang lebih terhadap pemakaian kombinasi ini.
ADRs yang teramati pada pemakaian ipratropium
bromida dan salbutamol adalah ADRs tipe A, yang
dapat diprediksi.
Hipokalemia dan hipotensi dapat disebabkan
karena furosemide, yang merupakan loop diuretic
yang mensekresi secara aktif melalui sistem
transpor asam organik nonspesifik kedalam
lumen dari ascending limb pada loop henle,
menyebabkan penurunan reabsorbsi natrium
dengan kompetisi pada chloride site pada Na+K+-2Cl cotransporter. Medullary hyper-tonicity
dikurangi, sehingga menurunkan abilitas ginjal
untuk mereabsorbsi air (21,22). Furosemide juga
dapat menyebabkan gatal-gatal yang merupakan
reaksi alergi di kulit (22).
Epinefrin menyebabkan dada terasa berdebar,
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Amelia Lorensia, Beny Canggih, dan Rizka Indra Wijaya
dikarenakan epinefrin menstimulasi reseptor
dari 1, 2-, 1-, dan 2-adrenergik (21). Losartan
merupakan antagonis non peptide, kompetitif
dan selektif dari reseptor Angiotensin II. Mekanisme kerja losartan yaitu berikatan secara
reversible dengan reseptor AT1 dan AT2 dan
dengan memblok efek vasokonstriksi dan sekresi
aldosteron dari Angiotensin II (21). Kelelahan
yang muncul akibat penggunaan Losartan dimungkinkan karena efek inhibisinya terhadap
sekresi aldosteron. Jika sekresi aldosteron menurun terlalu besar, keseimbangan cairan dan elektrolit akan terganggu dan manifestasi yang sering
muncul antara lain kelelahan (23).
Codein untuk terapi batuk pada asma akut dapat menyebabkan konstipasi, karena codein yang
merupakan opioid memberikan efek pada otot
polos yang dapat berkaitan dengan menurunnya
otot polos di usus sehingga menyebabkan konstipasi (24).
sil penelitian, obat-obat yang menimbulkan
ADRs aktual yang dinilai dengan naranjo scale,
semuanya bernilai 4, yang berarti memiliki kemungkinan ADR.
DAFTAR PUSTAKA
5. Abdelhamid E, Awad A, Gismallah A. Evaluation of
Perhitungan Naranjo Scale terhadap Kejadian
Adverse Drug Reactions (ADRs) yang Terjadi
pada Pasien Asma
ADRs pada pasien asma rawat inap dan rawat jalan yang bersifat aktual akan dihitung
menggunakan naranjo scale untuk menilai
39 kasus ADRs yang terjadi. Berdasarkan ha-
1. Global Initiative for Asthma. Global Strategy for
Asthma Management & Prevention [Update]; 2011.
KESIMPULAN DAN SARAN
ADRs yang terjadi pada pasien asma rawat inap
dan rawat jalan dalam penelitian menunjukkan
bahwa kejadian ADR yang terjadi sebagian besar
berasal dari pengobatan asma pasien, walaupun
dengan outcomes klinis ADRs yang cenderung
ringan.
Berdasarkan hasil penelitian, maka perlunya
peran farmasis dalam memonitor kemungkinan
terjadinya ADRs secara rutin terhadap obatobatan yang digunakan pasien asma baik pada
pasien asma rawat jalan maupun selama dirawat
di rumah sakit. Serta peran farmasis dalam
menyediakan informasi bagi tenaga kesehatan
lainnya mengenai penggunaan obat-obatan bagi
pasien.
Penelitan selanjutnya dalam menilai outcomes
DRPs diperlukan waktu pengamatan yang lebih
lama untuk mengetahui apakah outcomes tersebut dalam jangka panjang, serta jumlah sampel
penelitian yang lebih besar.
a Hospital Pharmacy-Based Pharmaceutical Care
Services for Asthma Patients. Pharmacy Practice
2008; 6(1): 25-32.
2. Cukic V, Ustamujic A, Lovre V. Adverse Drug Reac-
6. American Pharmacist Association. Principle of
3. Kim CW, Cho JH, Jung EH, Lee HK. Adverse Drug Re-
7. American Society of Health-System Pharmacists.
tions in Patients with Bronchial Asthma. Mat Soc
Med 2010; 22(2): 99-100.
actions to Anti-Asthmatics In Patients with Bronchial Asthma. a Meeting of The World Allergy Organization: A World Federal of Allergy, Asthma, &
Clinical Immunology Societies; 2011.
4. Berenguer B, La Cassa C, de La Matta MJ, Martin-
Calero MJ. Pharmaceutical Care: Past, Present and
Future. Curr Pharm Des. 2004; 10(31): 3931-46.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Practice for Pharmaceutical Care. AphA Pharmaceutical Care Guidelines Advisory Commitee; 2005.
ASHP Guidelines on a Standardized Method for
Pharmaceutical Care. Am J Health-Syst Pharm
1996; 53, 17136.
8. Cipolle R, Strand L, Morney P. Pharmaceutical Care
Practice. McGrawHill: United States; 1998. p. 76-80.
9. Farris KB, Fernandez-Llimos F, Benrimoj SI. Pharmaceutical care in community pharmacies: Prac-
149
Adverse Drug Reactions pada Pasien Asma
tice and research from around the world, Ann
of methyldopa, Indapamide and Theophylline Re-
Council Australia; 2006.
macoepidemiol Drug Saf. 2009;18(10): 977-9.
Pharmacotherapy 2005; 39:539-41.
10. Asthma Management Handbook. National Asthma
11. Prest MS, Kristianto FC, Tan CK. Reaksi Obat yang
Tidak Dikehendaki, Dalam Aslam M, Tan CK, Pra
yitno A, ed, Farmasi Klinis: Menuju Pengobatan
Rasional dan Penghargaan Pilihan Pasien, PT Elex
Media Komputindo, Jakarta; 2003. p. 101-107.
12. Lee A, Beard K. Adverse Drug Reactions, Churchill
Livingstone, London; 2006.
13. Edwards IR, Aronson JK. Adverse Drug Reactions:
Definitions, Diagnosis, and Management. Lancet
2000; 356(9237):1255-9.
14. Shastry BS. Pharmacogenetics and the concept of
indivi-dualized medicine. The Pharmacogenomics
Journal 2006; 6: 1621.
15. Naranjo CA, Busto U, Sellers EM, Sandor P, et al. A
method for estimating the probability of adverse
drug reactions.Clin Pharmacol Ther 1981; 30:
sis and Hypokalaemia in An Elderly Patient, Phar-
18. Brunton LL, Goodman LS, Blumenthal D, Buxton I,
Goodman and Gilmans manual of pharmacology
and therapeutics, 11th ed. McGraw-Hill Professio
nal; 2006.
19. Ralph E. Howell, William T. Muehsam and William J. Kinnier. Mechanism for the emetic side
effect of xanthine bronchodilators. Life Sciences
1990; 46(8).
20. McEvoy G, Snow E, Miller J, et al. American Society
of Health System Pharmacists. Bethesda; 2008.
21. Anderson P. Handbook Of Clinical Drug Data. Mcgraw-Hill Companies 2002; 10.
22. Lacy C, Armstrong L, Goldman M, Lance L. Drug In-
formation Handbook: A Comprehensive Resource
for all Clinicians and Healthcare Professionals.
Lexi-Comp Inc, United States 2006; 14.
239245.
23. National Endocrine and Metabolic Diseases Infor-
1997. p. 55.
24. Sweetman S. Martindale: The Complete Drug Refe
16. Lemeshow S. Besar Sampel dalam Penelitian Kese
hatan. Yogyakarta. Gajah Mada University Press;
17. Chan TY, Gomersall CD, Cheng CA, Woo J. Overdose
150
sulting in Prolonged Hypotension, Marked Diure-
maton Service: A Service. The Institute of Diabetes
and Digestive and Kidney Diseases. NIH; 2005.
rence. USA. Edition. Pharmaceutical Press 2009; 36.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Artikel Penelitian
Pengaruh Pemberian Ekstrak Etanol Umbi Mahakaan
terhadap Waktu Perdarahan dan Pembekuan serta Jumlah
Trombosit Darah Mencit Putih Betina
Surya Dharma, Dachriyanus, dan Zikra Sartika
ABSRACT: The effect of aethanolic extract of mahakaan,s (Gynura pseudochina (L)
DC tuber on shortening bleeding and coagulation time and trombocytes cell of
the white female mice has been studied. The overal doses used were 30,100 and
300 mg/kg BW. The effect was observed on, 1st, 7th, 14th and 21th days by using
the modified cutting tail method, slide method and using hemositometer. As a
comparator used vitamin K with dose of 0,026 mg/20g BW was given. The result
indicated that the extract has ability to shorten bleeding and coagulation time at
all doses, and the dose of 300 mg/kg BW showed a stronger effect on shortening
bleeding time compared to vitamin K 0,026 mg/20g BW (p<0,01). The doses of
100 and 300 mg/BW showed a stronger effect on shortening coagulation time. The
thrombocytes was not influenced by the all doses, and neither was the lenght of the
administration (p>0,01).
Keywords : Gynura pseudochina (L.) DC), bleeding time, coagulation time, and
level of thrombocyt
Jurusan Farmasi, Fakultas MIPA
Universitas Andalas Padang
ABSTRAK: Telah dilakukan penelitian tentang pengaruh ekstrak etanol umbi
tanaman mahakaan (Gynura pseudochina (L.) DC.) terhadap kemampuannya
mempersingkat waktu perdarahan, pembekuan darah serta mengamati jumlah
sel trombosit darah mencit putih betina. Dosis yang digunakan pada penelitian
ini adalah 30, 100 dan 300 mg/kb BB dan pengaruhnya diamati pada hari ke
1, 7, 14 dan 21. Metoda yang digunakan adalah metoda pemotongan ekor yang
dimodifikasi, metoda slide dengan menggunakan alat hemositometer. Sebagai
pembanding digunakan vitamin K pada dosis 0,026 mg/20g BB. Hasil penelitian
menunjukkan bahwa pemberian ekstrak etanol dari umbi mahakaan mampu
mempersingkat waktu perdarahan dan pembekuan darah secara signifikan apabila dibandingkan dengan vitamin K pada dosis 0,026 mg/20 g BB, dan efeknya
akan lebih baik terlihat pada dosis 300 mg/kg BB (p<0,01). Pada pemberian dosis 100 dan 300 mg/kg BB memberikan hasil yang lebih baik dalam memper
singkat waktu pembekuan darah. Tidak terlihat peningkatan jumlah sel trombosit pada penelitian ini untuk semua dosis yang digunakan (p>0,1).
Kata kunci : Gynura pseudochina (L.) DC), waktu perdarahan, waktu koagulasi,
dan level trombosit
Korespondensi:
Dachriyanus
Email : dachriyanus@hotmail.com
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
151
Pengaruh Ekstrak Etanol Umbi Mahakaan terhadap Waktu Pendarahan
PENDAHULUAN
Pada saat ini kita kembali kepada pengobatan
alternatif yaitu dengan menggunakan tanaman
obat yang sudah banyak diketahui khasiatnya.
Tanaman ini biasanya digunakan untuk pencegahan dan pengobatan penyakit (1). Kecenderung
an minat penggunaan obat tradisional kini makin
meningkat, karena bentuk sediaan yang didukung oleh kemajuan teknologi saat ini, disamping
itu harganya dapat dijangkau dan keamanannya
juga dapat terjamin (2). Gynura sp termasuk ke
dalam golongan famili Asteraceae, sering digunakan oleh masyarakat untuk pengobatan alternatif. Tanaman ini banyak tumbuh di pekarangan
rumah dan juga tumbuh di beberapa kawasan hutan di Indonesia. Kandungan kimia dari tanaman
ini adalah benzoquinon (Quinoid), carryophyllen
oksida (seskuiterpen), diosgenin (sapogenin),
stigmasterol (steroid), adenin (alkaloid), quercetin (flavonoid) (3).
Salah satu spesies tanaman yang banyak digunakan untuk obat adalah Gynura pseudochina
(L.) DC), yang dikenal dengan nama daerah mahakaan
Umbi dari tanaman ini digunakan untuk
menghentikan perdarahan (luka teriris, batuk darah, muntah darah, mimisan, perdarahan sehabis
melahirkan, luka bakar), demam, membersihkan
racun, tulang patah (fraktur) (4).
Sebagai obat luka umbi mahakaan (Gynura
pseudochina (L.) DC), masih banyak digunakan,
disamping itu belum ada suatu penelitian yang
melaporkan bahwa tanaman ini berkhasiat untuk
menghentikan perdarahan, pembekuan darah
dan meningkatkan jumlah trombosit.
Ekstrak etanol dari umbi tanaman ini di uji
terhadap proses hemostasis dan pembekuan darah, vitamin K digunakan sebagai pembanding
pada penelitian ini. Vitamin K memiliki peranan
dalam proses hemostasis dan pembekuan darah
terhadap faktor II (protrombin), faktor VII (prokonvertin), faktor IX (Christmas) dan faktor X
(Stuart-Prower), bekerja sebagai koenzim pada
gama karboksilasi rantai samping asam glutamat.
152
Hasil karboksilasi akan mempermudah pengikatan ion kalsium yang diperlukan untuk membentuk kompleks dengan fosfolipid (5).
Waktu perdarahan menggunakan metoda pemotongan ekor yang dimodifikasi (6), waktu pembekuan darah menggunakan metoda Slide Hepler (1962), dan penghitungan jumlah trambosit
menggunakan alat hemositometer (7).
METODOLOGI PENELITIAN
Alat, bahan dan hewan
Alat yang digunakan pada penelitian ini ada
lah : perkolator, alat destilasi, rotary evaporator,
lumpang dan alu, tabung reaksi, plat tetes, pipet
tetes, krus, oven kaca arloji, timbangan analitik,
gelas ukur, jarum oral, timbangan hewan, gun
ting, kertas saring, stopwatch, gelas objek, cover
glass, hemositometer dan mikroskop. Bahan yang
digunakan adalah ekstrak etanol umbi mahakaan,
hewan percobaan mencit putih betina galur DDY
Japan berumur 8-12 minggu dengan bobot badan
20-30 gram.
Sebelum digunakan hewan di aklimatisasi selama seminggu dan mencit putih yang digunakan
adalah mencit sehat, tidak mengalami perubahan berat badan yang berarti (deviasi maksimal
10%) dan secara visual menunjukkan perilaku
yang normal (8). Bahan kimia lain yang digunakan adalah etanol 96%, air suling, kloroform,
kloform ammonia, asam sulfat pekat, asam sulfat
2 N, reagen Meyer, larutan besi (III) klorida pekat,
serbuk Mg, Na CMC, larutan asam oksalat 1% dan
vitamin K (Kimia Farma).
Metoda Penelitian
Bahan uji ekstrak etanol umbi mahakaan
(Gynura pseudochina (L.) DC), larutan Na CMC 1%,
sebagai kontrol dan vitamin K diberikan secara
peroral kepada hewan percobaan dengan volume
pemberian obat 1% dari berat badan selama 21
hari. Pengamatan dilakukan pada hari ke 1, 7, 14,
dan 21, dan 60 menit setelah pemberian sediaan
dilakukan penentuan waktu perdarahan, pembekuan dan perhitungan jumlah sel trombosit.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Surya Dharma, Dachriyanus, dan Zikra Sartika
Tabel 1. Persentase Efektivitas Waktu Perdarahan Ekstrak Etanol Umbi Mahakaan Gynura
pseudochina (L.) DC.) dan Vitamin K terhadap Kontrol.
% Efektivitas waktu perdarahan setelah pemberian ekstrak
terhadap kontol pada pengamatan hari ke-
Perlakuan
Zat Uji dan Dosis
1 7 14 21
Ekstrak etanol 30 mg/kg BB
10,75 50,86 54,78 57,76
Ekstrak etanol 100 mg/kg BB
38,58 65,65 73,94 77,69
Ekstrak etanol 300 mg/kg BB
52,44 74,21 81,88 85,00
Vitamin K dosis 0,026 mg/kg BB
0,57 60,66 75,55 78,52
Waktu Perdarahan (%)
1. dosis 30 mg/kg BB
2. dosis 100 mg/kg BB
3. dosis 300 mg/kg BB
4. dosis 0,026 mg/kg BB
1 2 3 4
1 2 3 4
1 2 3 4
1 2 3 4
Waktu Pengamatan (hari)
Gambar 1. Diagram batang dalam bentuk persentase efek waktu pedarahan setelah pemberian ekstrak
etanol umbi mahakaan (Gynura pseudochina (L.) DC.) dengan 3 variasi dosis yang di bandingkan
dengan pemberian vitamin K dosis 0,026 mg/ 20 gr BB
Penentuan waktu pendarahan
Penentuan waktu perdarahan dilakukan dengan menggunakan metoda pemotongan ekor
yang di-modifikasi (6). Caranya adalah ujung
ekor mencit yang telah dibersihkan dengan
etanol 96%, dipotong sepanjang 5 mm dengan
gunting yang telah dibersihkan. Pengamatan
waktu perdarahan dilakukan mulai dari awal
pemotongan ekor sampai dengan terbentuknya
bekuan darah pada ujung ekor mencit tersebut.
Penentuan waktu pembekuan
Penentuan waktu pembekuan darah dilakukan dengan metoda Slide (9). Caranya, diteteskan 3 tetes darah diatas objek glass yang kering
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
dan bersih, saat awal penetesan stopwatch dijalankan. Tiap-tiap detik gerakan ujung jarum
melalui tetes pertama sampai terlihat adanya
benang fibrin. Segera setelah terlihat benang
fibrin pada tetes pertama, gerakan ujung jarum
pada tetes ke dua dan seterusnya sampai dilanjutkan pada tetes ketiga. Waktu terbentuknya
benang fibrin pada tetes kedua dan ketiga diratakan dan dicatat sebagai waktu pembekuan
darah.
Perhitungan jumlah trombosit
Penghitungan jumlah sel trombosit dilakukan menggunakan hemositometer (7), dilakukan
dengan cara sebagai berikut :
153
Pengaruh Ekstrak Etanol Umbi Mahakaan terhadap Waktu Pendarahan
Tabel 2. Persentase efektivitas waktu perdarahan ekstrak etanol umbi mahakaan (Gynura
pseudochina (L.) DC.) dan vitamin K terhadap kontrol
% Efektivitas waktu pembekuan darah setelah pemberian
ekstrak terhadap kontol pada hari ke-
Perlakuan
Zat Uji dan Dosis
1 7 14 21
Ekstrak etanol 30 mg/kg BB
11,73 58,57 66,93 69,50
Ekstrak etanol 100 mg/kg BB
45,04 77,92 84,76 88,82
Ekstrak etanol 300 mg/kg BB
65,32 83,18 86,68 89,13
Vitamin K dosis 0,026 mg/kg BB
4,22 75,33 78,04 85,47
Waktu pembekuan darah (%)
1. dosis 30 mg/kg BB
2. dosis 100 mg/kg BB
3. dosis 300 mg/kg BB
4. dosis 0,026 mg/kg BB
1 2 3 4
1 2 3 4
1 2 3 4
1 2 3 4
Waktu Pengamatan (hari)
Gambar 2 . Diagram batang efek dalam bentuk persentase terhadap waktu pembekuan darah setelah
pemberian ekstrak etanol umbi mahakaan (Gynura pseudochina (L.) DC.) dengan 3 variasi
dosis yang di bandingkan dengan pemberian vitamin K dosis 0,026 mg/ 20 gr BB.
A. Mengisi Pipet Eritrosit
Dipipet eritrosit terlebih dahulu dibilas de
ngan larutan amonium oksalat 1% sampai
garis tanda 1, kemudian bilasan di buang.
Dibersihkan darah pada bagian ekor yang
akan dipotong dengan tissue, dibiarkan darah
keluar kemudian dihisap sampai garis tanda
0,5. Kelebihan darah yang melekat pada ujung
pipet dihapus dengan tissue.
Dimasukkan ujung pipet ke dalam larutan
amonium oksalat 1 % sambil menahan darah
pada garis tanda tadi. Dihisap larutan amo-
154
nium oksalat tersebut perlahan-lahan sampai
tanda garis 101
Pipet diangkat dari larutan, ditutup ujung pipet dengan ujung jari dan karet pengisap di
lepaskan. Dikocok pipet tersebut sampai 1530 detik.
B. Mengisi Kamar Hitung
Kamar hitung dengan penutupnya yang bersih, diletakan mendatar di atas meja.
Pipet yang telah diisi tadi dikocok selama 3
menit secara terus menerus.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Surya Dharma, Dachriyanus, dan Zikra Sartika
Tabel 3. Persentase kenaikan jumlah sel trombosit ekstrak etanol umbi mahakaan (Gynura
pseudochina (L.) DC.) dan vitamin K terhadap kontrol
% Efektivitas waktu pembekuan darah setelah pemberian
ekstrak terhadap kontol pada pengamatan hari ke-
Perlakuan
Zat Uji dan Dosis
1 7 14 21
Ekstrak etanol dosis 30 mg/kg BB
- 0,36 - 0,36
Ekstrak etanol dosis 100 mg/kg BB
0,35 0,59 0,59 0,71
Ekstrak etanol dosis 300 mg/kg BB
1,53 1,42 1,42 2,01
Vitamin K dosis 0,026 mg/kg BB
0,12
0,24 0 0,12
Kenaikan jumlah trombosit darah (%)
1. dosis 30 mg/kg BB
2. dosis 100 mg/kg BB
3. dosis 300 mg/kg BB
4. dosis 0,026 mg/kg BB
1 2 3 4
1 2 3 4
1 2 3 4
1 2 3 4
Waktu Pengamatan (hari)
Gambar 3 . Diagram batang efek dalam bentuk persentase dari jumlah sel trombosit darah setelah
pemberian ekstrak etanol umbi mahakaan (Gynura pseudochina (L.) DC.) dengan 3 variasi
dosis yang di bandingkan dengan pemberian vitamin K pada dosis 0,026 mg/ 20 gr BB.
Tiga sampai empat tetes pertama cairan yang
terdapat dalam pipet dibuang dan segera sentuhkan ujung pipet pada permukaan kamar
hitung dengan menyinggung pinggir kaca
penutup. Dibiarkan kamar hitung terisi cairan
secara perlahan sampai penuh.
Kamar hitung yang telah terisi cairan, diinkubasi selama 10-15 menit dalam cawan petri yang diberi kapas basah kemudian ditutup.
Kamar hitung diletakan pada mikroskop, perbesaran yang digunakan adalah 10 x untuk me
lihat kamar hitung, dan 40 x untuk menghitung
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
jumlah trombosit. Kamar hitung yang diguna
kan untuk menghitung sel trombosit adalah kamar hitung yang di tengah (25 bidang). Hitung
semua sel trombosit pada 25 bidang tersebut.
Hasil yang diperoleh dikalikan 2000, maka
didapat sel trombosit per (l) darah Jumlah
trombosit = n/v x F, dimana n = jumlah trombosit yang dihitung, v = volume yang dihitung
(l) dan F = faktor pengenceran. Bila jumlah
trombosit yang dihitung 25 bidang besar sama
dengan N, maka : Jumlah trombosit N/0,1 x
200 =2000 x N/l darah.
155
Pengaruh Ekstrak Etanol Umbi Mahakaan terhadap Waktu Pendarahan
HASIL DAN PEMBAHASAN
Dari penelitian yang telah dilakukan dapat
diketahui bahwa ekstrak etanol umbi mahakaan
(Gynura pseudochina (L.) DC), dosis 30, 100 dan
300 mg/kg BB dapat mempersingkat waktu
perdarahan dan pembekuan darah mencit sebagai hewan uji. Efek ini sudah teramati pada
hari pertama setelah pemberian sediaan. Hal ini
merupakan suatu kemajuan untuk memperoleh
efek obat yang dapat mempersingkat waktu
perdarahan dan pembekuan darah.
Pada Tabel 1, dapat dilihat efek dalam bentuk
persentase setelah pemberian ekstrak etanol
umbi mahakaan dosis 30 mg/kg BB. Hasil diperoleh secara berturut-turut pada pengamatan
hari ke- 1, 7, 14 dan 21 adalah: 10,74; 50,85;
54,77 dan 57,75%. Pengamatan pada dosis 100
mg/kg BB, hasil yang diperoleh adalah: 38,57;
65,64, 73,93 dan 77,68 %. Pada dosis 300 mg/
kg BB adalah: 52,44; 74,20; 81,88 dan 85,00
%. Berdasarkan efek dalam bentuk persentase
tersebut dapat diketahui bahwa setiap peningkatan dosis dan lamanya waktu pengamatan
menyebabkan peningkatan efektivitas. Peningkatan efektivitas maksimum terlihat pada dosis
300 mg/kg BB pada hari ke 21 pengamatan.
Pada Tabel 2, persentase efek waktu pembekuan darah pada pemberian dosis 30 mg/kg
BB, ditemukan persentase efek secara berturut-turut pada hari ke- 1, 7, 14, dan 21 adalah
11,72; 58,56; 66,93; dan 69,50%. Pada pemberian dosis 100 mg/kg BB 45,03; 77,92; 84,76;
dan 88,82 %. Pemberian dosis 300 mg/kg BB
secara berurutan adalah : 65,32; 83,17; 86,67
dan 89,13%. Berdasarkan persentase efek dapat
diketahui bahwa setiap peningkatan dosis dan
lamanya waktu pengamatan menyebabkan terjadinya peningkatan efek waktu pembekuan darah. Dosis yang memberikan efektivitas maksimum adalah 300 mg/kg BB pada hari ke-21 pe
ngamatan.
Pada Gambar 1 terlihat pada diagram persentase efek waktu perdarahan, dan pada Gambar
2 adalah diagram persentase waktu pembekuan
156
darah. Pengamatan hari ke-1 dan 7 terlihat
diagram meningkat tajam dan dengan analisa
Duncan diketahui waktu perdarahan dan pembekuan darah antara pengamatan hari ke-1 dan
ke-7 memberikan perbedaan yang signifikan.
Pada pengamatan hari ke 7 dan 21 grafik terlihat landai, dan dari analisa uji statistik Duncan
diketahui waktu perdarahan dan waktu pembekuan darah antara hari ke-7, 14 dan 21 tidak
signifikan.
Untuk sementara waktu pengamatan pada
hari ke-1 dan 7, dapat diartikan bahwa pemberian ekstrak etanol umbi mahakaan mampu mempersingkat waktu perdarahan dan pembekuan
darah, sedangkan pada hari ke-14 dan 21, efek
semakin kecil terlihat pada diagram menunjukkan hampir datar.
Pada Tabel 3 merupakan tabel persentase kenaikan jumlah trombosit, terlihat trombosit tidak selalu naik seperti halnya pada waktu perdarahan dan pembekuan darah. Pada hari ke-7
ekstrak etanol umbi mahakaan dosis 300 mg/
kg BB memperlihatkan penurunan jumlah sel
trombosit, dan pada dosis 30 dan 100 mg/kgBB
serta vitamin K dosis 0,026 mg/20g BB terjadi
peningkatan persentase jumlah sel trombosit.
Pada pengamatan hari ke-14, terjadi penurunan
jumlah sel trombosit pada ketiga variasi dosis
sedian uji dan vitamin K. Pada pengamatan hari
ke-21 semua ekstrak memberikan peningkatan
persentase kenaikan jumlah sel trombosit. Namun bila dilakukan uji jarak berganda Duncan
terhadap faktor waktu dapat dilihat bahwa jumlah sel trombosit pada setiap waktu pengamatan
tidak berbeda nyata sehingga tidak mempengaruhi pada peningkatan waktu perdarahan dan
waktu pembekuan darah pada penelitian ini. Penyebab dari turun naiknya jumlah sel trombosit
ini mungkin disebabkan oleh umur trombosit
yang singkat yang berkisar antara 1 2 minggu
dimana setelah itu trombosit telah diurai dalam
sistem retikulum endoplasma (10).
Dari persentase kenaikan jumlah sel trombosit dapat dilihat bahwa peningkatan jumlah
sel trombosit pada setiap waktu pengamatan
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Surya Dharma, Dachriyanus, dan Zikra Sartika
dari masing-masing dosis, sangat kecil dimana
peningkatan yang paling tinggi hanya 2,009%
yaitu ekstrak etanol dosis 300 mg/kgBB pada
hari ke-21 pengamatan (tabel 3). Hal ini dapat
dipahami karena dalam tubuh produksi sel
trombosit di sum-sum tulang diatur oleh jumlah sel trombosit yang beredar dalam darah melalui suatu mekanisme umpan balik (5). Artinya
jumlah sel trombosit akan tetap konstan dalam
keadaan normal. Bila terjadi luka sel trombosit
yang beredar akan berkurang sehingga merangsang produksi faktor trombopoetik yaitu hormon trombopoetin yang akan mengatur pembentukan trombosit di sum-sum tulang (5).
Dari uraian di atas dapat disimpulkan bahwa
pemberian ekstrak etanol umbi mahakaan dapat
mempersingkat waktu perdarahan dan waktu
pembekuan darah. Tetapi terhadap sel trombo
sit ekstrak etanol umbi mahakaan hanya sedikit
meningkatkan jumlah sel trombosit bila diban-
dingkan dengan kontrol, dan apabila dihitung
secara statistik tidak menunjukkan efek yang
signifikan (p>0,01).
DAFTAR PUSTAKA
9. Hepler OE. Manual of Clinical Laboratory Methods,
1. Winarto WP, Tim Karyasari, Daun dewa: Budidaya
KESIMPULAN
Dari hasil penelitian yang telah dilakukan,
diperoleh kesimpulan bahwa:
1. Pemberian ekstrak etanol umbi mahakaan
(Gynura pseudochina (L.) DC) dengan tiga
variasi dosis (30, 100, dan 300) mg/kgBB
dapat mempersingkat waktu perdarahan
dan pembekuan darah mencit putih betina
dengan signifikan. (p<0,01)
2. Pemberian ekstrak etanol umbi mahakaan
(Gynura pseudochina (L.) DC) pada semua
dosis tidak memperlihatkan efek peningkatan
trombosit yang signifikan (p>0,01)
Fourth Edition. USA; Charles C Thomass Publisher;
1962.
dan Pemanfaatan Untuk Obat. Jakarta: Penebar
10. Mutchler E. Dinamika Obat, Buku Ajar Farmakologi
nurunkan Kolesterol. Jakarta: Penebar Swadaya;
11. Anonimous. Alternative Medicine Review 2009;14
Swadaya; 2004.
2. Dalimartha S. 36 Resep Tumbuhan Obat Untuk Me2000.
3. Agestia, Resi Waji. Flavonoid (Quersetin). Universitas Hasanudin; 2009.
4. Dalimartha S. Atlas Tumbuhan Obat Indonesia. Jakarta: Trubus Agriwida; 2001.
5. Kresno SB. Pengantar Hematologi dan Imunohematologi. Jakarta: Gaya baru, 1988.
dan Toksikologi, diterjemahkan oleh M.B Mathilda
dan A.S. Ranti. Bandung: Penerbit ITB; 1991.
(2): 177-179.
12. Anonimous. Betulkah Jus Jambu Biji Mengatasi Demam berdarah?. Kompas 2004; 6 Agustus 2005.
13. Baldy MC. Pembekuan, dalam A.S. Price, L.M.C, Wil-
son (Eds), Patofisiology Konsep Klinis Proses-Proses
Penyakit, diterjemahkan oleh P. Anugerah. Jakarta:
Penerbit EGC; 1994.
6. Dey PM, and JB Harborne. Methods in Plant Bio-
14. Guyton C, Arthur. Fisiology Manusia dan Mekanisme
7. Soebrata G. Penentuan Laboratorium Klinis. Jakarta:
15. Prihantin
chemistry Assay fo Bioactivity. New York: Academic Press 1991;4.
Dian Rakyat; 2001.
8. Farmakope Indonesia, Edisi IV, Jakarta; Departemen
Kesehatan Republik Indonesia 1995.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Penyakit, Edisi 3, diterjemahkan oleh P. Adrianto.
Jakarta: Penerbit EGC; 1990.
AMH. Pengaruh Perasan Daun Dewa
(Gynura pseudochina (L.) Merr), terhadap Bleeding time dan Clotting Time pada Tikus Putih Wistar
Jantan. Universitas Jember; 2008.
157
Pengaruh Ekstrak Etanol Umbi Mahakaan terhadap Waktu Pendarahan
16. Rosmiati H, VHS Gan. Antikoagulan, Anti Trombo
sit, Trombolitik dan Hemostatik: dalam, Tanu, I., et
al, (Ed.), Farmakologi dan Terapi, Edisi IV. Jakarta:
Universitas Indonesia; 1995.
17.
Satriawan AH. Pengaruh Eksrak Daun Dewa
teran Universitas Indonesia ; 1996.
19. Tsucida, Straeten N., et al. Henhanced Blood Coagu-
lation and Fibrinolysis in Mice Lacking HistidinRich Glycoprotein (HRG). Journal of Thrombosis
and Haemostasis; 2005.
(Gynura pseudochina (L.) DC) Terhadap Kematian
20. Winarto WP. Tanaman Obat Untuk mencegah
18. Tjokronegoro A, Pemeriksaan Laboratorium Hema-
thods for Medicinal Plant Materials, Geneva:
Cacing Ascaris solium Secara Invitro, Universitas
Islam Sultan Agung; 2009.
tologi Sederhana, Edisi II. Jakarta: Fakultas Kedok-
158
SARS. Jakarta: Penebar Swadaya; 2003
21. Worl Health Organization. Quality Control MeWHO; 2011.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Artikel Penelitian
Penentuan Kadar Rubraxanton pada Ekstrak
Kulit Batang Garcinia spp
Meri Susanti, Dachriyanus, Deddy Prima Putra, dan Fatma Sriwahyuni
ABSTRACT: In this study a High Performance Liquid Chromatography (HPLC)
has been used for determination of rubraxanton on bark extracts Garcinia spp
(Garcinia mangostana, Garcinia Cowa, Garcinia griffitii, Garcinia dioica and
Garcinia forbesii). HPLC system consisted of C-18 reversed phase column with
a length of 250 mm, diameter 4.6 mm, 20 mL injection volume, mobile phase
methanol: water (gradient system with polarity) and flow rate of 1 ml / min.
Rubraxanton levels obtained in this study; 9.161% for G. mangostana, 6.942%
for G. cowa,. 6.762% for G. dioica, 0.499% for G. forbesii and 0.229% for G.
griffitii. The method has been validated for specificity, linearity, accuracy, precision, limits of detection (LOD) and limits of quantitation (LOQ). The linearity of the method can be seen from the regression coefficient r = 0.9996 with a
linearity range from 1.72 to 55 ug/ml. Recovery of rubraxanton in the extract
of G.mangostana was between 99.61 to 101.08%. Intra-and inter-day precision
showed relatively small level of standard deviation (lower than 2%). Limit Of
Detection (LOD) and Limit Of Quantitation (LOQ) are 0.55 ug / ml and 1.82 ug
/ ml respectively.
Keywords : rubraxanton, bark extracts, Garcinia spp.
Laboratorium Kimia Bahan Alam,
Fakultas Farmasi, Universitas Andalas,
Padang
ABSTRAK: Dalam penelitian ini telah digunakan metoda Kromatografi Cair
Kinerja Tinggi (KCKT) untuk penentuan kadar rubraxanton pada ekstrak kulit batang Garcinia spp (Garcinia mangostana, Garcinia cowa, Garcinia griffitii,
Garcinia dioica dan Garcinia forbesii). Sistem KCKT terdiri dari kolom fase
terbalik C-18 dengan panjang kolom 250mm, diameter 4,6mm, volume
injeksi 20l, fase gerak metanol : air dengan sistem gradient polarity dan laju
alir 1ml/menit. Kadar rubraxanton yang diperoleh pada penelitian ini adalah
9,161% untuk G. mangostana, 6,942% untuk G. cowa, 6,762% untuk G. dioica,
0,499% untuk G. forbesii dan 0,229% untuk G. griffitii. Metoda ini telah tervalidasi untuk spesifisitas, linieritas, akurasi, presisi, limits of detection (LOD)
dan limits of quantitation (LOQ). Linieritas dari metoda dapat dilihat dari
harga koefisien regresi r = 0,9996 dengan rentang linieritas 1,72 55 g/ml.
Recovery rubraxanton dalam ekstrak G.mangostana adalah 99,61 101,08%.
Presisi intra dan inter-day memperlihatkan harga standar deviasi relatif yang
lebih kecil dari 2%. Limit Of Detection (LOD) dan Limit Of Quantitation (LOQ)
berturut-turut adalah 0,55 g/ml dan 1,82 g/ml.
Kata kunci : rubraxanton, ekstrak kulit batang, garcinia spp.
Korespondensi:
Meri Susanti
Email : meri_susanti008@yahoo.com
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
159
Penentuan Kadar Rubraxanton pada Ekstrak Kulit Batang Garcinia spp.
PENDAHULUAN
Garcinia adalah salah satu tumbuhan obat
yang termasuk ke dalam famili Guttiferae. Kelompok tumbuhan ini telah banyak digunakan
dan diperdagangkan oleh masyarakat Asia seba
gai obat tradisional untuk bermacam-macam
penyakit seperti diare, infeksi kulit, luka dan sebagai antiseptik (1). Penelitian terhadap genus
ini telah berhasil mengisolasi beberapa senyawa
kimia yang terbukti memiliki aktifitas farmako
logi. Salah satunya adalah senyawa rubraxanton.
Rubraxanton (1,3,6 trihydroksi 8 geranyl 7 methoxy xanton) telah berhasil diisolasi dari beberapa spesies Garcinia diantaranya
G. Dioica, (2) G. parvifolia (3) G. cowa (4, 5) G.
mangostana (6) dan G. griffithii. Aktivitas farmakologi yang menarik dari senyawa ini terkait
dengan daya an-ti bakterinya, dimana rubraxanton telah terbukti mampu menghambat dengan
baik pertumbuhan Staphylococcus aureus (2),
Trichophyton mentagrophytes, dan Microsporum
gypseum (3), Staphylococcus epidermidis, Micrococcus luteus, Pseudomonas aeruginosa, Escherichia coli (7), dan Helicobacter pylori (6). Selain
itu rubraxanton juga telah dilaporkan sebagai
antitumor dan aktif sebagai antioksidant dan
antikolesterolemia (7).
Berdasarkan survey yang dilakukan terhadap
genus Garcinia di daerah Sumatera Barat diketahui bahwa terdapat sekurangnya sembilan
spesies Garcinia yang tersebar di beberapa tempat yang telah dimanfaatkan masyarakat secara
tradisional (personal information). Penelitian ini
dimaksudkan untuk menganalisis kadar rubra
xanton yang potensial dalam terapi beberapa
penyakit di dalam ekstrak kulit batang Garcinia
spp yang ditemui di daerah Sumatra Barat. Sehingga dengan hasil penelitian ini dapat diketahui spesies mana yang mengandung rubraxanthon terbanyak untuk dijadikan sumber bahan
baku untuk kepentingan pengobatan nantinya.
Penetapan kadar rubraxanton dilakukan de
ngan metoda Kromatografi Cair Kinerja Tinggi.
Untuk hasil yang baik terhadap metoda yang
160
digunakan terlebih dahulu dilakukan validasi
metoda. Sehingga penelitian ini dibagi atas
validasi metoda penetapan kadar rubraxanton secara KCKT meliputi penentuan linieritas,
akurasi, presisi intra dan inter day serta limits of
detection dan limits of quantitation dan penetapan kadar rubraxanton dalam ekstrak beberapa
spesies Garcinia secara KCKT.
METODE PENELITIAN
Alat
Timbangan analitik Libror AEG 80 SM Shimadzu, seperangkat alat destilasi, rotary evaporator, KCKT merk Shimadzu, detektor UV-Vis
SPD 10AVP, pompa ganda/gradient, rekorder
Shimadzu CLASS - VP V6.14 SP2, kolom Shim
pack VP-ODS 250 x 4,6mm, timbangan analitik
Libror AEG 80 SM Shimadzu, oven Memmert,
desikator, labu ukur berbagai ukuran, gelas ukur,
pipet takar, cawan, krus, pipet tetes, kulkas, penyaring milipore, penyaring vakum, vial-vial kecil, botol kaca, corong, dan gelas ukur.
Bahan
Bahan-bahan yang diperlukan dalam penelitian ini adalah kulit batang tumbuhan G. mangostana, G. dioica, G. cowa, G. forbesii, dan G.
griffitii yang diambil di Sarasah Bonta Kotamadya Payakumbuh Sumatera Barat, pelarut metanol, aquabidest (Otsuka), metanol p.a (Merck),
rubraxanton, mangostin
Prosedur Kerja
1. Pembuatan Ekstrak Kulit batang tumbuhan Garcinia spp dikering anginkan ditempat teduh. Kemudian dirajang dan dijadikan
serbuk, sehingga diperoleh serbuk kering.
Serbuk kering kulit batang seberat 250g dimaserasi dengan metanol ditempat yang
terlindung dari cahaya langsung selama 5
hari. Setelah 5 hari hasil maserasi disaring
dan ampas dilakukan lagi maserasi dengan
pelarut yang sama selama 3 hari. Pengerjaan
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Meri Susanti, Dachriyanus, Deddy Prima Putra, dan Fatma Sriwahyuni
ini dilakukan sebanyak 2 kali pengulangan.
Maserat digabungkan dan dipekatkan dengan
rotary evaporator sehingga diperoleh ekstrak
kental.
2. Penetapan Rubraxanton dalam Ekstrak Beberapa Spesies Garcinia spp secara HPLC
Pembuatan Larutan Uji Ekstrak Garcinia spp
(500ppm)
Ekstrak kulit batang (G. dioica, G. cowa, G. forbesii, G. griffitii dan G. mangostana) sejumlah
kurang lebih 50mg ekstrak dilarutkan dengan
metanol sampai volume 100ml. Larutan disa
ring dengan penyaring milipore 0,45 m. Larutan
diinjeksikan ke dalam system kromatografi dengan fasa diam (oktadesilsilane C - 18), fasa gerak
metanol air system gradient polarity dengan kenaikan metanol 2% tiap menit, kecepatan aliran
1ml/menit, detektor UV pada:
Uji Spesifisitas
Spesifisitas ditentukan dengan menganalisis
campuran larutan standar rubraxanton yang dicampur dengan senyawa pembanding mangostin. Larutan diinjeksi dengan volume injeksi 20
l ke dalam sistem KCKT. Kemampuan pemisahan semua senyawa dalam sampel ditunjukkan
dengan menghitung resolusi (R) antara puncakpuncak yang dihasilkan. Identifikasi ditentukan dengan membandingkan waktu retensi dari
puncak-puncak utama pada masing-masing kromatogram dari larutan uji dengan kromatogram
larutan standar.
Linieritas dan Kurva Kalibrasi
Linieritas dilakukan analisa seri larutan standar rubraxanton (lima seri kosentrasi) dan di
njeksikan pada alat KCKT dengan menggunakan
loop 20ul. Kurva kalibrasi dibuat dengan memplot luas area yang didapat dari analisa terhadap
kosentrasi standar. Linieritas ditentukan oleh
harga r (koefisien korelasi).
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Presisi
Presisi yang dilakukan mencakup presisi
sistem dan presisi metoda. Presisi sistem dilakukan dengan menginjeksikan larutan standar de
ngan kosentrasi tertentu sebanyak enam kali pe
ngulangan yang dilakukan setiap hari pengerjaan.
Pengukuran variabel intra dan inter-day dibutuhkan untuk penentuan presisi metoda. Tiga
variasi kosentrasi larutan standar rubraxanton
di injeksikan ke dalam sistem KCKT. Kosentrasi
standar rubraxanton dari eksperimen dihitung
dengan persamaan garis lurus yang didapat dari
kurva kalibrasi. Relatif Standar Deviasi (RSD) digunakan sebagai nilai presisi. Presisi intra dan inter-day didapat dengan melakukan analisa secara
triplet dalam sehari yang dilakukan selama 3 hari
dengan kondisi KCKT yang sama.
Akurasi
Akurasi metoda ditentukan oleh pengujian recovery menggunakan metoda standar addisi. Tiga
variasi kosentrasi larutan standar rubraxanton
disiapkan dan ditambahkan kedalam larutan uji
ekstrak Garcinia spp. Larutan diinjeksikan de
ngan tiga kali pengulangan ke dalam sistem KCKT
untuk tiap-tiap kosentrasi selama tiga hari.
Sensistifitas
Sensitifitas ditentukan dari perhitungan nilai
LOD dan LOQ.
HASIL DAN PEMBAHASAN
Analisa kualitatif dan kuantitatif dari rubraxanton secara KCKT dilakukan setelah dilaksa
nakan uji kesesuain sistem. Dalam penelitian
ini fase gerak yang digunakan adalah campuran
metanol : air dengan kepolaran diturunkan tiap
menitnya. Untuk pengujian ini diperoleh harga N
= 173863.3 dan nilai JSPT = 0,001438mm/pelat
teori.
Pada pengujian spesifisitas menggunakan
sistim ini diperoleh pemisahan yang baik senyawa rubraxanton dengan senyawa mangostin
161
Penentuan Kadar Rubraxanton pada Ekstrak Kulit Batang Garcinia spp.
(Gambar 1) dengan harga resolusi (R) = 1,4112,
faktor kapasitas (k) = 7,40038.
Validasi metoda KCKT dari rubraxanton dalam
ekstrak Garcinia spp dilakukan terhadap beberapa parameter:
1. Linieritas dan Kurva Kalibrasi
Linieritas dan kurva kalibrasi dilakukan dengan menganalisa larutan standar rubraxanton
yang dibuat pada enam variasi dosis. Sebagai parameter adanya hubungan linier atau tidak digunakan koefisien korelasi r pada garis regresi linier
y=154166,7302 (x) 134007,8756, dari metoda
ini didapat harga r = 0, 9996. Uji T student untuk
membuktikan adanya hubungan antara kosentrasi dengan luas puncak pada df = 4 dengan taraf
kepercayaan P = 0,05 ternyata t hitung = 79,052
> t tabel = 2,747, yang berarti Ho ditolak dan ada
korelasi yang bermakna antara kosentrasi dan
luas area (Gambar 2).
2. Sensitivitas
Kepekaan metoda analisa ditentukan oleh batas deteksinya (LOD) sedangkan batas kuantitas
terkecil yang dapat dianalisa oleh suatu metoda
dengan cermat diistilahkan sebagai LOQ. LOD
dan LOQ dapat ditentukan dari kurva linieritas larutan standar yang dibuat dengan berbagai konsentrasi. Hasil perhitungan LOD dan LOQ analisa
rubraxanton diperoleh dari persamaan regresi
larutan standar adalah LOD = 0,55ug/ml dan
LOQ = 1,82 ug/ml.
Gambar 1. Kromatogram standard rubraxan-
thon dan senyawa mangostin
Gambar 2. Kurva linieritas larutan baku rubra-
xanthon
Gambar 3. Kromatogram Sampel Ekstrak
Garcinia dioica 458,362 ug/ml
Gambar 4. Kromatogram Sampel Ekstrak
Garcinia mangostana 459,745 ug/ml
162
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Meri Susanti, Dachriyanus, Deddy Prima Putra, dan Fatma Sriwahyuni
dar Deviasi Relative (RSD) < 5 %. Harga recovery
yang diperoleh dalam metoda ini telah memenuhi
persyaratan recovery untuk analisis yakni berkisar antara 95 105% dimana selisih kadar pada
berbagai penentuan < dari 5%.
3. Akurasi
Untuk menilai ketepatan suatu metoda parameter penting lainnya adalah akurasi dan recovery dari baku yang ditambahkan ke dalam
sampel uji tersebut. Prosentase recovery yang
didapat merupakan penilaian ketepatan metoda
yang dipakai. Pada penelitian ini akurasi metoda
ditetapkan dengan metoda standar addisi. Metoda ini dipilih karena sampel yang diuji berupa
ekstrak sehingga komponen pembawanya sangat
kompleks dan tidak dapat diketahui secara pasti sehingga tidak memungkinkan untuk menggunakan metoda sampel plasebo. Dari Tabel 1
terlihat bahwa prosentase standar rubraxanton
yang diperoleh kembali dalam ekstrak dengan
rentang 96,32% sampai 106,30% dengan Stan-
4. Presisi
Presisi yang dilakukan meliputi presisi sistem
yang dilakukan selalu setiap saat akan melakukan KCKT. Uji ini dilakukan dengan penyuntikan
berulang larutan standar yang diketahui konsentrasinya sebanyak 6 kali penyuntikan untuk
menunjukkan kinerja alat pada kondisi dan hari
pengujian dengan batas presisi RSD 2%. Harga
Relatif Standar Deviasi (RSD) dari 6 kali penyuntikan larutan standar adalah 1,354%, hal ini ber-
Tabel 1. Akurasi dan Recovery standar rubraxanton yang ditambahkan dalam pengujian Rubraxanton
secara KCKT selama 3 hari.
Kosentrasi standar yang
Recovery (%)
ditambahkan (g/ml)
Hari 1
Hari 2
Hari 3
102,828
2,866
97,040
4,292
96,061
2,936
101,348
5,582
94,987
6,196
95,905
0,407
99,062
0,928
97,315
0,795
96,341
2,921
5,5
11
16,5
Mean (%)
101,080
1,897
97,315
1,452
96,102
0,221
RSD (%)
1,699
1,808
1,919
Tabel 2. Hasil Uji Presisi intra day Metoda Penetapan Kadar Rubraxanton dalam Ekstrak Garcinia mangostana
No
Berat Sampel
Tertimbang (mg)
1.
50,0
Kadar larutan
(g/ml)
459,264
2.
50,1
460,182
3.
50,0
459,264
4.
50,0
459,264
5.
50,2
461,101
6.
50,1
460,182
Luas Puncak
Rata-rata
Perlakuan 1&2
6336749
Kadar
rubraxanthon (%)
6356879 9,168
6377009
6345054
6322757 9,101
6308765
6198765
6194309 8,938
6189852
6240029
6279892 9,059
6319754
6411018
6401222 9,193
6391425
6389765
6366666 9,163
6343567
Rata2
9,104 0,095
RSD
1,044 %
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
163
Penentuan Kadar Rubraxanton pada Ekstrak Kulit Batang Garcinia spp.
arti metoda ini telah memenuhi persyaratan Farmakope Indonesia edisi IV yaitu kecil atau sama
dengan 2%.
Presisi metoda dilakukan dengan replikasi
atau keberulangan sampel ekstrak Garcinia spp
yang diuji dengan cara yang sama sebanyak 6
kali pengulangan. Dalam pengujian ini digunakan
ekstrak G. mangostana. Dari Tabel 2 terlihat jelas presisi metoda pengujian rubraxanton dalam
ekstrak G. mangostana ini memenuhi persyaratan
yang berlaku yaitu RSD 2%. Sehingga metoda
ini dapat digunakan untuk maksud penetapan kadar rubraxanton di dalam ekstrak.
Presisi inter-day (ruggedness) dilakukan de
ngan replikasi atau keberulangan sampel ekstrak Garcinia mangostana yang diuji dengan cara
yang sama yang dibuat sebanyak 3 seri kosentrasi dimana tiap-tiapnya dibuat 3 kali pengulangan
yang dilakukan pada hari yang berbeda. Dari hasil pengujian terlihat bahwa harga RSD untuk hari
yang berbeda adalah 0,720%.
Dari hasil pengujian secara KCKT terhadap
ekstrak beberapa spesies Garcinia spp ini diketahui bahwa masing-masing ekstrak uji mengandung senyawa rubraxanton dengan kandungan
dalam masing-masing ekstrak adalah G. mangostana = 9,161%, G. cowa = 6,942%, G. dioica
= 6,762%, G. forbesii = 0,499% dan G. griffitii
0,229%. Dari data ini terlihat bahwa kadar rubraxanton dalam ekstrak G. mangostana, G. cowa
dan G. dioica >1% (Gambar 3), sehingga dapat
DAFTAR PUSTAKA
1. Cannel RJP. Natural Product Isolation. Tokowa
New Jersey: Human Press Inc 1998: 170-175
2. Iimuna M, Tosa H, Tanaka T, Asai F, Kobayashi Y,
Shimano R, Miyauchi K. Antibacterial Activity of
Xanthones from Guttiferous Plants Against Methi-
cillin-Resistant Staphylococcus aureus. J Pharm
Pharmacol 1996; 48(8): 861-5
3. Pattalung PN, Wiriyachitra P, Ongsakul M. The an-
timicrobial activities of rubraxanthone isolated
164
from Garcinia parviflia Miq. Journal Science Social
dikatakan bahwa rubraxanton merupakan salah
satu komponen mayor dalam ekstrak tumbuhan
ini. Sementara pada G. forbesii dan G. griffitii rubraxanton merupakan komponen minor karena
kadarnya yang kurang dari 1% dalam masing-masing ekstrak tersebut.
Dari penelitian ini diperoleh informasi bahwa
ekstrak dengan kandungan rubraxanton tertinggi
adalah pada spesies G. mangostana (Gambar 4).
KESIMPULAN
Dari hasil penelitian yang telah dilakukan dapat
diambil kesimpulan bahwa metoda Kromatorafi
Cair Kinerja Tinggi (KCKT) dengan kolom fase
terbalik C-18 fase gerak metanol air dengan system gradient polarity yang dimulai dengan metanol 20 % sampai metanol 100% dengan kenaikan
metanol 2%/menit, kecepatan aliran 1ml/menit,
detektor UV pada panjang gelombang 243nm
merupakan metoda yang tervalidasi meliputi presisi, akurasi dan recovery, linieritas, LOD dan LOQ,
spesifisitas memenuhi persyaratan yang ditetapkan. Kadar rubraxanton dalam ekstrak Garcinia
spp yang diperoleh dengan metoda KCKT adalah
G. Manostana 9,161%, G, cowa 6,942%, G. dioica
6,762%, G. forbesii 0,499% dan G. griffiti 0,229%
dimana ekstrak dengan kadar rubraxanton tertinggi adalah pada ekstrak G. mangostana.
1988; 14: 6771.
4. Lee H, Chan H. 1,3,6trihydroxy-7-methoxy8-(3,7-dimethyl-2,6-octadienyl) xanthone from
Garcinia cowa. Phytochemistry 1997; 16: 2003820040.
5. Abusarakam W, Phongpaichit S, Jansakul C, Wiri-
yachitra P. Screening of Antibacterial Activity of
Chemical Xanthon from Garcinia mangostana. Journal of Science and Technology 1983; 5: 337 339.
6. Dachriyanus, Dianita R, Jubahar J. Uji Aktivitas Antimikroba dan Antioksidan Senyawa Hasil Isolasi dari
Kulit Batang Tumbuhan Garcinia cowa Roxb. Jurnal
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Meri Susanti, Dachriyanus, Deddy Prima Putra, dan Fatma Sriwahyuni
Matematika dan Pengetahuan Alam 2003; 12.
7. World Health Organization. Quality Control Me-
thods for Medicinal Plant Material. England, 199
The United States Pharmacopeial Convention.
The Unitesd Sates Pharmacopeia 24th ed and The
National Formulary 19th ed Rockville. P 2000:
2149 2151.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
8. Departemen Kesehatan Republik Indonesia. Far-
makope Indonesia. Ed IV. Jakarta, Indonesia, 1996.
9. Departemen Republik Indonesia. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Indonesia, 2000.
10. Adamovics JA. Chromatographic anaysis of Pharmaceuticals. New York: Marcell Dekker, 1990.
165
Artikel Penelitian
Alga Merah (Gracilaria verrucosa) sebagai Bahan Bakto Agar
Shirly Kumala, Ros Sumarny, Rum Rachmani,
dan Atut Ruswita
ABSTACT: The used of bacto agar in microbiological studies increased tremendously, however, up till now, to fullfill its high demand the scientist were still relying on imported bacto agar eventhough domestic production of bacto agar was
as good and reliable as those produced commercially overseas. The current study
we focuseon the production of bacto agar from red algae Gracilaria verrucosa
using fell press technique; followed by quality analysis of the product. Red algae
samples were collected from two different locations (Bekasi and Subang). Qua
lity of the product was tested for its content, acid insoluble ash content, overall
ash content, pH, gel strength and its ability to be use as culture media to culture
Escherichia coli and Staphylococcus aureus. Microbiological test was performed
via pour plate. The results clearlydemonstrated that red algae sample from Bekasi produced bacto agar that meets the criteria of commercial bacto agar. It has
10.3% water content, 3.9%overall ash content, 0.4% acid insoluble ash content,
pH of 7.3 and gel strength of 600.8 - 602.8 g/square cm.
Keywords: Bacto agar, red Algae, Gracilaria verrucosa, Microbe media
Laboratorium Pengujian dan
Penelitian (Q Lab), Fakultas Farmasi
Universitas Pancasila, Jakarta
ABSTRAK : Pemanfaatan bakto agar dalam negeri untuk bidang mikrobiologi
semakin meningkat, namun untuk memenuhi kebutuhan tersebut masih meng
andalkan bakto agar impor, walaupun produksi alga penghasil agar di dalam
negeri cukup tinggi. Pada penelitian ini dilakukan pembuatan bakto agar dari
alga merah Gracilaria verrucosa dengan metode gel press serta dilakukan analisis mutu bakto agar yang dihasilkan. Sampel alga merah yang digunakan berasal
dari dua tempat budidaya, yaitu dari Bekasi dan Subang. Bakto agar dianalisis
rendemen dan mutunya yang meliputi kadar air, kadar abu, kadar abu tak larut
asam, nilai pH, dan kekuatan gel, serta kemampuannya dalam menumbuhkan
bakteri Escherichia coli dan Staphylococcus aureus. Uji mikrobiologi dilakukan
dengan metode tuang (pour plate). Hasil analisis mutu bakto agar menunjukkan
bahwa sampel alga merah dari Bekasi menghasilkan bakto agar yang memenuhi
standar bakto agar komersial dengan karakteristik kadar air 10,2575%, kadar
abu 3,86%, kadar abu tak larut asam 0,38%, nilai pH 7,31, serta kekuatan gel
sebesar 600,8205-602,8166 g/cm2.
Kata kunci: Bakto agar, Alga merah, Gracilaria verrucosa, Media mikroba
Korespondensi:
Shirly Kumala
Email : fskumala@yahoo.com
166
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Shirly Kumala, Ros Sumarny, Rum Rachmani, dan Atut Ruswita
PENDAHULUAN
Alga merah adalah salah satu jenis rumput laut
yang banyak digunakan sebagai bakto agar. Bakto
agar adalah agar yang telah dimurnikan dengan
mereduksi kandungan pigmen-pigmen pengotor,
kandungan garam (NaCl), dan kandungan bahanbahan asing (organik dan anorganik) serendah
mungkin, sehingga dapat mendukung pertumbuhan mikroba secara umum (1). Bakto agar memiliki kualitas tertentu sehingga dapat digunakan
dalam bidang mikrobiologi dan bioteknologi.
Beberapa persyaratan standar untuk bakto agar
adalah kekuatan gel (gel strength) minimal 400
g/cm2, kadar air 15%, kadar abu 4,5%, abu tak
larut asam 1%, dan pH 7-7,5 (2).
Hasil penelitian tentang ekstraksi agar yang
telah dilakukan umumnya baru menghasilkan
agar kualitas pangan (food grade). Beberapa
kelemahan yang menyebabkan tidak masuknya
kualitas agar ke dalam bakto agar adalah rendah
nya gel strength, tingginya kadar abu dan abu
tak larut asam. Sampai saat ini keperluan bakto
agar dalam negeri masih mengandalkan bakto
agar impor, walaupun produksi rumput laut
penghasil agar di dalam negeri cukup tinggi (2).
Berdasarkan data Kementrian Kelautan dan Perikanan, produksi rumput laut Indonesia pada tahun 2006 mencapai 1.374.462 ton.Namun untuk
memenuhi kebutuhan agar dalam negeri, Indonesia harus mengimpor agar sebanyak 665.154
kg. Oleh karena itu, potensi pengembangan bakto
agar dalam negeri harus ditingkatkan sehingga
dapat menekan angka impor produk olahan rum-
put laut seperti bakto agar (1).
Jenis rumput laut yang dapat digunakan dalam
pembuatan agar adalah alga merah (Rhodophyceae), alga jenis Agarophyte, yaitu alga yang menghasilkan agar-agar sebagai metabolit primernya
(1). Beberapa jenis alga merah penghasil agar
di Indonesia adalah Gracilaria sp., Gelidium rigidum, Rhodymenia ciliata, dan Gelidiella sp (2).
Jenis yang paling banyak ditemukan di Indonesia
adalah jenis Gracilaria karena selain dapat diperoleh dari alam, jenis ini juga telah dibudidayakan
(3). Berdasarkan standar Supreme Marine Chemical, spesifikasi bakto agar meliputi kadar air, kadar abu, kadar abu tak larut asam, kekuatan gel,
dan nilai pH seperti terlihat pada Tabel 1 (2).
BAHAN DAN METODE
Bahan
Bahan baku yang digunakan dalam penelitian
ini adalah alga merah jenis Gracilaria verrucosa
yang berasal dari dua tempat budidaya, yaitu
Bekasi dan Subang.
Bahan kimia yang digunakan adalah larutan
kapur (CaO) 0,5%, asam asetat 1%, dan larutan
KCl. Alat yang digunakan antara lain beaker glass,
erlenmeyer, gelas ukur, cawan Petri, pipet volume, oven, autoklaf, dan Laminar Air Flow Cabinet (LAF).
Metode
Pengolahan alga merah menjadi bakto agar
dilakukan dengan metode gel press. Sampel alga
Tablel 1. Spesifikasi bakto agar komersial (standar supreme marine chemical)
Parameter
Reguler
Standar
Premium
Kadar air (water content) (%)
< 15,0
< 12,0
< 9,0
Kadar abu tak larut asam(Acid insoluble ash content) (%)
< 1,0
< 1,0
< 1,0
Kadar abu.(Ash content) (%)
Kekuatan gel(gel strength) (g/cm2)
Nilai pH(pH value)
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
< 4,5
400,0 - 500,0
7,0 -7,5
< 4,0
500,0 - 650,0
6,8 7,0
< 1,0
> 650,0
6,8 7,0
167
Alga Merah sebagai Bahan Bakto Agar
merah dicuci dengan air tawar hingga bersih dan
dikeringkan dalam oven pada suhu 40-45oC selama 2 hari atau hingga kadar air sampel < 15%.
Sampel kemudian direndam dalam air tawar selama 3 hari dengan mengganti air rendaman setiap harinya.
Selanjutnya sampel direndam dalam larutan
kapur (CaO) 0,5% selama 5-10 menit dan dicuci
dengan air bersih hingga bau kapur hilang. Sampel kemudian dijemur di bawah sinar matahari
sampai kering atau sekitar 1 jam (4).
Sampel yang telah memucat direndam dalam
asam asetat 1% selama 1 jam dan dibilas hingga netral, kemudian dihancurkan dengan blen
der (5). Sampel diekstraksi ataudirebus dengan
aquadest sebanyak 20 kali berat sampel kering.
Perebusan dilakukan dalam suasana netral pada
suhu 90-95oC selama 2 jam. Setelah itu, dilakukan
penyaringan untuk memisahkan filtrat dan ampas rumput laut (4). Filtrat dipanaskan kembali
hingga suhu 90-92oC dan ditambahkan khitosan
1% dari berat sampel kering dengan waktu absorbsi atau pemanasan selama 45 menit (5). Filtrat ditambahkan KCl 3% dari berat sampel kering
dan dipanaskan pada suhu 60oC selama 30 menit
sambil terus diaduk. Selanjutnya filtrat dituang
ke dalam pan pencetak dan dibiarkan menjendal
selama 12 jam pada suhu ruang. Agar yang telah
menjendal dikeluarkan dari pan pencetak dan dipotong menggunakan alat pemotong agar hingga
didapat potongan yang berbentuk lembaran. Tiap
lembar agar dibungkus dengan kain blacu dan
disusun dalam kotak yang kemudian diberi pemberat pada bagian atasnya dan dibiarkan selama
satu malam (4).
Pengepresan bertujuan untuk mengeluarkan
air dari agar hingga diperoleh lembaran agar
yang tipis. Lembaran agar hasil pengepresan di
keringkan dan diserbukkan hingga diperoleh
agar-agar tepung.
Pengujian mutu bakto agar yang dilakukan
meliputi perhitungan rendemen, analisis kadar
air, kadar abu, kadar abu tak larut asam, nilai pH,
dan kekuatan gel. Sedangkan analisis mikrobiologi dilakukan dengan cara menumbuhkan bakteri
168
uji pada media dengan teknik agar tuang (pour
plate) menggunakan bakteri uji Escherichia coli
(mewakili bakteri Gram negatif) dan Staphylococcus aureus (mewakili bakteri Gram positif).
Alga merah Gracilaria verrucosa
(Red algae Gracilaria verrucosa)
Pencucian
(washing)
Pengeringan
(drying)
Perendaman dalam air (3 hari)
[soaking in water (3 days)]
Pemucatan
( bleaching)
Perlakuan asam
(Acid treatment)
Ekstraksi (T= 90-95oC, t = 2 jam)
[Extraction (T = 90-95 C, t = 2 hours)]
Penyaringan
(Filtration)
Pemurnian dengan khitosan
T = 90-92oC, t = 45 menit)
Purification with chitosan
(T = 90-92oC, t = 45 min)]
Penjendalan dengan KCl (T = 60oC, t = 30 menit)
[Gelation with KCl (T = 60oC, t = 30 minutes)]
Pengeringan
(drying)
Penepungan
(Flouring)
Bakto agar
(Bacto agar)
Gambar 1. Diagram alir ekstraksi bakto agar
dari Gracilaria verrucosa
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Shirly Kumala, Ros Sumarny, Rum Rachmani, dan Atut Ruswita
HASIL DAN PEMBAHASAN
Rendemen
Rendemen merupakan salah satu parameter
penting dalam menilai efektif atau tidaknya suatu
proses produksi. Nilai rendemen bakto agar dihitung berdasarkan perbandingan berat bakto agar
yang dihasilkan terhadap berat kering alga merah
(2). Rendemen bakto agar yang dihasilkan adalah
22,6200% untuk sampel Bekasi dan 30,6304%
untuk sampel Subang.
Tinggi rendahnya rendemen agar dapat dipe
ngaruhi oleh spesies alga, usia panen, dan iklim.
Pada penelitian ini, perbedaan rendemen yang
dihasilkan bisa disebabkan karena adanya perbedaan habitat, iklim, dan usia panen. Namun, rendemen yang dihasilkan dari kedua sampel dapat
dikatakan baik. Berdasarkan penelitian yang dilakukan oleh Abdullah, rendemen agar yang dihasilkan dari Gracilariaadalah 21,39%. Sedang
kan kandungan agar pada Gracilaria umumnya
berkisar antara 16 45% (5).
Kadar air
Pengujian kadar air dilakukan untuk mengetahui kandungan air dalam bakto agar yang dihasilkan. Kadar air yang didapat adalah 10,2575%
untuk sampel Bekasi dan 11,3730% untuk sampel Subang. Kadar air pada kedua sampel tidak
terlalu berbeda karena proses pengeringan bakto
agar untuk kedua sampel adalah sama, yaitu de
ngan menggunakan oven pada suhu 50C selama
24 jam. Apabila dibandingkan dengan bakto agar
komersial, maka kadar air bakto agar dari kedua
sampel telah memenuhi standar spesifikasi bakto
agar komersial dengan grade standar.
Kadar abu
Tujuan utama dari analisis kadar abu adalah
untuk mengetahui secara umum kandungan mineral yang terdapat dalam suatu bahan. Nilai
kadar abu pada bahan pangan menunjukkan besarnya jumlah mineral yang terkandung dalam
bahan pangan tersebut. Elemen mineral yang
paling banyak terdapat pada alga adalah kalium,
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
kalsium, fosfor, zat besi, dan iodium. Mineral diperlukan oleh mikroorganisme untuk tumbuh
namun dalam jumlah yang sedikit (2).
Pengujian kadar abu dilakukan berdasarkan
prosedur yang tertera pada SNI 01-4105-1996
(6). Kadar abu yang dihasilkan adalah 3,86%
untuk sampel Bekasi dan 4,93% untuk sampel
Subang. Nilai kadar abu dari sampel Subang masih berada diatas standar supreme marine chemical, yaitu kadar abu maksimal 4%. Hal ini dapat
dipengaruhi oleh proses pencucian sampel alga
yang kurang sempurna. Sampel alga yang berasal
dari budidaya hidup pada habitat lumpur sehingga menyebabkan adanya pengotor yang melekat
pada alga, seperti lumpur, kerang, dan lain-lain.
Jika alga tidak dicuci hingga benar-benar bersih,
maka pengotor yang masih ada pada alga tersebut akan ikut menjadi abu dan terukur sebagai
kadar abu dari agar. Untuk menghilangkan kotoran yang ada pada alga, diperlukan pengadukan
terus-menerus selama pencucian dan dilakukan
berulang-ulang dengan air bersih.
Jika dibandingkan dengan kadar abu dari sampel alga itu sendiri, yaitu 32,86% untuk sampel
Bekasi dan 36,98% untuk sampel Subang, kadar
abu dari bakto agar yang dihasilkan mengalami
penurunan. Hal ini dapat terjadi karena adanya
pemurnian dengan khitosan yang akan menyerap
komponen pengotor pada agar.
Kadar abu bakto agar tidak boleh lebih besar
dari standar, karena nilai kadar abu yang berlebihan dapat menghambat bakteri yang ditumbuhkan pada media tersebut (2).
Kadar abu tak larut asam
Kadar abu tak larut asam adalah salah satu
kriteria untuk menentukan tingkat kebersihan
pada proses pengolahan yang dicerminkan adanya kontaminasi logam berat yang tidak larut
asam dalam suatu produk (2). Kadar abu tak larut
asam pada bakto agar yang dihasilkan adalah
0,38% untuk sampel Bekasi dan 0,76% untuk
sampel Subang. Hasil ini telah memenuhi standar
supreme marine chemical dengan grade standar
yaitu kurang dari 1%. Rendahnya kadar abu tak
169
Alga Merah sebagai Bahan Bakto Agar
Tabel 2. Hasil Analisis Mutu Bakto Agar
Parameter
Kadar air (water content) (%)
Kadar abu (ash content)(%)
Abu tak larut asam (acid insoluble ash) (%)
Nilai pH (pH value)
Kekuatan gel (gel strength)(g/cm2)
Sampel
Bekasi
Subang
10,1
11,5
3,9
4,9
10,3
0,76
600,8205
688,6481
larut asam pada penelitian ini menunjukkan rendahnya kontaminasi logam berat pada bakto agar
yang dihasilkan.
Nilai pH
Nilai pH merupakan nilai yang menunjukkan
derajat keasaman suatu bahan. pH atau derajat
keasaman juga merupakan faktor yang mempe
ngaruhi pertumbuhan bakteri pada media. Nilai
pH bakto agar yang diperoleh adalah 7,31 untuk
sampel Bekasi dan 7,50 untuk sampel Subang.
Nilai pH yang berbeda dipengaruhi oleh kadar
3,6-anhidrogalaktosa pada bakto agar yang tercermin dari kekuatan gel bakto agar. Bila kadar
3,6-anhidrogalaktosa semakin rendah, maka nilai
pH juga semakin rendah (2).
Kekuatan gel
Kekuatan gel merupakan suatu beban maksimum yang dibutuhkan untuk memecah matrik
polimer pada daerah yang dibebani. Kekuatan gel
yang tinggi merupakan salah satu kriteria penting
sehubungan dengan penggunaan agar dalam bidang bioteknologi. Pengujian kekuatan gel dilakukan berdasarkan metode yang tertera pada SNI
01.2802.1995 (7). Kekuatan gel bakto agar yang
dihasilkan pada penelitian ini adalah 600,8205
602,8166 g/cm2 untuk sampel Bekasi dan telah
memenuhi standar bakto agar komersial dengan
grade standar, serta 688,6481698,6285 g/cm2
untuk sampel Subang dan masuk dalam grade
premium.
Karakteristik pembentukan gel agar disebab-
170
11,3
0,38
7,31
Standar
7,50
Reguler
Standar
Premium
< 15,0
<12,0
< 9,0
< 1,0
< 1,0
< 1,0
< 4,5
7,0-7,5
400,0 - 500,0
< 4,0
6,8-7,5
500,0 650,0
< 1,0
6,8-7,5
> 650,0
kan oleh tiga buah atom H pada residu 3,6 anhidro L-galaktosa yang memaksa molekul-molekul untuk membentuk struktur heliks. Interaksi
antar struktur heliks menyebabkan terbentuknya
gel.
Pergantian senyawa 3,6 anhidro L-galaktosa
oleh senyawa L-galaktosa sulfat menyebabkan
kekacauan dalam strukturheliks dan dalam keadaan seperti ini, kekuatan gel menjadi menurun.
Adanya 3,6 anhidrogalaktosa akan menyebabkan
sifat anhidrofilik dan meningkatkan pembentukan heliks rangkap sehingga terbentuk gel yang
kuat (2). Hasil analisis mutu bakto agar dapat
dilihat pada Tabel 2.
Hasil Uji Mikrobiologi
Pengujian mikrobiologi dilakukan untuk melihat kemampuan sampel bakto agar dalam menumbuhkan bakteri ketika digunakan bersama
komponen media pertumbuhan lainnya. Bakteri
uji yang digunakan adalah Escherichia coli (mewakili bakteri Gram negatif) dan Staphylococcus
aureus (mewakili bakteri Gram positif), dengan
menggunakan Nutrient Agar sebagai kontrol
positif.Hasil menunjukkan, bakteri uji tumbuh
pada media dengan bakto agar dari sampel Bekasi dan Subang.
KESIMPULAN
Dari hasil penelitian ini dapat disimpulkan
bahwa bakto agar yang dihasilkan dari alga
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Shirly Kumala, Ros Sumarny, Rum Rachmani, dan Atut Ruswita
merah Gracilaria verrucosa, baik yang berasal
dari Bekasi maupun Subang, sudah memenuhi
standar mutu agar, antara lain kadar air
10,2575% untuk sampel Bekasi dan 11,3730%
untuk sampel Subang, abu tak larut asam 0,38%
untuk sampel Bekasi dan 0,76% untuk sampel
Subang, nilai pH 7,31 untuk sampel Bekasi dan
7,50 untuk sampel Subang, serta kekuatan gel
sebesar 600,8205-602,8166 g/cm2 untuk sampel Bekasi dan 688,6481-698,6285 g/cm2 untuk
sampel Subang.Sedangkan untuk kadar abu, pada
sampel Bekasi sudah memenuhi standar, yaitu
3,86%, namun pada sampel Subang masih belum
memenuhi standar, yaitu 4,93% (lebih besar dari
4,5%). Untuk rendemen bakto agar yang dihasilkan sebesar 22,6200% untuk sampel Bekasi dan
30,6304% untuk sampel Subang.
Berdasarkan hasil uji mutu tersebut, bakto
agar dari alga merah Gracilaria verrucosa yang
berasal dari Bekasi sudah memenuhi standar, se-
DAFTAR PUSTAKA
1. Murdinah, Apriani, Siti Nurbaity K., Nurhayati,
Subaryono. Pengolahan Agar dari Gracilaria sp. Jakarta: Balai Besar Penelitian dan Pengembangan
Pengolahan Produk dan Bioteknologi Kelautan
dan Perikanan; 2011:1-21.
2. Murdinah, Fransiska Dina, Subaryono. Pembuatan
dangkan sampel alga merah asal Subang belum
memenuhi standar bakto agar komersial yang
ada.
Perlu dilakukan penelitian lanjutan untuk melakukan analisis mutu bakto agar yang dihasilkan
dari alga merah jenis lainnya atau alga merah
Gracilaria verrucosa yang berasal dari tempat budidaya di wilayah yang berbeda.
UCAPAN TERIMA KASIH
Penelitian ini merupakan Program IBIKK
Laboratorium Pengujian dan Penelitian (QLab)
Fakultas Farmasi Tahun ke-2 (Tahun Anggaran
2011).Dan dibiayai oleh Kopertis Wilayah III Jakarta Kementerian Pendidikan Nasional, sesuai
Surat Perjanjian Pelaksanaan Program Pengabdian Kepada Masyarakat Multi Tahun Nomor: 058/
K3/KU/K/2011 tanggal 4 Mei 2011.
Publisher; 2011:7-40.
4. Departemen Kelautan dan Perikanan. Teknologi
Pemanfaatan Rumput Laut. Jakarta: Badan Riset
Kelautan dan Perikanan; 2003: 2-9.
5. Abdullah A. Pengaruh Penambahan Khitosan ter-
hadap Mutu Agar Bakto (Bacto Agar) (skripsi).
Bogor: Fakultas Perikanan dan Ilmu Kelautan IPB;
2004: 5-60.
Bakto Agar dari Rumput Laut Gelidium rigidum
6. Badan Standardisasi Nasional. SNI 01-4105-1996.
Perikanan.;3(1): 2008; 79-86.
7. Badan Standardisasi Nasional. SNI 01-2802-1995.
untuk Media Tumbuh Bagi Mikroorganisme. Jur
nal Pascapanen dan Bioteknologi Kelautan dan
3. Kordi, K. M. Ghufran H. Kiat Sukses Budi Daya
Rumput Laut di Laut & Tambak. Yogyakarta: Lily
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Agar-agar kertas. Jakarta: Badan Standardisasi Nasional. 1996.
Agar-agar tepung. Jakarta; Badan Standardisasi
Nasional. 1995.
171
Artikel Penelitian
Karakteristik Fisik dan Displacement Value
Supositoria Neomisin Sulfat berbasis PEG
Alasen Sembiring Milala, Aditya Trias Pradana,
dan Andrew Pierce Boehe
ABSTRACT: Physical characteristic and the Displacement Value of Neomycin sulfate in suppository with various composition of PEG 400-4000
as it carrier has been studied. Displacement Value has been determined
to adjust the weight of suppositories that varies due to the density difference among drug substance and its carriers. The method used in the
determination of Displacement Value is the Moody method. Beside the
displacement value, we have also evaluated the physical characteristic
of suppository that has been produced, such as weight uniformity, hardness, macro and micro melting point andliquefaction ability. The results
shows that all measurements meet the requirements and the Displacement Value of Neomycin sulfate obtained from Moody method, was 0.96.
Keywords : Suppository, Displacement Value, Neomycin sulfate
Fakultas Farmasi
Universitas Surabaya
ABSTRAK: Telah dilakukan penelitian mengenai penentuan karakte
ristik fisik dan Displacement Value Neomisin sulfat di dalam formulasi
suppositoria dengan berbagai perbandingan PEG 400 4000 sebagai
pembawa. Displacement Value ditentukan untuk penyesuaian bobot
suppositoria yang nilainya bervariasi karena besarnya densitas bahan
aktif yang berbeda dari densitas pembawa. Metode yang digunakan
dalam penentuan Displacement Value ini adalah metode Moody. Evaluasi yang dilakukan antara lain uji keseragaman bobot, uji kekerasan,
uji titik leleh makro dan mikro, dan uji kemampuan mencair. Hasil uji
keseragaman bobot, uji kekerasan, uji titik leleh makro, mikro, dan
uji mencair memenuhi persyaratan suppositoria. Dari hasil yang diperoleh dengan metode Moody, Displacement Value Neomisin sulfat
adalah 0,96.
Kata kunci: Suppositoria, Displacement Value, Neomisin sulfat
Korespondensi:
Alasen Sembiring Milala
Email : alasen2004@yahoo.com
172
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Alasen Sembiring Milala, Aditya Triaspradana, dan Andew Pierce Boehe
PENDAHULUAN
Suppositoria merupakan salah satu bentuk sediaan farmasi yang mempunyai beberapa keunggulan, yaitu bahan aktif tidak mengalami hepatic
first pass effect, dapat memberikan efek lokal dan
sistemik, dapat digunakan untuk pasien yang tidak sadar dan tidak dapat menelan, serta dapat
terhindar dari iritasi saluran pencernaan, menutupi rasa dan bau yang tidak enak (2).
Polietilenglikol (PEG) memiliki daya serap
air tinggi, melarut pada cairan rektal dan tidak
memiliki efek samping. Sedangkan Oleum cacao adalah suatu lemak padat yang berasal dari
biji tanaman Theobroma cacao, melunak pada
suhu tubuh dan tidak menyebabkan iritasi. Baik
PEG maupun Oleum cacao mudah mencair saat
dipanaskan dan cepat membeku saat didingin
kan, stabil pada temperatur ruangan dan mudah
bercampur dengan bahan obat (3,4).
Pada pembuatan sediaan suppositoria perlu
diawali dengan penentuan Displacement Value.
Displacement Value adalah sejumlah bobot dari
bahan-bahan obat yang menggantikan satu bagian dari basis (3). Displacement Value ini berguna untuk menyetarakan jumlah obat dengan
densitas basis suppositoria, sehingga jumlah bahan aktif obat yang tersedia dalam setiap suppositoria dapat diperkirakan. Jika jumlah bahan aktif obat cukup besar, maka volume material harus
diperhitungkan dan jumlah sesungguhnya basis
yang diperlukan untuk mengisi cetakan menjadi
sangat penting (10). Tidak semua bahan obat
dengan basis tertentu memiliki Displacement
Value. Penentuan displacement value diazepam
telah dilakukan dengan beberapa basis berbeda.
Displacement value diazepam dengan basis 10%
beeswax dan 90% Thebroma oil adalah senilai
0,88, sedangkan dengan gelatin-gliserin-air dan
PEG 1540-gliserin-air berturut-turut senilai 1,04
dan 0,98. Perbedaan displacement value tersebut menjadi pertimbangan dalam penimbangan
bahan dan pemenuhan volume supositoria (8).
Suppositoria paracetamol dengan basis kombinasi trigliserida memiliki displacement value 1,4
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
dan 1,46. Sementara dengan basis suppositoria
ester dan basis suppositoria ampifilik berturutturut nilai displacement value-nya adalah 1,4 dan
1,43. Nilai ini selanjutnya digunakan dalam perhitungan jumlah basis yang ditambahkan dalam
formulasi (9).
METODE PENELITIAN
Bahan
Neomisin sulfat p.g (Shanghai Demo Bio-tech
co., Ltd, Shanghai, China) merupakan bahan
aktif yang digunakan dan dibentuk suppositoria dengan bahan tambahan PEG 400 p.g dan
PEG 4000 p.g (Pan Asia Chemical Corp, Taipei,
Taiwan). Untuk memudahkan suppositoria dikeluarkan dari cetakan ditambahkan parafin
liquidium p.g (Bratachem, Surabaya, Indonesia)
yang akan melumuri dinding cetakan.
Alat
Timbangan Analitik (Digital) tipe Sartorius BP
10 (Sartorius, Gottingen, Germany), Penangas air
Memmert seri W 200 (Memmert GmbH, Buchenbach, German), Fisher Johns Melting Point Apparatus
(Thermo Fischer Scientific, Massachusetts, USA),
Cetakan suppositoria nirkarat (Surabaya, Indonesia), Mortirdan stamper, Erweka Suppository Hardness Tester (Erweka GmbH, Heusenstamm, Germany), dan Erweka Suppository Liquefaction Tester
(Erweka GmbH, Heusenstamm, Germany).
Metode Kerja
1. Formulasi Supositoria
Neomisin sulfatdosis 250 mg diformulasikan
dengan basis campuran PEG 400 : 4000 = 40% : 60%.
Untuk sepuluh suppositoria, 2500 mg Neomisin
sulfat digerus hingga halus. PEG 400 dan 4000
ditimbang berturut-turut11000 mg dan 16500
mg, lalu dimasukkan dalam cawan dan dipanaskan pada waterbath. Mortir dihangatkan dengan
pemberian air panas, dan selanjutnya Neomisin
sulfat dimasukkan ke mortir hangat tersebut.
Setelah itu, kedua PEG yang telah meleleh terse-
173
Karakteristik Fisik dan Displacement Value Supositoria Neomicin Sulfat
but dimasukkan ke mortir hangat sambil diaduk
dan digerus, dicampur semuanya hingga homogen. Hasil campuran homogen yang diperoleh
lalu dituang kedalam cetakan yang tersedia. Cetakan kemudian didiamkan di suhu ruangan selama 15 menit, lalu dimasukkan ke dalamlemari
esdandijagatetap5C selama 15 menit. Selanjutnya, cetakan dipindahkan ke freezer-2oC dan
didiamkan selama 30 menit.Cetakan dikeluarkan
dan didiamkan 10 menit di suhu ruangan. Suppositoria yang telah terbentuk dikeluarkan dari
cetakan, kemudian ditimbang bobotnya dan dibungkus dengan aluminium foil, lalu dimasukkan
ke dalam wadah. Proses pembuatan akan menghasilkan 10 sediaan suppositoria.
2. Analisis hasil
Pengujian karakter fisik suppositoria yang dilakukan meliputi pengamatan organoleptis, ke
seragaman bobot, uji kekerasan, penentuan waktu dan suhu leleh serta waktu lebur.
2.1. Organoleptik
Pengujian organoleptik dilakukan dengan
menggunakan panca indera untuk mengetahui bentuk, warna, rasa dan bau suppositoria.
2.2. Keseragaman bobot
Keseragaman bobot suppositoria dilakukan
dengan cara menimbang satu per satu bobot
suppositoria hingga sebanyak 10 buah. Pe
nyimpangan bobot suppositoria yang terbentuk tidak melebihi persyaratan (6), dimana
nilainya tidak lebih dari 5%.
2.3. Kekerasan
Pengujian kekerasan suppositoria diawali
de
ngan pendiaman suppositoria pada suhu
pengamatan 25 1,5C. Suppositoria ditempatkan secara tegak dengan bagian runcing
menghadap keatas, pada sample holder. Pintu
kaca ditutup dan selanjutnya bantalan digeser sehingga batang pemberat dalam posisi
menggantung bersamaan dengan pencatatan
waktu. Penambahan beban dengan berat
masing-masing 200 gram dilakukan setiap 1
menit. Pencatatan waktu dihentikan saat sup-
174
positoria hancur. Penentuan kekerasan diawali dengan memberi beban menggunakan batang pemberat sebelum ditambah beban yaitu
600 gram(7). Jika waktu yang dibutuhkan oleh
suppositoria untuk hancur, setelah penambahan beban terakhir kurang dari atau sama
dengan 20 detik maka beban terakhir tidak
diperhitungkan. Jika dibutuhkan waktu antara 20 sampai 40 detik, maka beban terakhir
dihitung 100 gram saja. Sementara jika waktu
yang dibutuhkan lebih dari 40 detik, maka beban terakhir dihitung penuh yaitu 200 gram.
2.4. Waktu leleh
Pengujian titik leleh makro dan mikro dilakukan untuk menentukan waktu dan suhu
yang diperlukan suppositoria untuk meleleh
sempurna. Pengujian titik leleh makro untuk
mendapatkan waktu leleh diawali dengan
membenamkan seluruh suppositoria dalam
waterbath dengan suhu konstan (37OC). Diukur waktu yang diperlukan oleh suppositoria untuk meleleh atau terdispersi ke dalam
air. Pengujian titik leleh mikro menggunakan
Fisher Johns Melting Point Apparatus. Pengujian diawali dengan meletakkan sejumlah kecil
suppositoria yang telah digerus halus dan homogen lalu dimasukkan ke dalam cover glass.
Suhu diamati saat suppositoria mulai meleleh
sampai meleleh seluruhnya. Titik leleh suppositoria yang diperoleh tidak melebihi 37OC.
2.5. Waktu mencair
Waktu mencair suppositoria ditentukan dengan Erweka Suppository Liquefaction Tester.
Suppositoria dimasukkan ke dalam tabung
yang ditahan ketat dalam sebuah sangkar
(spiral glass), dalam sebuah pipa penguji berskala, yang ditempatkan dalam sebuah mantel
gelas yang dialiri air hangat suhu 37OC, melalui
sebuah pipa kecil gelas yang sekaligus mencegah jatuhnya suppositoria dari sangkarnya,
kemudian diamati waktu suppositoria mulai
mencair sampai mencair seluruhnya.
2.6. Displacement value
Pengujian displacement value dilakukan deJurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Alasen Sembiring Milala, Aditya Triaspradana, dan Andew Pierce Boehe
ngan penimbangan bobot suppositoria pada
timbangan analitik Sartorius BP 10 dengan
dan tanpa bahan aktif sesuai (1, 3, 5) menggunakan perbandingan bobot obat dalam suppositoria dengan bobot basis yang tergantikan
oleh bahan aktif. Perhitungan displacement
value dengan metode Moody dilakukan deng
an perbandingan bobot bahan aktif dalam suppositoria dengan bobot basis yang tergantikan
oleh bahan aktif. Untuk memperoleh hasil perlu dilakukan pengukuran bobot rata-rata suppositoria tanpa bahan aktif, bobot rata-rata
suppositoria dengan bahan aktif, bobot basis
dalam suppositoria, bobot bahan aktif dalam
suppsitoria, bobot basis yang tergantikan oleh
bahan aktif dan besarnya 1 g basis yang tergantikan oleh bahan aktif yang menggambarkan nilai displacement value.
bobot obat dalam suppositoria
Displacement Value =
bobot basis yang tergantikan oleh bahan aktif
HASIL DAN PEMBAHASAN
Hasil pengamatan organoleptis suppositoria
Neomisin sulfat dengan basis PEG 400 dan 4000
diperoleh bentuk suppositoria yang berbentuk
torpedo berwarna putih. Sebelum dilakukan penelitian lebih awal dilakukan kalibrasi cetakan
suppositoria untuk melihat variasi tiap lubang cetakan ketika terisi material. Bobot rata-rata suppositoria dengan basis PEG yaitu 2,94 g 0,0241.
Pengujian karakteristik fisik suppositoria yang
lain meliputi keseragaman bobot, uji kekerasan,
uji titik leleh makro, uji titik leleh mikrodan uji
mencair. Uji keseragaman bobot suppositoria
menurut [6] yaitu bobot tiap suppositoria tidak
boleh menyimpang lebih dari 5% dari bobot ratarata suppositoria. Hasilnya bobot suppositoria
Neomisin sulfat dengan basis PEG untuk replikasi
I III tidak menyimpang lebih dari 5% sehingga
memenuhi persyaratan dan bobot sediaan yang
dihasilkan relatif seragam.
Kekerasan suppositoria diuji dengan menggunakan alat Erweka Suppository Hardness Tester.
Menurut (11) bahwa kekerasan suppositoria tidak kurang dari 1,8 2,0 kg. Data yang diperoleh
untuk suppositoria Neomisin sulfat replikasi I, II,
III dengan rata-rata 1,87 kg sehingga dapat disimpulkan bahwa kekerasan suppositoria yang
dihasilkan telah cukup ideal.
Titik leleh makro suppositoria umumnya tidak boleh lebih dari 37C [7], dan waktu yang
diperlukan untuk meleleh sampai meleleh seluruhnya adalah kurang dari 30 menit. Suppositoria Neomisin sulfat dengan basis PEG replikasi I,
IIdan III member gambaran titik leleh yang baik
dengan rata-rata 17,63 menit. Sedangkan pengujian titik leleh mikro suppositoria Neomisinsulfat PEG rata rata senilai 36,67oC, dimana titik
Tabel 1. Hasil pengujian karakteristik fisik dan displacement value
Replikasi
Keseragaman
Bobot
Suppositoria
(BobotSD)
Kekerasan
Suppositoria
(kg)
Waktu Leleh
Suppositoria
(menit)
Suhu Leleh
Suppositoria
(C)
Waktu Lebur
Suppositoria
(menit)
Displacement
Value
2,92 0,04
1,8
16,13
35,0
20,20
0,93
2,93 0,04
2,0
18,37
37,0
17,40
0,96
2,93 0,04
1,8
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
18,40
38,0
19,20
0,98
175
Karakteristik Fisik dan Displacement Value Supositoria Neomicin Sulfat
leleh mikro menggunakan basis PEG umumnya
tidak lebih dari 37OC (7).
Penentuan waktu mencair yang dilakukan
dengan menggunakan alat Erweka Suppository
Liquefaction Tester menunjukkan bahwa suppositoria Neomisin sulfat-PEG mencair sempurna
setelah rata-rata 18,93 menit. Waktu yang dicapai telah memenuhi persyaratan dimana mencair
tidak lebih dari 30 menituntuk basis PEG (11).
Selanjutnya dilakukan perhitungan Displacement Value dengan menggunakan metode Moody.
Hasil perhitungan Displacement Value dengan
metode Moody untuk Neomisin sulfat dengan
basis PEG 400 (40%) dan 4000 (60%) adalah
diperoleh nilai rata-rata 0,96. Penentuan displacement value penting dalam proses produksi
terutama produksi massal. Bahan aktif dengan
displacement value tersebut akan menggantikan
bobot basis 0,96 bagian. Basis Polybase yang
akan dibentuk suppositroria dengan sumatriptan
25mg, harus mempertimbangkan nilai displace-
ment value. Sumatriptan memiliki displacement
value 0,92, sehingga Polybase yang akan ditam
bahkan untuk melengkapi bobot suppositoria 2,5
gram harus diperhitungkan kembali (12).
DAFTAR PUSTAKA
7. Lachman, L, Lieberman, H. A ., Kanig , J. L, Teori dan
1. Allen LV, 2000, International Journal of Pharma
ceutical Compounding, 2000, 4, (5) : 291-293.
2. Gilman AG,The Pharmacological Basic of Therapeutics, 10 edition, USA, 2001 : 5-20.
th
3. Moody, M..M., Suppositories and Pessaries in Winfield AJ, Richards RME, Pharmaceutical Practise,
2
nd
Edition, International Edition, Churchill, Li
Dari hasil penelitian yang dilakukan, dike
tahui bahwa suppositoria Neomisin sulfat memiliki karakteristik fisika yang sesuai dengan
persyaratan. Terkaitperhitungan Displacement
Value dengan bahan aktif Neomisin sulfatdengan
menggunakan basis PEG, maka dapat disimpulkan bahwa Displacement Value Neomisin sulfat
basis PEG 400 (40%) dan 4000 (60%) dengan
metode Moody adalah0,96.
Berdasarkan penelitian yang telah dilakukan,
dapat dilakukan perhitungan Displacement Value
terhadap bahan aktif Neomisin sulfat menggunakan kombinasi basis yang lain.
Praktek Farmasi Industri III, Universitas Indonesia,
Jakarta, 1994 : 1147-119.
8. Kamal B.A., Iraqi J. Pharm. Sci., Vol 16 (2). University of Baghdad, Iraq, 2007 : 21-27.
9. Ranjita, S., In Vitro Release of Paracetamol from
Suppocire Suppositories: Role of Additives. Ma-
laysian Journal of Pharmaceutical Science, 2010, 8
(1): 57-71.
vingston, 1998 : 170-176.
10. Agoes, G., SediaanFarmasiLikuida Semisolida
don, 2005 : 45 46, 1093.
perse Systems, 2nd Edition, New York, 1994: 243.
4. Reynolds, Martindale, The Complete Drug Refe-
rence, 34 Edition, The Pharmaceutical Press, Lonnd
5. Lund, W (editor), The Pharmaceutical Codex 12th
edition, Pharmaceutical Press, London, 1994:
1039-1041.
6. Departemen Kesehatan Republik Indonesia, Far-
makope Indonesia, Edisi IV, Jakarta, 1995 : 16-17,
135-136, 449-450, 508, 1087-1088, 1193.
176
KESIMPULAN DAN SARAN
(SFI-7). Penerbit ITB, Bandung, 2012: 344-371.
11. Lieberman AH, Pharmaceutical Dosag Forms Dis12. Desai, H.D., Shirley, K.L., Penzak, S.R., Strom, J.G.,
Hon, Y.Y., Spratlin, V., Jann, M.W., Pharmacokinetics
in Healthy Volunteers of Sumatriptan 25 mg Oral
Tablet Versus 25 mg Extemporaneous Supposi-
tory. International Journal of Pharmaceutical Compounding, 2008, 7 (6) : 481-484.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Artikel Penelitian
A Model of Rat Thrombocytopenia Induced by
Cyclophosphamide
Hery Kristiana1, Florensia Nailufar1, Imelda L. Winoto1, and
Raymond R. Tjandrawinata2
ABSTRACT: This study is aimed at optimizing the dose of cyclophosphamide
in thrombocytopenia rat model. A suitable drug dosage that could induce
thrombocytopenia in rat was then investigated. Animal model of 25 rats were
randomly divided into five groups: Normal (group A), Cyclophosphamide low
dose (group B), medium dose (group C), high dose (group D), very high dose
(group E) with each of 5 rats. The four dosage groups were given 25, 50, 100,
150 mg/kg BW cyclophosphamide, respectively. Cyclophosphamide was given
by subcutaneous injection once a day for 3 consecutive days. All groups were
under investigation for 8 days. The result suggested that a decrease in the
platelet count, white blood cell, and mean corpuscular volume of all group cyclophosphamide induced at the 7th day were significantly different than that of
Normal. The platelets count was reduced but fluctuated greatly, all of the rats
died in group E at 7th day and group D at 8th day. Though all 4 dosages successfully initiated thrombocytopenia as the platelets number dropped at the 7th
day, the low dose was considered to be a suitable one that was of high efficacy
and low toxicity. Thus, using Wistar rats challenged by subcutaneous injection of cyclophosphamide 25 mg/kg per day for 3 consecutive days showed
one simple, feasible and stable rat thrombocytopenia model that could be used
for pharmacodynamic test of the drugs which are supposed to have platelet
increasing effect.
Keywords: rat, thrombocytopenia, cyclophosphamide
1
2
Section of Animal Pharmacology
Dexa Laboratories of Biomolecular
Sciences, Dexa Medica, Cikarang
Korespondensi:
Raymond R. Tjandrawinata
Email : raymond@dexa-medica.com
ABSTRAK: Penelitian ini bertujuan untuk mengoptimalkan dosis siklofosfamid dalam model tikus trombositopenia. Sejumlah dosis obat yang cocok yang
bisa menyebabkan trombositopenia pada tikus kemudian diteliti. Dua puluh
lima tikus secara acak dibagi menjadi lima kelompok: Normal (grup A), siklofosfamid dosis rendah (grup B), dosis sedang (grup C), dosis tinggi (grup
D), dosis sangat tinggi (grup E) yang masing-masing terdiri dari 5 tikus. Keempat kelompok masing-masing diberi dosis 25, 50, 100, dan 150 mg/kg BB
cyclophosphamide. Siklofosfamid diberikan melalui suntikan subkutan sekali
sehari selama 3 hari berturut-turut. Semua kelompok diamati selama 8 hari.
Hasil penelitian menunjukkan bahwa penurunan jumlah trombosit, sel darah
putih, dan rata-rata volume corpuscular dari semua kelompok siklofosfamid pada hari ke-7 berbeda secara signifikan dibandingkan dengan Normal.
Platelet count berkurang meski sangat fluktuatif, semua tikus di grup E mati
pada hari ke-7 dan grup D pada hari ke-8. Meskipun keempat dosis berhasil
menginisiasi trombositopenia ditinjau dari jumlah trombosit yang menurun
pada hari ke-7, dosis yang rendah dianggap paling sesuai karena efektivitas
yang tinggi dan toksisitas rendah. Jadi, penggunaan tikus Wistar yang di
induksi oleh injeksi subkutan siklofosfamid 25 mg/kg per hari selama 3 hari
berturut-turut menunjukkan suatu model tikus trombositopenia yang sederhana, layak dan stabil yang dapat digunakan untuk uji farmakodinamik obat
yang diduga memiliki efek meningkatkan trombosit.
Kata kunci: tikus, trombositopenia, siklofosfamid
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
177
A Model 0f Rat Thrombocytopenia Induced by Cyclophosphamide
INTRODUCTION
Thrombocytopenia is a condition in which
blood has a lower than normal number of blood
cell fragments (platelets). Thrombocytopenia is
a blood disease characterized by an abnormally low number of platelets in the bloodstream.
Platelets are made in the bone marrow along with
other kinds of blood cells. Cyclophosphamide is a
synthetic alkylating agent that has been used for
its antineoplastic and immunosuppressive activities, and was introduced as an antitumor agent in
1958. Cyclophosphamide was used as toxicant in
the current study because of its capacity to induce
stable thrombocytopenia (1). In conventional chemotherapy, cyclophosphamide is one of the most
commonly employed drugs which are applied in
high dose regimen to treat metastatic breast cancer (2). Fulminant cardiac toxicity is the most severe dose-limited toxicity of cyclophosphamide
whose other side effects are hematopoietic depression, hemorrhagic cystitis, gonadal dysfunction, alopecia, nausea, gastrointestinal toxicity,
renal toxicity, antidiuretic effect and vomiting.
Also, it was reported that cyclophosphamide
could induce chromosome aberration of bone
marrow and liver cells (3). For reasons that are
poorly understood, patients with drug-induced
thrombocytopenia occasionally present with disseminated intravascular coagulation (4) or renal
failure and other findings indicative of the hemolytic uremic syndrome or thrombotic thrombocytopenic purpura (5). Cyclophosphamide induced
leucopenia animal model can also be the model
of thrombocytopenia (6). Therefore, we attemp
ted to use rats as a model of thrombocytopenia
following induction by cyclophosphamide. The
model is applicable for pharmacodynamic studi
es for drugs causing thrombocytopenia.
MATERIAL AND METHOD
Materials
Materials Cyclophosphamide was purchased
178
from Novell Pharmaceutical Laboratories, Bogor, Indonesia. Platelet count, erythrocyte, white
blood cell, platelet distribution width, and mean
corpuscular volume determined by semi-automated hematology analyzer MEK-6450K (Nihon
Kohden, Japan) and cell packs diluents (Nihon
Kohden, Japan) was provided by Dexa Laboratories of Biomolecular Sciences, Dexa Medica.
Animals
For all experiments, adult Wistar rats were
purchased from Indoanilab (Bogor, Indonesia).
The rat were kept in the cages at 24oC, <70% relative humidity, with alternating 12-h lightdark
cycle (lights on from 06.00 to 18.00 h). They were
kept in standard polypropylene filter top cage and
allowed access to food and water ad libitum. All
experiments were reviewed and approved by the
Institutional Animal Care and Use Committees of
the Dexa Laboratories of Biomolecular Sciences,
Dexa Medica (Cikarang, Indonesia).
Experimental protocols
Male Wistar rats (250-300g) were used for the
study. The rats were divided into 5 groups (n = 5,
each group), they are: Group A, as normal control,
were treated with normal saline; Group B were
treated with cyclophosphamide (25 mg/kg BW);
Group C were treated with cyclophosphamide
(50 mg/kg BW); Group D were treated with cyclophosphamide (100 mg/kg BW); and Group E
were treated with cyclophosphamide (150 mg/
kg BW) by subcutaneous injection once a day for
the first 3 consecutive days. All groups were investigated for 11 days. 100 l of blood was collected from tail every day (1 7th days of study).
Plasma collected using EDTA anticoagulant.
Platelet count, red blood cell, white blood cell,
platelet distribution width, and mean corpuscular volume were determined by semi-automated
hematology analyzer MEK-6450K. At the end of
the study period, the rats were euthanized with
sodium pentobarbital 150 mg/kg BW (IP) under
anesthesia (ketamine 80 mg/kg, and xylazine 7.5
mg/kg, i.p).
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Hery Kristiana, Florensia Nailufar, Imelda L. Winoto, and Raymond R. Tjandrawinata
Statistical analysis
The data obtained were analyzed using one
way analysis of variance (ANOVA) followed by
post hoc test for multiple comparisons (Tukeys
HSD or Games-Howell test), using the statistical
package SPSS version 20 for Windows. Differen
ces were considered significant when p<0.05.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
RESULTS
Platelet count
Blood cell analyses in comparison to all group;
Platelet count (Table 1); white blood cell (Table
2); platelet distribution width (Table 3), mean
corpuscular volume (Table 4); and red blood cell
(Table 5) did not change.
179
A Model 0f Rat Thrombocytopenia Induced by Cyclophosphamide
Body weight and survivability of animals
Figure 1 shows the weights of animal receiving varying doses of cyclophosphamide. It is seen
that at higher doses, rats tended to decrease in
their weight suggesting that the compound affected their over health status.
This data is further strengthened by the subsequent analysis of animal survivability follow-
180
ing cyclophosphamide administration. Figure 2
shows that at higher doses of 100 mg/kg and 150
mg/kg, rats were dying after 7 days of drug administration. However, at lower doses of 25 mg/
kg and 50 mg/kg, rats were able to survive even
to the end of experiment seen on day 11 post administration.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Hery Kristiana, Florensia Nailufar, Imelda L. Winoto, and Raymond R. Tjandrawinata
Figure 1. Weight changes of Wistar rats following administration of cyclophosphamide.
Values are presented as mean.
DISCUSSION
Since its discovery in 1958, cyclophosphamide
has been widely used in both clinical and experimental animal studies of cancer chemotherapy.
Acute events like bone-marrow toxicity, infections, haemorrhagic cystitis, gastrointestinal side
effects (nausea, vomiting) and hair loss were seen
as its side effects. Cyclophosphamide was used
as an inducer in the current study because of its
preliminary data suggesting its capacity as an inducer of stable thrombocytopenia (1)
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
The result suggested that decrease in the
platelet counts of group B, C, D, and D at 4th day
were significantly higher than those of the normal group.The platelet counts were reduced with
wide variations. In all groups, the maximum decrease in the platelet count was seen at the 7th
day. All rats in Group D (100 mg/kg) and Group
E (150 mg/kg) are haemorrhagic cystitis, porfirin, 20% body weight loss and hair loss at the 7th
day. It was clear that Groups D and E could reduce
platelet to some extent and the effect lasted for
a longer time, however, rats in these groups died
181
A Model 0f Rat Thrombocytopenia Induced by Cyclophosphamide
rapidly, while platelet counts were fluctuating at
a higher rate. It is widely known that chemothe
rapeutic and immunosuppressive agents typically cause thrombocytopenia by suppressing
hematopoiesis, in order to its effect as an immunosuppresor (7).
In Groups D and E, mean corpuscular volume
and white blood cell decreased sharply. Cyclophosphamide, a chemotherapy drug, also well
known as a potent immunosuppressive drug in
humans and experimental animals, can, in fact,
reduce white blood cells. The result of the white
blood cells count data was corelated with a previously reported result, suggesting that the drop
occurs in the beginning followed by a rise on its
counts (8). Moreover, in Group D and E, the width
of platelet distribution increased. Platelet distribution width is an indication of variation in platelet size which can be a sign of active platelet release. Platelet large cell ratio increases in thrombocytopenia, and is inversely related to platelet
count and directly related to platelet distribution
width and mean platelet volume (9).
The body weights of rat cyclophosphamide
treated group decreased after injecting cyclophosphamide (Figure 1). The weight of the Normal group rat tended to be stable after end pe
riods. Rat in group E death rate was 100% on the
7th day. Rat in group D died from the 7th day, the
death rate was 100% on the 8th day (Figure 2)
and other group life until the end period. Many
patients with drug-induced thrombocytopenia
have only petechial hemorrhages and occasional
ecchymosis and require no specific treatment
other than discontinuation of the sensitizing
medication. When there is uncertainty about the
causative drug, all medications should be discon-
REFERENCES
1. Hong N, Kong-yan L, Xiao-qi Z, Xue-ying F, Duan-
rong Y, Yu-si W, Jiu-yao Z, Wen-cai Y, Establishment
182
of a Mouse Thrombocytopenia Model Induced by
tinued, and pharmacologic equivalents with different chemical structures substituted as necessary. Patients who have severe thrombocytopenia
and wet purpura should be aggressively treated
with platelet transfusions because of the risk of
fatal intracranial or intrapulmonary hemorrhage
(10,11,12). Corticosteroids are often given, but
there is no evidence that they are helpful if the
thrombocytopenia is drug-induced. Intravenous
immune globulin (13) and plasma exchange(14)
have been used in acutely ill patients, but the be
nefit of these treatments is uncertain (10).
Though all four dosages successfully initiated
thrombocytopenia as the platelets count dropped
at the 7th day, the low dose (25 mg/kg BW) was
considered to be a suitable one that was of high
efficacy and low toxicity. Thus, Wistar rat challenged by subcutaneous injection of cyclophosphamide 25 mg/kg per day for 3 consecutive day
is one simple, feasible and stable rat thrombocytopenia model that could be used for pharmacodynamic test of drugs which pharmacologically
act as platelets count stimulator.
CONCLUSION
In conclusion, Wistar rat challenged by subcutaneous injection of cyclophosphamide 25 mg/kg
per day for 3 consecutive day is one simple, feasible and stable rat thrombocytopenia model.
ACKNOWLEDGEMENTS
The authors would like to thank to Destrina
Grace for her assistance in editing the manuscript.
Cyclophosphamide. Zoological research 2009;
30(6):645-652.
2. Legha SS, Buzdar AU, Smith TL, Hortobagyi GN,
Swenerton KD, Blumenschein GR, Gehan EA,
Bodey GP, Freireich EJ. Complete remissions in
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Hery Kristiana, Florensia Nailufar, Imelda L. Winoto, and Raymond R. Tjandrawinata
metastatic breast cancer treated with combi-
8. Masahiro K, Takuya K, Yoshio K, Hiroaki T, Kikuo
3. He WS, Liu AH, Shi LM. In vivo induction of chro-
administered a Japanese ethical herbal drug,
nation drug therapy [J]. Ann Intern Med, 1979,
91(6): 847-852.
mosomal aberration in liver, bone-marrow and
spermatogonial cells in mice by benzene and cy-
N, Takafumi Y. 1999. Accelerated recovery from
cyclophosphamide-induced leukopenia in mice
Hochu-ekki-to [J]. Immunopharmacology, 44(3):
223-231.
clophosphamide [J]. Zool Res, 1984, 5(2): 175-
9. Babu E, Basu D. 2004. Platelet large cell ratio in the
Quinine-induced disseminated intravascular co-
10. Aster R. Drug-induced thrombocytopenia. In:
5. Kojouri K, Vesely SK, George JN. Quinine associ-
11. Freiman JP. Fatal quinine-induced thrombocyto-
tures, and long-term outcomes. Ann Intern Med
monary hemorrhage in druginduced thrombocy-
179 (in Chinese).
4. Knower MT, Bowton DL, Owen J, Dunagan DP.
agulation: case report and review of the literature.
Intensive Care Med 2003;29:1007-11.
ated thrombotic thrombocytopenic purpurahemolytic uremic syndrome: frequency, clinical fea2001;135:1047-51.
6. Lu QJ. 2007. Methodology of New Drug Research
in Pharmacology [M]. Beijing: Chemical Industry
Press, 326 (in Chinese).
7. Curtis BR, Kaliszewski J, Marques MB, et al.
Immune-mediated
thrombocytopenia
result-
ing from sensitivity to oxaliplatin. Am J Hematol
2006;81:193-8.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
differential diagnosis of abnormal platelet counts
[J].Indian J Pathol Microbiol, 47(2): 202-205.
Michelson AD, ed. Platelets. New York: Academic
Press, 2007:887-902.
penia. Ann Intern Med 1990; 112:308-9.
12. Fireman Z, Yust I, Abramov AL. Lethal occult pultopenia. Chest 1981; 79:358-9.
13. Ray JB, Brereton WF, Nullet FR. Intravenous im-
mune globulin for the treatment of presumed
quinidine-induced thrombocytopenia. DICP 1990;
24:693-5.
14. Pourrat O. Treatment of drug-related diseases
by plasma exchanges. Ann Med Interne (Paris)
1994;145:357-60.
183
Petunjuk
Petunjuk Bagi Penulis
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
184
Jurnal Farmasi Indonesia menerima tulisan ilmiah berupa laporan hasil penelitian atau telaah pustaka yang berkaitan
dengan bidang kefarmasian.
Naskah diutamakan yang belum pernah diterbitkan di media lain, baik cetak maupun elektronik. Jika sudah pernah
disampaikan dalam suatu pertemuan ilmiah hendaknya diberi keterangan yang jelas mengenai nama, tempat, dan
tanggal berlangsungnya pertemuan tersebut.
Naskah ditulis dalam bahasa Indonesia baku atau bahasa Inggris dengan huruf Cambria 11, disusun dengan
sistematika sebagai mana yang disarankan di bawah ini.
Judul dalam dua bahasa Indonesia dan Inggris, ditulis dengan huruf kapital diikuti huruf kecil, bold, singkat dan jelas
mencerminkan isi tulisan, tidak lebih dari 14 kata (bahasa Indonesia) atau 10 kata (bahasa Inggris).
Nama penulis tanpa gelar, diberi nomor superscript, diikuti alamat instansinya masing-masing dan sebutkan alamat
korespondensi kepada penulis lengkap dengan alamat e-mail.
Abstrak dalam bahasa Inggris dan bahasa Indonesia, masing-masing maksimum 200 kata, dilengkapi dengan kata
kunci (Keywords) 3-5 kata.
Isi/Batang Tubuh:
a. Untuk tulisan berupa artikel hasil penelitian (research article), disusun dengan sistematika sebagai berikut:
Pendahuluan, Metodologi Penelitian (meliputi bahan, alat dan cara kerja), Hasil dan Pembahasan, Kesimpulan
dan Saran, serta ucapan terima kasih.
b. Untuk tulisan bukan berupa laporan hasil penelitian (tinjauan pustaka atau komunikasi singkat), disusun dengan
sistematika sebagai berikut: Pendahuluan, bagian-bagian sesuai topik tulisan, serta Penutup berupa kesimpulan
dan saran, serta ucapan terima kasih.
Daftar Pustaka ditulis berurutan dengan nomor arab (1, 2, 3, dst.), sesuai urutan kemunculannya dalam naskah,
ditulis secara konsisten menurut ketentuan dalam Cummulated Index Medicus dan/atau Uniform Requirements for
Manuscripts Submitted to Biomedical Journal (Ann Intern Med 1979; 90: 95-99).
Singkatan nama jurnal mengikuti ketentuan dalam Index Medicus; untuk nama jurnal yang tidak tercantum dalam
Index Medicus harap tidak disingkat.
1. Contoh: Cefalu WT, Padridge WM. Restrictive transport of a lipid-soluble peptide (cyclosporin) through the
blood-brain barrier. J Neurochem 1985; 45; 1954-1956.
Sitasi/rujukan kepustakaan dilakukan dengan sistem nomor yang diletakkan dalam tanda kurung.
2. Contoh: .........disusun oleh protein-protein membran, antara lain kadherin (5).
Cara penulisan:
a. Halaman judul diketik di awal naskah terdiri dari judul, nama penulis dan afiliasinya serta nama dan alamat
lengkap corresponding author.
b. Naskah diketik 1 spasi tidak bolak balik, ukuran kertas A4 dengan margin atas 4 cm, bawah 3 cm, kiri 4 cm, kanan
3 cm, minimum 8 halaman, maksimum 14 halaman tidak termasuk gambar/foto atau tabel.
c. Tabel harus utuh, jelas terbaca, dibuat dengan format tabel pada Microsoft Word diletakkan terpisah pada
halaman setelah daftar pustaka, diberi judul dan nomor tabel dengan angka arab 1, 2, 3... dst.
d. Gambar dibuat dengan format TIFF, JPG, JPEG, atau BMP, atau format Microsoft Excel/scatter plot untuk grafik,
dikirimkan tersendiri dalam file terpisah dengan keterangan yang jelas diberi nama file sesuai dengan nomor
urut gambar.
e. Judul gambar ditulis dalam format MS Word setelah halaman Tabel. Judul gambar dinomori dengan angka arab
(1,2,3,... dst).
Naskah dapat dikirim dalam bentuk cetakan (hard copy) dan berkas elektronik (dalam bentuk CD) melalui pos/
kurir atau diantar sendiri ke sekretariat jurnal. Berkas elektronik dapat dikirim melalui email ke alamat jfi@
ikatanapotekerindonesia.net atau jurnalfarmasiindonesia@gmail.com. Naskah dapat juga dikirimkan secara online
melalui jfi.iregway.com.
Naskah yang diterima akan disaring oleh Redaksi/Editor, kemudian direview oleh Mitra Bestari. Apabila diperlukan,
naskah akan diberi catatan dan dikembalikan kepada penulis untuk direvisi, untuk selanjutnya dikirimkan kembali
secara utuh kepada redaksi jurnal untuk diterbitkan.
Untuk penelitian klinis yang menggunakan subyek manusia, disertakan Ethical clearance.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
Instructions
Instructions for Authors
1. Jurnal Farmasi Indonesia received the scientific papers in the form of research article or literature review related to the
field of pharmacy.
2. Preferred manuscript is that the paper has never been published in other media, both printed and electronic. If it has
ever been presented in a scientific meeting, a clear explanation of the name, place and date of the meeting should be
given.
3. Manuscripts are written in standard Indonesian or English with Cambria 11, compiled by systematics as described
below.
4. The title is written in a capital letter followed by lowercase letters, bold, not more than 14 words (Indonesian) or 10
words (English), concise and clearly reflect the content of the manuscript.
5. The authors name should be written without title, given the superscript numbers, followed by the affiliation and specify
complete address of corresponding author by e-mail address.
6. Abstract should be written in English and Indonesian respectively , with a maximum of 200 words, equipped with 3-5
keywords.
7. Contents / Body:
a. A research article should compile by the systematics as follows: Introduction, Research Methodology (includes
materials, equipment, and methods), Results and Discussion, Conclusions and Recommendations, as well as
acknowledgement.
b. A literature review or short communication) should follow systematics as Introduction, the sections of sub topics,
and Conclusions and/ or Recommendations, as well as acknowledgement.
8. References are written sequentially with Arabic numbers (1, 2, 3, ..), in the order of it appearance in the manuscript. It
should be written consistently in accordance with the Index Medicus Cummulated and / or the Uniform Requirements
for Manuscripts Submitted to Biomedical Journal (Ann Intern Med 1979; 90: 95-99).
9. Journal abbreviations should follow the provisions in Index Medicus; For journal that are not listed in Index Medicus
should not be abbreviated.
Example: Cefalu WT, Padridge WM. Restrictive transport of a lipid-soluble peptide (cyclosporin) through
the blood-brain barrier. J Neurochem 1985; 45; 1954-1956.
10. Citation should be written with Arabic number and placed in brackets.
Example: ......... compiled by membrane proteins, among others kadherin (5).
11. Guidance for writing:
a. Typed the title page at the beginning of the script consists of title, authors name and affiliation as well as the name
and complete address of corresponding author.
b. Typed the manuscript in 1 spacing in A4 paper with a top margin of 4 cm, bottom 3 cm, left 4, and right 3 cm. The
manuscript may consist of minimum of 8 pages and maximum of 14 pages excluding images/pictures or tables.
c. Tables must be intact, clearly legible, in Microsoft Word format, placed separately on the page after the list of
references, given the title and number of tables with Arabic numbers (1, 2, 3 ...).
d. Images/Figures should be made with the format of TIFF, JPG, JPEG, or BMP, or Microsoft Excel format/scatter plot
for graphic, submit ted in a separate file with a clear description of the file named according to the number of
Figures.
e. Figure legends should be written in MS Word format after the page of tables. Figure legends are numbered with
Arabic numbers (1,2,3, ... ).
12. Manuscripts can be submitted in hard copy and electronic version (on CD) by post /courier or delivered to the
secretariat of the journal by hand. Electronic files can be sent via email to jfi@ikatanapotekerindonesia.net or
jurnalfarmasiindonesia@gmail.com. Manucripts can also be submitted online through jfi.iregway.com.
13. Manuscript received will be screened by the Editor, and then reviewed, the manuscripts may be returned to the author
and noted to be revised, and be sent back to the editor for decision of acceptance for publication.
14. For clinical research using human subjects should include Ethical clearance.
Jurnal Farmasi Indonesia n Vol. 6 No. 3 n Januari 2013
185
Anda mungkin juga menyukai
- Tanaman Pepohonan Pencegah & Penghalau Gelombang Tsunami Di Kawasan Pesisir Pantai Edisi Bahasa IndonesiaDari EverandTanaman Pepohonan Pencegah & Penghalau Gelombang Tsunami Di Kawasan Pesisir Pantai Edisi Bahasa IndonesiaPenilaian: 3.5 dari 5 bintang3.5/5 (3)
- Tumbuhan Herbal Yang Berkhasiat Mencegah Wabah Penyakit Edisi Bahasa Inggris 2021Dari EverandTumbuhan Herbal Yang Berkhasiat Mencegah Wabah Penyakit Edisi Bahasa Inggris 2021Belum ada peringkat
- JFI 6.3 IregwayDokumen122 halamanJFI 6.3 Iregwayرجب جبBelum ada peringkat
- 377-Article Text-618-1-10-20190902Dokumen5 halaman377-Article Text-618-1-10-20190902Sri KurniatyBelum ada peringkat
- Nadiyah Atikah Della PutriDokumen15 halamanNadiyah Atikah Della PutriEdo Wahyu PratamaBelum ada peringkat
- Uji Aktivitas Antioksidan Infusa Daun Ungu DenganDokumen9 halamanUji Aktivitas Antioksidan Infusa Daun Ungu Dengangayatri pradnya andiniBelum ada peringkat
- Buah Melinjo Dan Daun Sirsak Sebagai AntikankerDokumen4 halamanBuah Melinjo Dan Daun Sirsak Sebagai AntikankerAli Akbar PutraBelum ada peringkat
- Alim (1) +25 32 1Dokumen8 halamanAlim (1) +25 32 1RizkiBelum ada peringkat
- S53351-Freddy Hutama EkaputraDokumen19 halamanS53351-Freddy Hutama EkaputraDescarBelum ada peringkat
- 6 11 1 SMDokumen7 halaman6 11 1 SMParkerAllisonBelum ada peringkat
- 5961 12713 1 SMDokumen8 halaman5961 12713 1 SMIndah SubayirBelum ada peringkat
- Efek Penghambatan Radikal Bebas Infusa Dan EkstrakDokumen7 halamanEfek Penghambatan Radikal Bebas Infusa Dan EkstrakAfridhausmanBelum ada peringkat
- Aktivitas Antioksidan Ekstrak Etanol Biji Dan Daging BUAH PALA (Myristica Fragrans) DENGAN METODE DPPHDokumen6 halamanAktivitas Antioksidan Ekstrak Etanol Biji Dan Daging BUAH PALA (Myristica Fragrans) DENGAN METODE DPPHOktataa WNBelum ada peringkat
- 13 IJPNP Maret 2023Dokumen10 halaman13 IJPNP Maret 2023VelsaMarellaBelum ada peringkat
- 150-Article Text-253-1-10-20170403Dokumen19 halaman150-Article Text-253-1-10-20170403NABILA MADYA MANDABelum ada peringkat
- Formulasi Dan Uji Aktivitas Antioksidan 23f23d89Dokumen13 halamanFormulasi Dan Uji Aktivitas Antioksidan 23f23d89Suci PurwaningsihBelum ada peringkat
- ANTIOKSIDAN DAN SITOTOKSIKDokumen10 halamanANTIOKSIDAN DAN SITOTOKSIKSrihrtnBelum ada peringkat
- 25-Article Text-128-6-10-20220418Dokumen8 halaman25-Article Text-128-6-10-20220418Haikal SaputraBelum ada peringkat
- 130-Article Text-1203-1-10-20220702Dokumen8 halaman130-Article Text-1203-1-10-20220702Hardiyanti GoroBelum ada peringkat
- 29-Article Text-139-1-10-20210412Dokumen7 halaman29-Article Text-139-1-10-20210412Sis WatiBelum ada peringkat
- 203-Article Text-1733-1-10-20191028Dokumen9 halaman203-Article Text-1733-1-10-20191028Putri ElisaBelum ada peringkat
- WahahaDokumen7 halamanWahahaDinan Af'idah AnasBelum ada peringkat
- Jurnal Kulit Semangka PDFDokumen10 halamanJurnal Kulit Semangka PDFRizqi Himathu FuadhahBelum ada peringkat
- JPA+Vol+11+No+2+April+2023+ (6) +melanieDokumen7 halamanJPA+Vol+11+No+2+April+2023+ (6) +melanietifahhiban21Belum ada peringkat
- 04.formulasi Pewarna Rambut Dari Biji Pepaya Carica Papaya L. Dalam BentukDokumen7 halaman04.formulasi Pewarna Rambut Dari Biji Pepaya Carica Papaya L. Dalam BentukVieviepunya'esayonggRudii SakmampuseBelum ada peringkat
- Daktivitas Antioksidan Ekstrak N-Heksan, Etil Asetat, Dan Metanol Daun Dewandaru - Martiani 2017Dokumen9 halamanDaktivitas Antioksidan Ekstrak N-Heksan, Etil Asetat, Dan Metanol Daun Dewandaru - Martiani 2017Ismedsyah SyahBelum ada peringkat
- Formulasi Dan Uji Aktivitas Antioksidan Ekstrak Daun Matoa (PometiaDokumen7 halamanFormulasi Dan Uji Aktivitas Antioksidan Ekstrak Daun Matoa (PometiaArya AsmaraBelum ada peringkat
- Uji Aktivitas Antioksidan Krim Ekstrak Daun ManggaDokumen8 halamanUji Aktivitas Antioksidan Krim Ekstrak Daun ManggaAnditapitalokaBelum ada peringkat
- EFEKTIFKRIMDokumen11 halamanEFEKTIFKRIMsitiBelum ada peringkat
- Resume Guest LecturerDokumen5 halamanResume Guest LecturerNafisahBelum ada peringkat
- 1372-Article Text-4780-1-10-20220905Dokumen11 halaman1372-Article Text-4780-1-10-20220905herda lianaBelum ada peringkat
- 16 3 2005 Abdul - 3Dokumen8 halaman16 3 2005 Abdul - 3Serley WulandariBelum ada peringkat
- Manuskrip Gina HanifahDokumen17 halamanManuskrip Gina HanifahSITI YURIAHBelum ada peringkat
- Antioksidan SemangkaDokumen64 halamanAntioksidan SemangkaSri marianiBelum ada peringkat
- Universitas Sumatera UtaraDokumen84 halamanUniversitas Sumatera UtaraRuth NainggolanBelum ada peringkat
- Uji Aktivitas Antioksidan DPPH Fraksi - BendraDokumen82 halamanUji Aktivitas Antioksidan DPPH Fraksi - BendraDilla NovitaBelum ada peringkat
- 012 - Alvyolian ManangsangDokumen15 halaman012 - Alvyolian ManangsangAlvyolianBelum ada peringkat
- ANTIOKSIDANDokumen9 halamanANTIOKSIDANSiti ImasitaBelum ada peringkat
- Jurnal+Lentera+Farma+02.01 08-14+Dian+PratiwiDokumen7 halamanJurnal+Lentera+Farma+02.01 08-14+Dian+Pratiwifelisthaanastasya01Belum ada peringkat
- 9933 42772 1 PBDokumen10 halaman9933 42772 1 PB9147Indah WulandariBelum ada peringkat
- Ekstrak Kulit Manggis BubukDokumen7 halamanEkstrak Kulit Manggis BubukWahyu EnyBelum ada peringkat
- Amalia Putri Salsabila - Sekolah Tinggi Analis Bakti Asih - PKM-A..Dokumen19 halamanAmalia Putri Salsabila - Sekolah Tinggi Analis Bakti Asih - PKM-A..Ferdi FitrianoBelum ada peringkat
- Antibakteri Daun SukunDokumen11 halamanAntibakteri Daun Sukunayu50% (2)
- MENINGKATKAN KESEHATAN LANSIADokumen8 halamanMENINGKATKAN KESEHATAN LANSIAJohan TiraBelum ada peringkat
- 1 SMDokumen5 halaman1 SMAriSuandiBelum ada peringkat
- ANTIOKSIDAN PEGAGANDokumen6 halamanANTIOKSIDAN PEGAGANRila Vita SariBelum ada peringkat
- Annonae Reticulae FoliumDokumen11 halamanAnnonae Reticulae Foliumdessy permatasari juan100% (1)
- Jurnal Daun MintDokumen4 halamanJurnal Daun MintAulia NurrizqiBelum ada peringkat
- Skrining Fitokimia Ekstrak Etanol Daun Kersen (Muntingia Calabura)Dokumen5 halamanSkrining Fitokimia Ekstrak Etanol Daun Kersen (Muntingia Calabura)marie j.choleBelum ada peringkat
- Analisis Senyawa Metabolit Sekunder dari Ekstrak Metanol Daun SurianDokumen5 halamanAnalisis Senyawa Metabolit Sekunder dari Ekstrak Metanol Daun SurianSultan HSBBelum ada peringkat
- Ipi 62982Dokumen4 halamanIpi 62982EGi ButzBelum ada peringkat
- Bab IiDokumen7 halamanBab IiLim MunBelum ada peringkat
- 3945-Article Text-16843-1-10-20210807Dokumen8 halaman3945-Article Text-16843-1-10-20210807GITA KHOIROH MARUAHBelum ada peringkat
- NoneDokumen8 halamanNoneNia MarzaBelum ada peringkat
- Analisis Senyawa Metabolit Sekunder Dari EkstrakDokumen5 halamanAnalisis Senyawa Metabolit Sekunder Dari Ekstrakfitria lavitaBelum ada peringkat
- HERBA CIPLUKANDokumen23 halamanHERBA CIPLUKANWigeSudirman67% (3)
- Journal Mata Kuliah NutrasetikaDokumen9 halamanJournal Mata Kuliah NutrasetikaBaekhyunBelum ada peringkat
- Bab I, II, III FixxDokumen115 halamanBab I, II, III FixxMuhammadSyifaBelum ada peringkat
- Tugas Mandiri Tanaman ObatDokumen8 halamanTugas Mandiri Tanaman ObatMuhammad Ibnu Abdi BrataBelum ada peringkat
- Buah Dan Tanaman Herbal Yang Berkhasiat Untuk Menghilangkan Stress Depresi Edisi BilingualDari EverandBuah Dan Tanaman Herbal Yang Berkhasiat Untuk Menghilangkan Stress Depresi Edisi BilingualBelum ada peringkat
- TERAPIINHALASIASMABRONKIALDokumen6 halamanTERAPIINHALASIASMABRONKIALDeejay Ruth PakpahanBelum ada peringkat
- Obat Tetes HidungDokumen13 halamanObat Tetes HidungYeni Adhaningrum100% (1)
- Penggunaan AntiplateletDokumen7 halamanPenggunaan AntiplateletLissa AlhabsyiBelum ada peringkat
- BISOPROLOLDokumen4 halamanBISOPROLOLYeni AdhaningrumBelum ada peringkat
- Pedoman Teknis Fasilitas RS Kelas C-CompleteDokumen95 halamanPedoman Teknis Fasilitas RS Kelas C-CompleteYasir MaulanaBelum ada peringkat
- AmlodipineDokumen2 halamanAmlodipineQaffah Silma AzasBelum ada peringkat
- Koroner Akut Infarkmiokard Obat HosppharmDokumen7 halamanKoroner Akut Infarkmiokard Obat HosppharmDimas YuliarBelum ada peringkat
- Buku Pedoman FarmakoekonomiDokumen96 halamanBuku Pedoman FarmakoekonomiDa ChanBelum ada peringkat
- Hipertensi JantungDokumen11 halamanHipertensi JantungYeni AdhaningrumBelum ada peringkat
- 29 - 184kombinasiclopidogrel AtorvastatinDokumen1 halaman29 - 184kombinasiclopidogrel AtorvastatinYeni AdhaningrumBelum ada peringkat
- OPTIMALKAN BATU GINJALDokumen20 halamanOPTIMALKAN BATU GINJALKengGo Kiromi IwasakiBelum ada peringkat
- 584 634 1 PBDokumen5 halaman584 634 1 PBcentikaselvianaBelum ada peringkat
- Tukak PeptikDokumen12 halamanTukak PeptikMohammed Ramzy GhifariBelum ada peringkat
- DIAGNOSADokumen85 halamanDIAGNOSAMohammad Izza Naufal FikriBelum ada peringkat
- DIAGNOSADokumen85 halamanDIAGNOSAMohammad Izza Naufal FikriBelum ada peringkat
- Tukak PeptikDokumen12 halamanTukak PeptikMohammed Ramzy GhifariBelum ada peringkat
- Gangguan Saluran CernaDokumen13 halamanGangguan Saluran CernaYeni Adhaningrum100% (1)
- Tukak PeptikDokumen12 halamanTukak PeptikMohammed Ramzy GhifariBelum ada peringkat
- Soal UKAIDokumen22 halamanSoal UKAIYeni AdhaningrumBelum ada peringkat
- PC InfeksiDokumen86 halamanPC InfeksiSukeng TeazzBelum ada peringkat
- KELAINAN KROMOSOMDokumen18 halamanKELAINAN KROMOSOMYeni AdhaningrumBelum ada peringkat
- JFI (Jurnal Farmasi Indonesia)Dokumen69 halamanJFI (Jurnal Farmasi Indonesia)Yeni Adhaningrum100% (9)
- IndonesiaMDG BI CoverDokumen14 halamanIndonesiaMDG BI CoverYeni AdhaningrumBelum ada peringkat
- PC InfeksiDokumen86 halamanPC InfeksiSukeng TeazzBelum ada peringkat
- MataDokumen28 halamanMataYeni AdhaningrumBelum ada peringkat
- Makalah FitomedisinDokumen29 halamanMakalah FitomedisinYeni AdhaningrumBelum ada peringkat
- Regulasi Lac OperonDokumen4 halamanRegulasi Lac OperonokutairieBelum ada peringkat
- FLAVONOIDDokumen35 halamanFLAVONOIDYeni Adhaningrum100% (1)
- Tugas FisTum Respirasi GlikolisisDokumen12 halamanTugas FisTum Respirasi GlikolisisYeni AdhaningrumBelum ada peringkat