Entropi Adalah Salah Satu Besaran Termodinamika Yang Mengukur Energi
Diunggah oleh
MarisImanJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Entropi Adalah Salah Satu Besaran Termodinamika Yang Mengukur Energi
Diunggah oleh
MarisImanHak Cipta:
Format Tersedia
1.
Entropi adalah salah satu besaran termodinamika yang mengukur energi dalam sistem
per satuan temperatur yang tak dapat digunakan untuk melakukan usaha. Mungkin
manifestasi yang paling umum dari entropi adalah (mengikuti hukum termodinamika),
entropi dari sebuah sistem tertutup selalu naik dan pada kondisi transfer panas, energi
panas berpindah dari komponen yang bersuhu lebih tinggi ke komponen yang bersuhu
lebih rendah.
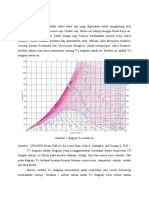
2. Diagram dengan salah satu sumbu koordinat berupa entropi yang sering digunakan
adalah diagram temperatur-entropi (T-s) dan diagram entalpi-entropi (h-s).
a. Diagram T-s
Bentuk umum dari diagram entropi dapat dilihat pada Gambar 1. Pada daerah uap panas
lanjut, garis-garis volume spesifik konstan, kemiringannya lebih curam dari garis-garis
tekanan konstan. Garis-garis kualitas tetap ditunjukkan dalam daerah dua fase cair-uap.
Pada beberapa gambar, garis kualitas uap tetap ditandai sebagai garis-garis persen uap
yang merupakan rasio massa cairan dengan massa total.Pada daerah uap panas lanjut
dalam diagram T-s, garis-garis entalpi spesifik konstan hampir membentuk garis lurus
pada saat tekanan berkurang. Keadaan ini ditunjukkan pada daerah terarsir pada
Gambar 1. Untuk keadaan pada daerah ini, entropi ditentukan hanya dengan temperatur.
Variasi tekanan antarabeberapa keadaan tidak berpengaruh besar.
b. Diagram h-s
Diagram entalpi-entropi ini disebut juga dengan diagram Mollier, seperti tampak pada
Gambar 2. Garis-garis kualitas konstan ditunjukkan pada daerah campuran dua fase
cair-uap. Grafik ini digunakan untuk mendapatkan nilai sifat pada keadaan uap panas
lanjutdan untuk campuran dua fase cair-uap. Data cairan umumnya jarang tersedia.
Pada dareah uap panas lanjut, garis temperatur konstan mendekati horizontal pada saat
tekanan berkurang yang ditunjukkan pada daerah terarsir pada Gambar 2 (Moran dan
Shapiro, 2006).
3. Tsistem = 110 + 273 = 383K
Msistem = 0.5 kg
Tlingkungan = 25 + 273 = 298K
Dari tabel uap diperoleh = > sf = 6,0480 kj/kgK; hfg = 2230 kj/K
∆Ssistem= -m.Sf = -0.5 x 6,0480 = -4,546 Kj/K
Kalor yg diberikan ke lingkungan (Q) =
Q = m.hfg = 0.5x 2230 = 1115 kJ
𝑄 1115
∆Slingkungn= = = 3,4716 1kj
𝑇𝑙𝑛𝑘𝑢𝑛𝑔𝑎𝑛 298
∆Snetto = ∆Ssistem + ∆Slingkungn
= -4,546 + 3,4716
= 1,0744 Kj/Kelvin
Anda mungkin juga menyukai
- Makalah EntropiDokumen22 halamanMakalah EntropiEkanisa Tri Lestari75% (4)
- C-170405187-Andre Kusady-D TERMODINAMIKADokumen4 halamanC-170405187-Andre Kusady-D TERMODINAMIKAAndre KusadyBelum ada peringkat
- Kimia AnalitikDokumen3 halamanKimia AnalitikElfa NofiaBelum ada peringkat
- Materi Termodinamika Pertemuan 11 & 12Dokumen18 halamanMateri Termodinamika Pertemuan 11 & 12anakkenkobohBelum ada peringkat
- FTX 01.dasar Humidifikasi, Pengukuran, Dan Adiabatic CLDokumen30 halamanFTX 01.dasar Humidifikasi, Pengukuran, Dan Adiabatic CLLembar Firdillah KurniawanBelum ada peringkat
- Ring KasanDokumen7 halamanRing KasanAzron AzimaBelum ada peringkat
- Bab 3Dokumen25 halamanBab 3Tari TarisahBelum ada peringkat
- Kesetimbangan Fasa 1Dokumen26 halamanKesetimbangan Fasa 1ShalowBelum ada peringkat
- Siklus RankineDokumen4 halamanSiklus Rankinehina raya100% (1)
- Neraca Energi Menggunakan Data Termodinamika TabularDokumen4 halamanNeraca Energi Menggunakan Data Termodinamika TabularIdo Aprilian TariganBelum ada peringkat
- 0 Bahan 6 Kuliah Pe DaringDokumen44 halaman0 Bahan 6 Kuliah Pe Daringmutiara eva syehrinaBelum ada peringkat
- Cara Kerja Diagram MollierDokumen9 halamanCara Kerja Diagram MollierRoberto AbimanyuBelum ada peringkat
- Modul 4 SPT1 Siklus Rankine, Tabel UapDokumen30 halamanModul 4 SPT1 Siklus Rankine, Tabel UapBANTUAN LOGIN100% (1)
- Thermo Dina MikaDokumen16 halamanThermo Dina MikakarlobrondialBelum ada peringkat
- Mengganti DH Dengan CPDT Dan Du Oleh CVDT Dan Membagi Ungkapan Yang DihasilkanDokumen12 halamanMengganti DH Dengan CPDT Dan Du Oleh CVDT Dan Membagi Ungkapan Yang DihasilkanYoga PrasetyoBelum ada peringkat
- LTM 4 Perpindahan KalorDokumen8 halamanLTM 4 Perpindahan KalorAmeninta CesaninaBelum ada peringkat
- EntropiDokumen36 halamanEntropimelanBelum ada peringkat
- 5147S1TMME21022018 - Perpindahan Panas Dasar - Pertemuan 12 - Materi TambahanDokumen11 halaman5147S1TMME21022018 - Perpindahan Panas Dasar - Pertemuan 12 - Materi TambahanMuhammad Rizqi StoryBelum ada peringkat
- Modul IiiDokumen7 halamanModul IiiMuhammad Raihan BalfasBelum ada peringkat
- Sifat Zat MurniDokumen9 halamanSifat Zat Murnisunaryo unsiqBelum ada peringkat
- BAB 3. Evaluasi SifatDokumen13 halamanBAB 3. Evaluasi SifatAris Tri Ika R100% (1)
- Perpindahan Kalor - Konduksi LTM 2Dokumen7 halamanPerpindahan Kalor - Konduksi LTM 2ayokitabisaBelum ada peringkat
- Ramdan Prianto - Konduksi Stabil MultidimensiDokumen15 halamanRamdan Prianto - Konduksi Stabil Multidimensilaode irfanBelum ada peringkat
- Siklus RankineDokumen19 halamanSiklus RankineAlexanderTassya100% (1)
- Bab VI EntropiDokumen4 halamanBab VI EntropiJoel Bastanta TambarMalemBelum ada peringkat
- Perhitungan Perubahan EntalpiDokumen27 halamanPerhitungan Perubahan Entalpinabila auliabalqisBelum ada peringkat
- Bab II SuhuDokumen5 halamanBab II SuhuJev N. HilgaBelum ada peringkat
- Diagram MollierDokumen20 halamanDiagram MollierMuhamad Akrom raihanBelum ada peringkat
- Bab IDokumen41 halamanBab IRin-rin LoveLy RinahBelum ada peringkat
- Bab 1 TermodinamikaDokumen43 halamanBab 1 TermodinamikaYaumil Khairin SeptianiBelum ada peringkat
- Thermo 2 CicaDokumen17 halamanThermo 2 CicaNur AzisahBelum ada peringkat
- Siklus RankineDokumen23 halamanSiklus RankineZainal Arifin BGBelum ada peringkat
- Pengukuran SuhuDokumen28 halamanPengukuran SuhuNabila KhoirunnisaBelum ada peringkat
- PsikopatDokumen16 halamanPsikopatDaniel Dan IrfanBelum ada peringkat
- Nama: Cintia Fitriani Rumapea NIM:4183331004 Kelas: Kimia Dik A 2018 Tugas Pertemuan 11 Kinetika Dan KesetimbanganDokumen5 halamanNama: Cintia Fitriani Rumapea NIM:4183331004 Kelas: Kimia Dik A 2018 Tugas Pertemuan 11 Kinetika Dan KesetimbanganCessyaBelum ada peringkat
- Termodinamika Sifat Uap AirDokumen9 halamanTermodinamika Sifat Uap Airraden_aditiya39100% (1)
- Treybal, Robert E. (1) - Bab Vii. Operasi Humidifikasi - Kurva Tekanan Uap - MZDokumen19 halamanTreybal, Robert E. (1) - Bab Vii. Operasi Humidifikasi - Kurva Tekanan Uap - MZamaliaBelum ada peringkat
- 7.neraca Energi Tanpa Reaksi Kimia 3Dokumen21 halaman7.neraca Energi Tanpa Reaksi Kimia 3tarara425100% (2)
- Makalah EntropiDokumen9 halamanMakalah EntropiErlin Kety SiregarBelum ada peringkat
- 3 - Campuran Gas-Uap Dan Pengkondisian UdaraDokumen11 halaman3 - Campuran Gas-Uap Dan Pengkondisian UdaraAgung AlamandaBelum ada peringkat
- TermodinamikaDokumen6 halamanTermodinamikaZibNa SyafaatBelum ada peringkat
- Materi 10Dokumen9 halamanMateri 10Danang TriajiBelum ada peringkat
- Fungsi Alih Thermal SystemsDokumen9 halamanFungsi Alih Thermal SystemsRayya Aela YumnaBelum ada peringkat
- Makalah EntropiDokumen28 halamanMakalah EntropiHafiz Al BajiriBelum ada peringkat
- Chapter III-V PDFDokumen23 halamanChapter III-V PDFArief MunandarBelum ada peringkat
- Bab VI EntropiDokumen4 halamanBab VI EntropiMarioMartinTambunanBelum ada peringkat
- Perubahan EntalpiDokumen16 halamanPerubahan EntalpiIir MnemonisBelum ada peringkat
- BAB 2 Termodinamika NeDokumen54 halamanBAB 2 Termodinamika NeMushaddiq Saleh100% (1)
- Diagram EntropiDokumen4 halamanDiagram EntropiLee Eno ChanBelum ada peringkat
- ContentDokumen48 halamanContentdudi ariyadiBelum ada peringkat
- Pembacaan Tabel UapDokumen20 halamanPembacaan Tabel UapDavid Gozali100% (1)
- Sistem Tenaga Gas FixDokumen45 halamanSistem Tenaga Gas FixSeppy FajrianiBelum ada peringkat
- ENTROPIDokumen9 halamanENTROPIJoe NedBelum ada peringkat
- ENTROPIDokumen14 halamanENTROPITeknik Kimia Unwahas100% (1)
- Bab 2 Teori KompresiDokumen57 halamanBab 2 Teori KompresiFelly AntaBelum ada peringkat
- BAB-III Analysis Alat Penukar Kalor PDFDokumen13 halamanBAB-III Analysis Alat Penukar Kalor PDFRonald Febrianto KarosekaliBelum ada peringkat
- Tugas Akhir Pertemuan Ke 3 (AutoRecovered)Dokumen4 halamanTugas Akhir Pertemuan Ke 3 (AutoRecovered)MarisImanBelum ada peringkat
- TB2 - Iman Maris - 41320110092Dokumen6 halamanTB2 - Iman Maris - 41320110092MarisImanBelum ada peringkat
- Turnitin3 TA Iman Maris 41320110092Dokumen26 halamanTurnitin3 TA Iman Maris 41320110092MarisImanBelum ada peringkat
- UntitledDokumen1 halamanUntitledMarisImanBelum ada peringkat
- Forum 3 Teknik PemipaanDokumen2 halamanForum 3 Teknik PemipaanMarisImanBelum ada peringkat
- 559 Iman MarisDokumen1 halaman559 Iman MarisMarisImanBelum ada peringkat
- Modul Ke-01 Dasar-Dasar Teknik Pemipaan, Prinsip Perancangan System Pemipaan - Macam - Macam Pipa. - Standar DiameterDokumen34 halamanModul Ke-01 Dasar-Dasar Teknik Pemipaan, Prinsip Perancangan System Pemipaan - Macam - Macam Pipa. - Standar DiameterMarisImanBelum ada peringkat
- Seller Dashboard TokopediaDokumen1 halamanSeller Dashboard TokopediaMarisImanBelum ada peringkat
- FORUMDokumen2 halamanFORUMMarisImanBelum ada peringkat
- TB1 - Iman Maris - 41320110092Dokumen9 halamanTB1 - Iman Maris - 41320110092MarisImanBelum ada peringkat
- Book 1Dokumen6 halamanBook 1MarisImanBelum ada peringkat
- Tugas 02 Bahan Bakar Dan Teknik PembakaranDokumen19 halamanTugas 02 Bahan Bakar Dan Teknik PembakaranMarisImanBelum ada peringkat
- Tugas03 - Iman Maris - 41320110092Dokumen7 halamanTugas03 - Iman Maris - 41320110092MarisImanBelum ada peringkat
- Tugas2 - Iman MarisDokumen5 halamanTugas2 - Iman MarisMarisImanBelum ada peringkat
- Tugas Besar 1Dokumen6 halamanTugas Besar 1MarisImanBelum ada peringkat
- Teknik Pendingin 1Dokumen10 halamanTeknik Pendingin 1MarisImanBelum ada peringkat
- PERAWATAN MAINTENANCE BOILER TugasDokumen21 halamanPERAWATAN MAINTENANCE BOILER TugasMarisImanBelum ada peringkat
- Konversi Energi Tugas Temu2Dokumen3 halamanKonversi Energi Tugas Temu2MarisImanBelum ada peringkat
- Tugas Besar 2 Metode Penelitian (Iman)Dokumen34 halamanTugas Besar 2 Metode Penelitian (Iman)MarisImanBelum ada peringkat
- Surat KonfirmasiDokumen2 halamanSurat KonfirmasiMarisImanBelum ada peringkat
- Berikan Penjelasan Dan Pandangan Anda Tentang Sistem Pengkondisian Udara Atau ACDokumen2 halamanBerikan Penjelasan Dan Pandangan Anda Tentang Sistem Pengkondisian Udara Atau ACMarisImanBelum ada peringkat
- Tugas 1Dokumen2 halamanTugas 1MarisImanBelum ada peringkat