Tugas Kkob Uji Klinik
Tugas Kkob Uji Klinik
Diunggah oleh
Anggraita PratiwiJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Tugas Kkob Uji Klinik
Tugas Kkob Uji Klinik
Diunggah oleh
Anggraita PratiwiHak Cipta:
Format Tersedia
ANGGRAITA DAPP 1704015338
TUGAS DAN KEWENANGAN PELAKU UJI KLINIK MENURUT :
PERATURAN KEPALA BADAN PENGAWAS OBAT DAN MAKANAN REPUBLIK
INDONESIA
NOMOR 21 TAHUN 2015
TENTANG TATA LAKSANA PERSETUJUAN UJI KLINIK
Menurut Bab I Pasal I
1. Sponsor adalah perorangan, perusahaan, institusi atau organisasi yang
bertanggung jawab untuk memprakarsai, mengelola, dan/atau membiayai suatu Uji
Klinik.
2. Organisasi Riset Kontrak, yang selanjutnya disingkat ORK, adalah seseorang atau
suatu organisasi (komersial atau lainnya) yang dikontrak oleh sponsor untuk
melaksanakan satu atau lebih tugas dan fungsi sponsor dalam Uji Klinik.
3. Inspeksi Cara Uji Klinik yang Baik, yang selanjutnya disebut Inspeksi CUKB, adalah
tindakan regulator/Badan Pengawas Obat dan Makanan untuk melaksanakan suatu
pemeriksaan resmi terhadap dokumen, fasilitas, rekaman dan sumber lain yang
dianggap oleh otoritas regulatori ada hubungannya dengan Uji Klinik (termasuk uji
bioekivalensi), di Sentra Uji Klinik, Sponsor dan/atau di ORK, dan/atau di tempat lain
yang berhubungan dengan pelaksanaan Uji Klinik dimaksud.
4. Subjek Uji Klinik adalah individu yang ikut serta dalam Uji Klinik yang memiliki hak
dan kewajiban saat keikutsertaannya dalam Uji Klinik.
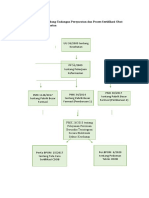
BAB III PENGAJUAN PERSETUJUAN UJI KLINIK
Bagian Pertama Pengajuan Persetujuan Uji Klinik Prapemasaran Pasal 9 (1)
Pengajuan persetujuan Uji Klinik Prapemasaran dilakukan secara tertulis oleh
Sponsor atau ORK kepada Kepala Badan.
Bagian Kedua Penyampaian Notifikasi Uji Klinik Pascapemasaran Pasal 10 (1)
Penyampaian notifikasi Uji Klinik Pascapemasaran dilakukan secara tertulis oleh
Sponsor atau ORK kepada Kepala Badan.
Bagian Keempat Masa berlaku Pasal 16 (1) Persetujuan sebagaimana dimaksud
dalam Pasal 14 ayat (1) huruf a berlaku selama 2 (dua) tahun sejak tanggal
diterbitkan. (2) Dalam hal pelaksanaan Uji Klinik melebihi masa persetujuan yang
diberikan sebagaimana dimaksud pada ayat (1), Sponsor atau ORK harus mengajukan
permohonan perpanjangan persetujuan kepada Kepala Badan.
BAB V PRODUK UJI
Pasal 18 (1) Produk Uji yang akan digunakan dalam Uji Klinik harus memiliki data
keamanan awal dan persyaratan mutu sesuai dengan tahapan uji kliniknya. (2)
Dalam hal diperlukan pemasukan Produk Uji sebagaimana dimaksud pada ayat (1) ke
dalam wilayah Indonesia, sponsor harus mendapatkan persetujuan dari Kepala
Badan. (3) Pengajuan pemasukan Produk Uji sebagaimana dimaksud pada ayat (2)
dilakukan secara tertulis bersamaan dengan pengajuan persetujuan Uji Klinik. (4)
Persetujuan sebagaimana dimaksud pada ayat (2) diterbitkan bersamaan dengan
persetujuan pelaksanaan Uji Klinik, dengan menggunakan format persetujuan
pemasukan sebagaimana tercantum dalam Lampiran IV yang merupakan bagian
tidak terpisahkan dari Peraturan ini.
BAB VI PENANGGUHAN ATAU PENGHENTIAN UJI KLINIK
Pasal 20 Kepala Badan dapat memerintahkan pihak Sponsor Uji Klinik untuk
menangguhkan atau menghentikan Uji Klinik yang sedang berlangsung jika: a. Terjadi
masalah keamanan Uji Klinik dan setelah berkonsultasi dengan ahli uji klinik;
dan/atau b. Uji Klinik dilaksanakan tanpa persetujuan Komisi Etik.
BAB VII PELAPORAN UJI KLINIK Bagian Pertama Kejadian Tidak Diinginkan Serius dan
Efek Samping Produk Uji yang Serius Pasal 21 (1) Peneliti Utama wajib melaporkan
seluruh KTDS dalam Uji Klinik di Indonesia kepada: a. Sponsor; dan b. Komisi Etik.
Pasal 22 (1) Sponsor wajib melaporkan Efek Samping Produk Uji yang Serius dari Uji
Klinik di Indonesia kepada Kepala Badan.
Pasal 23 (1) Sponsor wajib melaporkan Efek Samping Produk Uji yang Serius dan
tidak diduga (Unexpected Serious Adverse Drug Reaction) dari Uji Klinik di negara
lain yang melibatkan Sentra Uji Klinik di Indonesia kepada Komisi Etik dan Kepala
Badan.
Pasal 24 (1) Sponsor wajib melaporkan perkembangan pelaksanaan Uji Klinik yang
dilakukan kepada Kepala Badan: a. setiap 6 (enam) bulan; b. saat berakhirnya
pelaksanaan Uji Klinik; dan/atau c. jika terjadi penghentian pelaksanaan Uji Klinik
sebelum waktunya dengan menjelaskan alasannya
BAB VIII PERUBAHAN DOKUMEN
Pasal 25 (1) Sponsor wajib menyerahkan dokumen Uji Klinik yang mengalami
perubahan.
Anda mungkin juga menyukai
- Cara Uji Klinik Alat Kesehatan Yang Baik - Feb20Dokumen30 halamanCara Uji Klinik Alat Kesehatan Yang Baik - Feb20ig iaibekasikabBelum ada peringkat
- Tugas PMKDokumen25 halamanTugas PMKWildan Irvan ZulyadiBelum ada peringkat
- KEP KBPOM - NO.02002 - SK - KBPOM TAHUN 2001 - Tentang TATA LAKSANA UJI - 2001 PDFDokumen19 halamanKEP KBPOM - NO.02002 - SK - KBPOM TAHUN 2001 - Tentang TATA LAKSANA UJI - 2001 PDFAgustinus M SilabanBelum ada peringkat
- Regulasi Uji KlinikDokumen37 halamanRegulasi Uji KlinikNancy PongsibidangBelum ada peringkat
- Persetujuan Pelaksanaan Uji Klinik - Elin Novia SDokumen20 halamanPersetujuan Pelaksanaan Uji Klinik - Elin Novia SdellaBelum ada peringkat
- Regarding Clinical Trial Procedure, 28-Feb-2001Dokumen46 halamanRegarding Clinical Trial Procedure, 28-Feb-2001Dedi PurnomoBelum ada peringkat
- 03 CUKB 1 Isi PengantarDokumen28 halaman03 CUKB 1 Isi PengantarSeptia AlmeeraBelum ada peringkat
- Bab IvDokumen7 halamanBab IvUPT Puskesmas KarangsariBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RSUD PanyabunganDokumen6 halamanKontrak Survei - Survei Akreditasi RSUD PanyabunganRani Harus TersenyumBelum ada peringkat
- Denah Ruangan Dan Alur Kalibrasi Alat MedikDokumen14 halamanDenah Ruangan Dan Alur Kalibrasi Alat MedikJANN's100% (2)
- Kontrak Survei - Survei Akreditasi RS Hi Muhammad YusufDokumen6 halamanKontrak Survei - Survei Akreditasi RS Hi Muhammad YusufPrasetya YudhaBelum ada peringkat
- Protokol Uji Profisiensi 2023Dokumen11 halamanProtokol Uji Profisiensi 2023Nasrudin AsyifakBelum ada peringkat
- Pertanyaan Dan JawabanDokumen4 halamanPertanyaan Dan JawabansjhyoBelum ada peringkat
- Draft Mou Klinik SaharaDokumen7 halamanDraft Mou Klinik Saharaagung kurniawanBelum ada peringkat
- Materi Prediksi PreetestDokumen16 halamanMateri Prediksi PreetestDede JefriBelum ada peringkat
- Persyaratan SertifikasiDokumen5 halamanPersyaratan SertifikasiBPPIBTSP BUNIKASIHBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RS Amanah Umat PurworejoDokumen6 halamanKontrak Survei - Survei Akreditasi RS Amanah Umat PurworejoIyanAntoniuzBelum ada peringkat
- Penjelasan Relaksasi Akreditasi Klinik Tahun 2023Dokumen14 halamanPenjelasan Relaksasi Akreditasi Klinik Tahun 2023AzharBelum ada peringkat
- Penjelasan Relaksasi Pelaksanaan Akreditasi Klinik Tahun 2023Dokumen3 halamanPenjelasan Relaksasi Pelaksanaan Akreditasi Klinik Tahun 2023Lia HaliaBelum ada peringkat
- Manajemen Laboratorium Akreditasi LabDokumen20 halamanManajemen Laboratorium Akreditasi LabDinaragritaBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RS Khusus Mata Prima VisionDokumen6 halamanKontrak Survei - Survei Akreditasi RS Khusus Mata Prima VisionanitaBelum ada peringkat
- Paparan PMK 54Dokumen39 halamanPaparan PMK 54Sri UlfaBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RS Emma MojokertoDokumen6 halamanKontrak Survei - Survei Akreditasi RS Emma MojokertoRumah Sakit EMMA MojokertoBelum ada peringkat
- Panduan Pengajuan Dan Pelaksanaan Uji Klinik Selama Pandemi Covid-19 Agustus 2020Dokumen32 halamanPanduan Pengajuan Dan Pelaksanaan Uji Klinik Selama Pandemi Covid-19 Agustus 2020sutan kayoBelum ada peringkat
- 1 PKS LARSI Dengan RS SURVEI MASTER77Dokumen4 halaman1 PKS LARSI Dengan RS SURVEI MASTER77Rafael HamzahBelum ada peringkat
- Kontrak Survei - Survei Akreditasi KARS Rumkit Ilyas TarakanDokumen6 halamanKontrak Survei - Survei Akreditasi KARS Rumkit Ilyas TarakansofianBelum ada peringkat
- Penyelenggaraan Akreditasi RSDokumen27 halamanPenyelenggaraan Akreditasi RSRahim AryawanBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RSIA Amalia Sidayu GresikDokumen6 halamanKontrak Survei - Survei Akreditasi RSIA Amalia Sidayu GresikLAILATUL AFIYAHBelum ada peringkat
- Penyelenggaraan & Persyaratan Akreditasi KHSDokumen49 halamanPenyelenggaraan & Persyaratan Akreditasi KHSSdm SariasihciputatBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RSKIA Permata Hati PainanDokumen6 halamanKontrak Survei - Survei Akreditasi RSKIA Permata Hati PainanPermata HatiBelum ada peringkat
- PDF Penjelasan Relaksasi Akreditasi Klinik Tahun 2023 - CompressDokumen14 halamanPDF Penjelasan Relaksasi Akreditasi Klinik Tahun 2023 - CompressZotero 71Belum ada peringkat
- Sosialisasi Aplikasi SINAFDokumen18 halamanSosialisasi Aplikasi SINAFTheodora Nancy100% (2)
- Hirarki PerundangDokumen8 halamanHirarki Perundangtiara raniBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RS Aisyiyah KudusDokumen6 halamanKontrak Survei - Survei Akreditasi RS Aisyiyah KudusNabilaBelum ada peringkat
- Skema Sertifikasi Indogap Cppib PDFDokumen10 halamanSkema Sertifikasi Indogap Cppib PDFatikamarisaBelum ada peringkat
- Penyelenggaraan Akreditasi Rumah SakitDokumen27 halamanPenyelenggaraan Akreditasi Rumah SakitNurhaeniBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RS As Syifa Bengkulu SelatanDokumen5 halamanKontrak Survei - Survei Akreditasi RS As Syifa Bengkulu SelatanRumah Sakit As-syifaBelum ada peringkat
- DPLS 05 Persyaratan Tambahan Bagi LSSHACCP Dan LSSMKP PDFDokumen18 halamanDPLS 05 Persyaratan Tambahan Bagi LSSHACCP Dan LSSMKP PDFFurqon HidayatullohBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RS. WoodwardDokumen6 halamanKontrak Survei - Survei Akreditasi RS. WoodwardfrederickBelum ada peringkat
- Rangkuman Izin Produksi Alkes PKRTDokumen6 halamanRangkuman Izin Produksi Alkes PKRTanistrisiaBelum ada peringkat
- Peraturan Menteri Kesehatan Republik Indonesia Nomor 20 Tahun 2017 Tentang Cara Pembuatan Alat Kesehatan Dan Perbekalan Kesehatan Rumah Tangga Yang BaikDokumen13 halamanPeraturan Menteri Kesehatan Republik Indonesia Nomor 20 Tahun 2017 Tentang Cara Pembuatan Alat Kesehatan Dan Perbekalan Kesehatan Rumah Tangga Yang BaikyetikBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RSU at Medika PalopoDokumen6 halamanKontrak Survei - Survei Akreditasi RSU at Medika PalopoDeck LeoBelum ada peringkat
- Persyaratan Pengajuan Akreditasi Rumah SakitDokumen3 halamanPersyaratan Pengajuan Akreditasi Rumah SakitVani Angga PBelum ada peringkat
- Perjanjian Kerja Sama Antara Kars DGN Rsud EndeDokumen6 halamanPerjanjian Kerja Sama Antara Kars DGN Rsud EndeHardiman E BanamtuanBelum ada peringkat
- Kontrak Survei - Survei Akreditasi RSU RatihDokumen6 halamanKontrak Survei - Survei Akreditasi RSU RatihMbak DheaBelum ada peringkat
- Spo KalibrasiDokumen1 halamanSpo KalibrasiklinikganecadhaBelum ada peringkat
- Tugas FarmakonogsiDokumen7 halamanTugas FarmakonogsiNanda SafitriBelum ada peringkat
- BPFKDokumen41 halamanBPFKjuli agustonoBelum ada peringkat
- Penyelenggaraan Akreditasi Rumah Sakit - Surabaya-Ka TimkerDokumen27 halamanPenyelenggaraan Akreditasi Rumah Sakit - Surabaya-Ka Timkermorning reportBelum ada peringkat
- UUDokumen34 halamanUUHidayah Dwi RengganiBelum ada peringkat
- Penilaian Obat KLP 6Dokumen21 halamanPenilaian Obat KLP 6Mashitoh Cindy Utari100% (1)
- Kontrak Survei - Survei Akreditasi RSUD. Ngimbang, LamonganDokumen6 halamanKontrak Survei - Survei Akreditasi RSUD. Ngimbang, LamonganSi BudiBelum ada peringkat
- Protap Penanganan Program Kalibrasi Dan VerifikasiDokumen5 halamanProtap Penanganan Program Kalibrasi Dan Verifikasifahmi.akbar.putraBelum ada peringkat
- Etika ProfesiDokumen13 halamanEtika ProfesiFelysa AmeliaBelum ada peringkat
- PERSIAPAN KLINIK Untuk AKREDITASI 2023Dokumen3 halamanPERSIAPAN KLINIK Untuk AKREDITASI 2023nurillah isnaeni yusufBelum ada peringkat
- Paper Kalibrasi Khusmah Ayuning TyasDokumen30 halamanPaper Kalibrasi Khusmah Ayuning TyasKhusmah Ayuning TyasBelum ada peringkat
- Kaspianoor - ILKI WebinarDokumen36 halamanKaspianoor - ILKI WebinarYadi ApriyadiBelum ada peringkat
- Laporan GerdDokumen16 halamanLaporan GerdAnggraita PratiwiBelum ada peringkat
- Review Jurnal MatriksDokumen1 halamanReview Jurnal MatriksAnggraita PratiwiBelum ada peringkat
- TugasNosi Ke 4Dokumen4 halamanTugasNosi Ke 4Anggraita PratiwiBelum ada peringkat
- Teks PujaDokumen2 halamanTeks PujaAnggraita PratiwiBelum ada peringkat
- Pengawasan MutuDokumen22 halamanPengawasan MutuAnggraita PratiwiBelum ada peringkat
- 12.pembuatan & Analisis Berdasarkan KontrakpptDokumen10 halaman12.pembuatan & Analisis Berdasarkan KontrakpptAnggraita PratiwiBelum ada peringkat
- VIALDokumen9 halamanVIALAnggraita PratiwiBelum ada peringkat
- Hygene Dan SanitasiDokumen14 halamanHygene Dan SanitasiAnggraita PratiwiBelum ada peringkat
- Penanganan Keluhan Dan DokumentasiDokumen12 halamanPenanganan Keluhan Dan DokumentasiAnggraita PratiwiBelum ada peringkat
- Uji PraklinikDokumen30 halamanUji PraklinikAnggraita PratiwiBelum ada peringkat
- Laporan Farkol Nekropsi Dan Pengambilan DarahDokumen13 halamanLaporan Farkol Nekropsi Dan Pengambilan DarahAnggraita Pratiwi100% (1)