Presentasi Canva
Diunggah oleh
Muhamad ToriqHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Presentasi Canva
Diunggah oleh
Muhamad ToriqHak Cipta:
Format Tersedia
TERMODINAMIKA
Termodinamika adalah cabang fisika yang mempelajari hukum-hukum dasar
dan membahas konversi energi termal menjadi usaha yang bermanfaat.
Termodinamika berasal dari 2 kata bahasa Yunani yaitu “Thermos” dan
“dynamic”.
“Thermos” artinya panas dan “dynamic” yang berarti dinamis atau perubahan,
Jadi termodinamika adalah pergerakan atau perubahan panas.
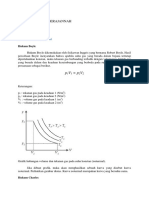
PERSAMAAN UMUM
PROSES ISBOARIK PROSES ISOKHORIK
Yaitu proses yang berlangsung pada RUMUS
RUMUS
Yaitu proses yang berlangsung pada
tekanan tetap (tekanan sama). Grafik Karena tekanan sama dan suhu Karena tekanan sama dan suhu volume tetap (volume sama). Grafik
tekanan gas (P) terhadap volume (V) berubah dari T1 menjadi T2, maka berubah dari T1 menjadi T2, maka tekanan gas (P) terhadap volume (V)
perhatikan gambar di smping : berlaku hukum Charles : berlaku hukum GayLussac : perhatikan gambar di samping :
V1/𝑇1 = V2/𝑇2 𝑃1/𝑇1 = 𝑃2/𝑇2
(P1 = P2), volume gas berubah dari V1 W = usaha gas (J) P1 = tekanan gas mula-mula (Pa) Dari grafik di samping pada volume yang
menjadi V2. Usaha yang dilakukan gas P = tekanan gas (Pa) P2 = tekanan gas akhir (Pa) sama (V1 = V2), tekanan gas berubah dari
pada proses isobar adalah V1 = volume gas mula-mula (m3) T1 = suhu gas mula-mula (K) P1 menjadi P2. Usaha yang dilakukan gas
W = P.V = P.(V2 – V1) V2 = volume gas akhir (m3) T2 = volume gas akhir (K) pada proses isovolume adalah sama
W = n.R.(T2 – T1) T1 = suhu gas mula-mula (K) dengan nol.
W = luas daerah yang diarsir T2 = volume gas akhir (K) W = P.V = P.(V2 – V1) = 0
PROSES ISOTERMAL PROSES ADIABATIK
Yaitu proses yang berlangsung pada suhu RUMUS
RUMUS
Yaitu proses perubahan keadaan gas
tetap (suhu sama). Grafik tekanan gas (P) Karena tekanan sama dan suhu Karena tekanan sama dan suhu dimana tidak ada kalor yang masuk
terhadap volume (V) amati gambar di berubah dari T1 menjadi T2, maka berubah dari T1 menjadi T2, maka maupun kalor yang keluar dari sistem (Q =
samping : berlaku hukum Boyle : berlaku hukum Poisson : 0). Grafik tekanan gas (P) terh adap
P1.V1 = P2.V2 P1.V1(Y) = P2.V2(Y) volume (V) amati gambar di samping :
Dari grafik di samping pada suhu yang n = mol Y = tetapan laplace Dari grafik di samping pada suhu yang
sama (T1 = T2), volume gas berubah dari R = tetapan gas umum P1 = tekanan gas mula-mula sama (T1 = T2), volume gas berubah dari
V1 menjadi V2 dan tekananya berubah R = 8314 J/kmol V1 = volume gas mula-mula V1 menjadi V2 dan tekananya berubah
dari P1 menjadi P2. Usaha yang dilakukan K =8,314 J/mol P2 = tekanan gas akhir dari P1 menjadi P2. Usaha yang dilakukan
gas pada proses isothermal adalah : K = 0,082 liter.atm/moloK) V2 = suhu gas akhir gas pada proses isothermal adalah :
W = nRT ln (V2/V1) T = suhu gas (K) W = 3/2 n.R.(T1-T2) atau 1/y-1 ( P1.V1 -
P2.V2 )
Anda mungkin juga menyukai
- Fisika TermodinamikaDokumen11 halamanFisika TermodinamikaRaven EllenaBelum ada peringkat
- Materi TermodinamikaDokumen8 halamanMateri Termodinamikamutianurulhuda065Belum ada peringkat
- Bab 1 Konsep DasarDokumen36 halamanBab 1 Konsep DasarNabilatul InayahBelum ada peringkat
- Teori Kinetik & TermodinamikaDokumen14 halamanTeori Kinetik & TermodinamikaAdinLennyYusroniBelum ada peringkat
- TermodinamikaDokumen15 halamanTermodinamikaDhikaa SyakirellBelum ada peringkat
- HK I ThermodinamikaDokumen28 halamanHK I ThermodinamikaKinesanBelum ada peringkat
- Fisika PPT - 20231108 - 084316 - 0000Dokumen14 halamanFisika PPT - 20231108 - 084316 - 0000Difa Raihan Setya AdjiBelum ada peringkat
- Fisika PPT - 20231108 - 084316 - 0000Dokumen14 halamanFisika PPT - 20231108 - 084316 - 0000Difa Raihan Setya AdjiBelum ada peringkat
- HUKUM I TERMODINAMIKADokumen31 halamanHUKUM I TERMODINAMIKAApriyanto DwiBelum ada peringkat
- Eksperimen Joule-1Dokumen6 halamanEksperimen Joule-1Achmad HamdaniBelum ada peringkat
- Termodinamika PDFDokumen26 halamanTermodinamika PDF7. Firginia AinurBelum ada peringkat
- PDokumen7 halamanPAchmad HamdaniBelum ada peringkat
- TERMODINAMIKADokumen4 halamanTERMODINAMIKAFeby MaharaniBelum ada peringkat
- TermodinamikaDokumen11 halamanTermodinamikaHana RiaBelum ada peringkat
- Gas Ideal dan Hukum-Hukum DasarDokumen128 halamanGas Ideal dan Hukum-Hukum DasarRoselina Eka WahyuniBelum ada peringkat
- Tekanan AbsolutDokumen7 halamanTekanan AbsolutdigyoBelum ada peringkat
- Hukum Termodinamika 1Dokumen82 halamanHukum Termodinamika 1Nandach Benci Disakiti100% (1)
- Panas 2Dokumen20 halamanPanas 2BangTomBelum ada peringkat
- Kuliah ThermodinamikaDokumen55 halamanKuliah Thermodinamikalevonavon50Belum ada peringkat
- TEORI GASDokumen8 halamanTEORI GASalvinda rosi wasikaBelum ada peringkat
- Pemuaian Zat GasDokumen5 halamanPemuaian Zat GasAndri RahmadaniBelum ada peringkat
- TermodinamikaDokumen51 halamanTermodinamikaAdamsyah Muhammad0% (1)
- Modul TermodinamikaDokumen19 halamanModul Termodinamikayunatri sanawaniBelum ada peringkat
- KF 1Dokumen128 halamanKF 1Winda Regita Pratiwi100% (1)
- Gas IdealDokumen128 halamanGas IdealDona PermataAyuBelum ada peringkat
- KURVA GAS IDEALDokumen127 halamanKURVA GAS IDEALIndahLestariBelum ada peringkat
- TERMODINAMIKA PROSESDokumen22 halamanTERMODINAMIKA PROSESIda Bagus Gede Yamuna C.N.Belum ada peringkat
- Hukum Gas IdealDokumen17 halamanHukum Gas IdealElok FaikhatulBelum ada peringkat
- Materi TermodinamikaDokumen32 halamanMateri TermodinamikaAnonymous zVNJ0lcKD2Belum ada peringkat
- Materi Termodinamika 2Dokumen3 halamanMateri Termodinamika 2aqilanabilBelum ada peringkat
- TermodinamikaDokumen19 halamanTermodinamikaFerdinandus Pati0% (1)
- Memposting StatusDokumen19 halamanMemposting StatusIntan Putri AmandaBelum ada peringkat
- SUHU DAN KALORDokumen5 halamanSUHU DAN KALORAbu KhonsaBelum ada peringkat
- Mekanika Fluida 4Dokumen13 halamanMekanika Fluida 4Hermawan -Belum ada peringkat
- PEMUAIAN GASDokumen4 halamanPEMUAIAN GASNova LianaBelum ada peringkat
- Presentation 1Dokumen11 halamanPresentation 1GabrelabesouwBelum ada peringkat
- TERMODINAMIKADokumen18 halamanTERMODINAMIKAFitri handayaniBelum ada peringkat
- Persamaan Gas Non IdealDokumen15 halamanPersamaan Gas Non IdealangelBelum ada peringkat
- Termo 2Dokumen28 halamanTermo 2Irfan TreyaanBelum ada peringkat
- Termodinamika DasarDokumen33 halamanTermodinamika DasarAnindya Primada100% (3)
- Komsep Dadar Ipa Kelompok 5Dokumen28 halamanKomsep Dadar Ipa Kelompok 5Sucita WulandariBelum ada peringkat
- Bab Iv Persamaan KeadaanDokumen16 halamanBab Iv Persamaan KeadaanFakhrur RaziBelum ada peringkat
- TermodinamikaDokumen16 halamanTermodinamikaRapliBelum ada peringkat
- OPTIMASI TERMODINAMIKADokumen16 halamanOPTIMASI TERMODINAMIKAdewiBelum ada peringkat
- Termodinamika Kel 1Dokumen24 halamanTermodinamika Kel 1IraBelum ada peringkat
- Thermodinamika 1 8Dokumen25 halamanThermodinamika 1 8Payung TeduhBelum ada peringkat
- TermodinamikaDokumen68 halamanTermodinamikaJihan ZaniraBelum ada peringkat
- Teori Kinetik GasDokumen6 halamanTeori Kinetik Gassrysari87Belum ada peringkat
- Pert 5. TermodinamikaDokumen50 halamanPert 5. TermodinamikaSyafry KurniawanBelum ada peringkat
- TermodinamikaDokumen28 halamanTermodinamikaIni SayaBelum ada peringkat
- Teori Kinetik Gas: PV=nRTDokumen20 halamanTeori Kinetik Gas: PV=nRTGigih Adi PambudiBelum ada peringkat
- Presentasi SBMDokumen108 halamanPresentasi SBMYunus AL Mahdi SiregarBelum ada peringkat
- PemuaianDokumen3 halamanPemuaianAgim sulungBelum ada peringkat
- OPTIMALKAN TEMPERATURDokumen38 halamanOPTIMALKAN TEMPERATURrizka fajrinBelum ada peringkat
- Diktat ThermodinamikaDokumen82 halamanDiktat ThermodinamikaadiyaksapermanaBelum ada peringkat
- OPTIMIZING GAS LAWSDokumen20 halamanOPTIMIZING GAS LAWSMurni SirappaBelum ada peringkat
- Bab 1 AtkinsDokumen20 halamanBab 1 AtkinsBerliana Dwi SeptianiBelum ada peringkat
- Teori Kinetik Gas Kelompok 1Dokumen34 halamanTeori Kinetik Gas Kelompok 1Achmad Nak KoedoesBelum ada peringkat