Identifikasi Kation Golongan II Teori
Diunggah oleh
Fajril RifkiJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Identifikasi Kation Golongan II Teori
Diunggah oleh
Fajril RifkiHak Cipta:
Format Tersedia
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
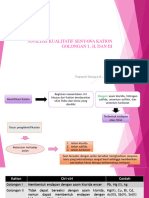
IDENTIFIKASI KATION GOLONGAN II
I. TUJUAN
Mengidentifikasi kation-kation pada golongan IIA dan IIB serta
memahami reaksi-reaksinya.
II. TEORI
Analisis terbagi dalam:
1. Analisis kwalitatif atau analisis jenis.
Analisis kwalitatif bertujuan memeriksa untuk menentukan unsur-unsur,
gugus-gugus atau ion-ion apa yang terdapat dalam suatu zat atau
campuran zat-zat atau larutan.
2. Analisis kwantitatif atau analisis jumlah.
Analisis kwantitatif bertujuan menentukan berapa atau berapa persen
suatu unsure terdapat dalam suatu senyawa ataupun dalam suatu
campuran seperti menentukan berapa % besi atau berapa % Fe 2O3
terdapat dalam suatu cuplikan tanah.
Klasifikasi kation yang paling umum didasarkan pada perbedaan
kelarutan dari klorida, sulfida, dan karbonat kation tersebut. Kation
diklasifikasikan dalam 5 golongan berdasarkan sifat-sifat kation tersebut
terhadap beberapa reagensia.Analisis kualitatif merupakan suatu proses
dalam mendeteksi keberadaan suatu unsur kimia dalam suatu cuplikan
dan merupakan salah satu cara yang efektif untuk mempelajari unsur-
unsur kimia serta ion-ionnya dalam larutan. Dalam metode analisis
kualitatif kita menggunakan beberapa pereaksi diantaranya pereaksi
golongan dan pereaksi spesifik, kedua pereaksi ini dilakukan untuk
menegtahui jenis anion atau kation suatu larutan.
Reagensia golongan II ini adalah hidrogen sulfida (gas atau larutan
– air jenuh). Kation-kation yang temasuk golongan II, yaitu : Merkurium
(II), Timbal(II), Bismut(III), Tembaga(II), Kadmium(II), Arsenik(III),
Arsenik(V), Stibium(III), Stibium(V), Timah(II) dan Timah(IV). Pereaksi
golongan II ini adalah hidrogen sulfida dengan reaksi golongannya
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
membentuk endapan-endapan dengan berbagai warna seperti HgS
(hitam), PbS (hitam), CuS (hitam), CdS (kuning), Bi2S3 (coklat), As2S3
(kuning), Arsenik(V) sulfida (kuning), Sb2S3 (jingga), Sb2S5 (jingga), SnS
(coklat), dan SnS2 (kuning).
Kation-kation golongan kedua dibagi menjadi dua sub-golongan,
yaitu:
1. Sub-golongan tembaga
2. Sub-golongan arsenic
Dasar dari pembagian golongan ini adalah kelarutan amonium sulfida
dalam ammonium polisulfida. Sementara sulfida dari sub-golongan
tembaga tak larut dalam reagensia ini, sulfide dari sub-grup arsenic
melarut dengan membetuk garam tio.
Sub-golongan tembaga terdiri dari merkurium(II), timbel(II),
bismut(III), tembaga(II), dan kadmium(II). Meskipun bagian terbesar ion
timbel(II) diendapkan dengan asam klorida encer bersama ion-ion lain
dalam golongan I, pengendapan ini agak kurang sempurna, disebabkan
oleh kelarutan timbel(II) klorida yang relative tinggi. Maka dalam
pengerjaan sistematik, ion-ion timbel masih akan tetap ada, ketika kita
bertugas mengendapkan golongan kation kedua. Reaksi-reaksi ion
timbel(II) sudah diuraikan bersama-sama dengan reaksi-reaksi kation
golongan pertama.
Klorida, nitrat, dan sulfat dari kation-kation sub-golongan tembaga,
sangat mudah larut dalam air. Sulfida, hidroksida, dan karbonat-nya tidak
larut. Beberapa kation dari sub-golongan tembaga (merkurium(II),
tembaga(II), dan kadmium(II)) cenderung membentuk kompleks
(ammonia, ion sianida, dan seterusnya).
Sub-golongan arsenik terdiri dari ion arsenik(III), arsenik(V), stibium
(III), stibium(V), timah(II), dan timah(IV). Ion-ion ini mempunyai sifat-sifat
amfoter. Sifat amfoter yaitu oksidanya membentuk garam baik dengan
asam maupun dengan basa. Jadi, arsenik(III) oksida dapat dilarutkan
dalam asam klorida (6M), dan terbentuk kation arsenik(III):
As2O3 + 6HCl 2As3+ + 6Cl- + 3H2O
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
Di samping itu, arsenik (III) oksida larut pula dalam natrium
hidroksida 2M, pada mana terbentuk arsenit.
As2O3 + 6HCl 2As3+ + 3H2O
Melarutnya sulfida dalam amonium polisulfida dapat dianggap
sebagai pembentukan garam-tio anhidrat. Jadi, melarutnya arsenik(II)
sulfida (asam tio anhidrat) mengakibatkan terbentuknya ion-ion amonium
dan tioarsenik (amonium tioarsenik, suatu garam-tio).
Semua sulfida dari sub-golongan arsenik larut dalam amonium
sulfida (tak berwarna), kecuali timah(II) sulfida; untuk melarutkan yang
terakhir ini, diperlukan amonium polisulfida, yang bertindak sebagian
sebagai zat pengoksida, sehingga terbentuk ion tiostanat.
Ion-ion arsenik(III), stibium(III), dan timah(IV). Dapat dioksidasikan
menjadi ion arsenik(V), stibium(V), dan timah(IV). Di lain pihak, ketiga ion
yang terakhir ini dapat direduksi oleh zat-zat pereduksi yang sesuai.
Besarnya potensial oksidasi-reduksi dari sistem arsenik(V) arsenik(II), dan
stibium(V) stibium(III), bergantung pada pH yang sesuai untuk reaksi
tersebut.
Kation-kation yang termasuk golongan kedua adalah:
1. Merkurium II (Hg2+)
Reaksi-reaksinya adalah:
a. Hidrogen sulfide (H2S)
Dengan adanya asam klorida encer, miula-mula akan terbentuk
endapan putih yang akan terurai bila ditambahkan hydrogen
sulfide.
b. Amonium hidroksida (NH4OH)
Akan terbentuk endapan kuning pucat.
c. Kalium Iodida (KI)
Akan terbentuk endapan merah.
d. Timah II klorida (SnCl2)
Terbentuk endapan putih dalam larutan putih susu.
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
e. Natrium Hidroksida (NaOH)
Terbentuk endapan coklat merkutium II Hidroksida.
2. Bismut III (Bi3+)
Bismut adalah logam putin kemerahan, kristalin, dan etas. Tidak larut
dalam asam klorida disebabkan oleh potensial standardnya tetapi larut
dalam asam nitrat pekat.
Reaksi-reaksinya adalah:
a. Hidrogen sulfide (H2S)
Terbentuk endapan hitam. Asam klorida panas melarutkan
endapan.
b. Amonium Hidroksida (NH4OH)
Terbentuk endapan putih. Endapan tidak larut dalam kelebihan
pereakai.
c. Natrium Hidroksida (NaOH)
Terbentuk endapan putih. Endapan hanya sedikit larut dalam
kelebihan pereasi.
d. Kalium Iodida (KI)
Terbentuk endapan hitam. Endapan mudah larut dalam reagensia
berlebihan.
e. Air (H2O)
Akan terbentuk endapan putih. Endapan akan larut dalam asam
mineral encer.
3. Tembaga (Cu2+)
Tembaga adalah logam merah muda yang lunak dapat ditempa dan liat.
Reaksi – reaksi ion tembaga.
a. Hidrogen Sulfida (H2S)
Terbentuk endapan hitam. Endapan larut dalam asam nitrat pekat
panas.
b. Amonium Hidroksida (NH4OH)
Terbentuk endapan biru tua garam basa. Endapan akan larut
dalam kelebihan pereaksi.
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
c. Natrium Hidroksida (NaOH)
Terbentuk endapan biru. Endapan tidak larut dalam kelebihan
pereaksi.
d. Kalium Iodida (KI)
Terbentuk endapan yang berwarna putih, tetapi larutannya
berwarna coklat karena terbentuknya ion-ion Iodida.
e. Kalium Sianida (KCN)
Mula-mula terbentuk endapan kuning. Endapan cepat terurai
menjadi tembaga I Sianida.
f. Kalium Tiosianat (KSCN)
Endapan hitam tembaga II tiosianat.
4. Kadmium (C2+)
Kadmium adal;ah logam putih keperakan yang dapat ditempa dan liat. Ia
melarut dengan lambat dalam asam encer dengan melepaskan hydrogen.
Reaksi-reaksi cadmium adalah:
a. Hidrogen Sulfida (H2S)
Terbentuk endapan kuning cadmium sulfide. Endapan tidak larut
dalam kalium sianida. Aini yang membedakannya dari tembaga.
b. Amonium Hidroksida (NH4OH)
Terbentuk endapan putih. Endapan melarut dalam kelebihan
pereaksi.
c. Natrium Hidroksida (NaOH)
Terbentik endapan putih dan endapan akan melarut dalam
kelebihan pereaksi. Warna komposisinya tetap bila didihkan.
d. Kalium Sianida (KCN)
TErbentuk endapan putih dan endapan kan larut dalam kelebihan
pereaksi.
e. Kalium Iodida (KI)
Pada reaksi ini tidak terbentuk endapan. Hal ini yang
membedakannya juga dengan tembaga.
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
5. Stibium (Sb3+)
Stibium adala logam yang berwarna putih keperakan yang mengkilap.
Stibium tidak larut dalam asam klorida dan asam sulfat encer. Dalam
asam sulfat panas ia melarut perlahan-lahan dengan membentuk ion
Stibium III.
Reaksi-reaksinya adalah:
a. Hidrogen Sulfida (H2S)
Endapan merah jingga stibium trisulfida dari larutan yang tidak
terlalu asam. Endapan larut dalam asam, klorida pekat panas.
Dan dalam larutan Hidroksida membentuk antimonit dan
tioantimonit.
b. Air (H2O)
Bila larutan dituangkan kedalam air, akan terbentuk endapan putih
yang larut dalam asam klorida dan larutan tartarat (perbedaan
dengan bismuth). Dengan air yang berlebihan akan dihasilkan oksi
trhidrasi.
c. Natrium Hidroksida (NaOH)
Terbentuk endapan putih yang larut dalam basa alkali yang pekat
(5M) membuat antimonit.
d. Kalium Iodida (KI)
Warna menjadi merah karena pembentukan ion kompleks.
6. Timah (Sn2+)
Timah adalah logam putih perak yang dapat ditempa dan liat p[ada suhu
biasa, tetapi pada suhu rendah menjadi getas. Logam ini melarut dengan
lambat dalam asam klorida encer dan asam sulfat encer.
Reaksi-reaksinya adalah:
a. Hidrogen sulfide (H2S)
Terbentuk endapan coklat timah II sulfide. Endapan akan larut
dalam asam klorida pekat. Endapan tidak larut dalam basa alkali.
b. Natrium Hidroksida (NaOH)
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
Terbentuk endapan putih yang larut dalam alkali yang berlebihan.
c. Merkuri II Klorida (Hg2Cl2)
Terbentuk endapan putih jika reagensia ditambah dalam jumlah
yang besar dengan cepat. Tetapi ion timah II terdapat berlebihan,
endapan akan berubah menjadi abu-abu.
d. Bismut Nitrat dan Natrium Hidroksida
Endapan hitam bismuth.
Identifikasi Kation-Kation Golongan IV
Praktikum Kimia Dasar II
Tahun Akademik 2013/2014
IV. Kesimpulan dan Saran
4.1 Kesimpulan
Dari praktikum yang telah dilakukan dapat diambil kesimpulan
bahwa:
1. Kation golongan II terdiri dari merkurium(II), bismut, tembaga,
kadmium, arsen(III), antimoni(III), antimoni(V), tin(II) dan tin(IV).
2. Reagen spesifik golongan dua menurut teori adalah H2S.
4.2 Saran
Agar praktikum selanjutnya berjalan dengan baik, disarankan:
1. Jangan menambahkan reagen dalam jumlah yang berlebih
karena akan melarutkan endapan.
2. Sebelum melakukan praktikum atau uji terhadap kation,
praktikan harus mengetahui reagen spesifiknya.
3. Bekerja dengan hati-hati sesuai dengan aturan yang ada
dipedoman.
Identifikasi Kation-Kation Golongan IV
Anda mungkin juga menyukai
- Identifikasi Kation Golongan II (Teori)Dokumen8 halamanIdentifikasi Kation Golongan II (Teori)AdeFriscaDianaII100% (4)
- IDENTIFIKASI KATION GOLONGAN IIDokumen22 halamanIDENTIFIKASI KATION GOLONGAN IIjane nizar rahmanBelum ada peringkat
- KATION GOLONGAN IIDokumen13 halamanKATION GOLONGAN IIMeitri Wulandari KoharBelum ada peringkat
- Makalah Kation Dan AnionDokumen29 halamanMakalah Kation Dan AnionCahaya PratamaBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Dokumen22 halamanMakalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Fajar Yusya Ramadhan94% (33)
- 27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIDokumen22 halaman27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIMawar RamadhaniBelum ada peringkat
- Praktikum Reaksi Pengenalan Kation Golongan IiDokumen13 halamanPraktikum Reaksi Pengenalan Kation Golongan Iityas nur malindaBelum ada peringkat
- Analisis Kation Golongan I II III IV DanDokumen13 halamanAnalisis Kation Golongan I II III IV Dannadya aulia100% (1)
- Analisis KationDokumen16 halamanAnalisis KationLinggar Rudiarto100% (1)
- KATION GOLONGAN IIDokumen25 halamanKATION GOLONGAN IISri SumartiniBelum ada peringkat
- Identifikasi Kation Golongan 1 Dan 2Dokumen26 halamanIdentifikasi Kation Golongan 1 Dan 2Muhammad Alfi Syahri 1607112225Belum ada peringkat
- Analisis Kualitatif IonDokumen10 halamanAnalisis Kualitatif IonDeni St-setia Van HoutenBelum ada peringkat
- Analisiskation 190425155404Dokumen13 halamanAnalisiskation 190425155404Dechia Sachamyta LicheresBelum ada peringkat
- Identifikasi Kation Golongan 2Dokumen7 halamanIdentifikasi Kation Golongan 2ervhintia mkBelum ada peringkat
- Analisis KationDokumen17 halamanAnalisis KationSileents ShaadowBelum ada peringkat
- Dalam Sistem H2S Kation Golongan IDokumen9 halamanDalam Sistem H2S Kation Golongan IDea Aliftia FirdaushyaBelum ada peringkat
- Bab IDokumen13 halamanBab IMoch Khoirul UmamBelum ada peringkat
- Analisa Kualitatif Adalah Proses Dalam Mendeteksi Keberadaan Suatu Unsur Kimia Dalam Sampel Yang Tidak DiketahuiDokumen3 halamanAnalisa Kualitatif Adalah Proses Dalam Mendeteksi Keberadaan Suatu Unsur Kimia Dalam Sampel Yang Tidak DiketahuiYoon Hye MyeongBelum ada peringkat
- Kation Golongan IIDokumen22 halamanKation Golongan IIHesti apriana putriBelum ada peringkat
- IDENTIFIKASI LOGAM BERATDokumen30 halamanIDENTIFIKASI LOGAM BERATTifa KahestiyBelum ada peringkat
- TugasDokumen7 halamanTugasMulti ArmainahBelum ada peringkat
- Makalah Pemisahan Kation Golongan II PDFDokumen14 halamanMakalah Pemisahan Kation Golongan II PDFPrilaHermanto100% (2)
- Laporan Praktikum Kation Dan AnionDokumen23 halamanLaporan Praktikum Kation Dan AnionFatimah Jufri50% (4)
- Identifikasi KationDokumen38 halamanIdentifikasi KationfasyaurfaniBelum ada peringkat
- IDENTIFIKASI KATION LOGAM BERAT DENGAN REAKSI KIMIADokumen31 halamanIDENTIFIKASI KATION LOGAM BERAT DENGAN REAKSI KIMIATifa KahestiyBelum ada peringkat
- ANALISIS KATIONDokumen9 halamanANALISIS KATIONZhalzhabilla AzzahrahBelum ada peringkat
- ANALISIS KATIONDokumen12 halamanANALISIS KATIONdutaBelum ada peringkat
- Laporan Resmi KationDokumen20 halamanLaporan Resmi KationFikriyah Nugiari RachmahBelum ada peringkat
- Makalah KationDokumen50 halamanMakalah KationPalupi Diah UtamiBelum ada peringkat
- Identifikasi Kation Golongan 1 Dan 2Dokumen4 halamanIdentifikasi Kation Golongan 1 Dan 2Indra KurniawanBelum ada peringkat
- Jurnal Praktikum Analisis Kation Dan Anion - 008 - Tiara PuspitasariDokumen31 halamanJurnal Praktikum Analisis Kation Dan Anion - 008 - Tiara PuspitasariBani AsrorBelum ada peringkat
- Makalah Pemisahan Kation Golongan IIDokumen9 halamanMakalah Pemisahan Kation Golongan IIFinta C LimbongBelum ada peringkat
- Kimia Analitik IDokumen10 halamanKimia Analitik INurul afiqah suburanBelum ada peringkat
- Kelompok 2 KAD (Autosaved)Dokumen28 halamanKelompok 2 KAD (Autosaved)susi simangunsongBelum ada peringkat
- Identifikasi Kation dan AnionDokumen6 halamanIdentifikasi Kation dan AnionPuspipita DewiBelum ada peringkat
- Kimia AnalitikDokumen20 halamanKimia AnalitikYannieApriyani50% (2)
- Bundelan Objek 1Dokumen31 halamanBundelan Objek 1Ashlah HafizahBelum ada peringkat
- Pemisahan Dan Identifikasi KationDokumen42 halamanPemisahan Dan Identifikasi KationNawir BaharuddinBelum ada peringkat
- Materi KA1 Minggu 1Dokumen28 halamanMateri KA1 Minggu 1Arnes TataBelum ada peringkat
- KATION GOLONGAN IIDokumen32 halamanKATION GOLONGAN IIDwik PurnamayantiBelum ada peringkat
- KATION Golongan 2Dokumen7 halamanKATION Golongan 2Ody xBelum ada peringkat
- Kation Golongan 1Dokumen4 halamanKation Golongan 1BiiebBelum ada peringkat
- Makalah Pemisahan Kation Golongan IIDokumen14 halamanMakalah Pemisahan Kation Golongan IIMeitri Wulandari Kohar80% (5)
- Uji Kualitatif KationDokumen14 halamanUji Kualitatif KationAl GhifarBelum ada peringkat
- 09-Pemisahan Dan Identifikasi Kation Golongan IIDokumen3 halaman09-Pemisahan Dan Identifikasi Kation Golongan IIAl LubizBelum ada peringkat
- Analisis Kation Golongan IiDokumen17 halamanAnalisis Kation Golongan Iiilliyin75% (4)
- LA ArrheniusDokumen27 halamanLA Arrheniuseli eliBelum ada peringkat
- CBR Kimia Analitik - Desima Samosir - 4191131009 - PSPK 19eDokumen12 halamanCBR Kimia Analitik - Desima Samosir - 4191131009 - PSPK 19eDesima SamosirBelum ada peringkat
- JJXJDKSMXDokumen15 halamanJJXJDKSMXAufa QaysBelum ada peringkat
- Pemisahan Kation Golongan I Dan IiDokumen14 halamanPemisahan Kation Golongan I Dan IiFadhil FerdianBelum ada peringkat
- Analisis Kualitatif Kation Gol 2Dokumen28 halamanAnalisis Kualitatif Kation Gol 2Gita Yuliana DewiBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion Ira JaperDokumen23 halamanMakalah Analisis Kualitatif Kation Dan Anion Ira JaperFauziahBelum ada peringkat
- K2GKGDDDokumen16 halamanK2GKGDDFitriyaniBelum ada peringkat
- Analis Kation AnionDokumen5 halamanAnalis Kation AnionAnnyzar Maulana BachtiarBelum ada peringkat
- Makalah Kimia KualitatifDokumen10 halamanMakalah Kimia KualitatifGamaliel JuliadiBelum ada peringkat
- Golongan 2Dokumen10 halamanGolongan 2Beby HapsariBelum ada peringkat
- Untitled DesignDokumen1 halamanUntitled DesignFajril RifkiBelum ada peringkat
- Tugas Kelompok Bhs. Indonesia 2022 (Revisi) - 1Dokumen10 halamanTugas Kelompok Bhs. Indonesia 2022 (Revisi) - 1Fajril RifkiBelum ada peringkat
- ILMU KIMIA DASARDokumen15 halamanILMU KIMIA DASARFajril RifkiBelum ada peringkat
- SMK-DaftarHadirDokumen20 halamanSMK-DaftarHadirFajril RifkiBelum ada peringkat
- ILMU KIMIA DASARDokumen15 halamanILMU KIMIA DASARFajril RifkiBelum ada peringkat