1.a. Sifat Koligatif Larutan 1
1.a. Sifat Koligatif Larutan 1
Diunggah oleh
Anisa RizaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
1.a. Sifat Koligatif Larutan 1
1.a. Sifat Koligatif Larutan 1
Diunggah oleh
Anisa RizaHak Cipta:
Format Tersedia
SIFAT KOLIGATIF
LARUTAN
>> 0 >> 1 >> 2 >> 3 >> 4 >>
PENGANTAR
• Dalam kehidupan sehari-hari sering Kalian jumpai kegiatan manusia yang
memanfaatkan Sifat Koligatif larutan. Namun kalian banyak yang belum tahu. Misalnya
saja Orang buat Es Puter . Sebagai Pendingin Mereka menggunakan Es yang dicampur
dengan garam . Why ? Kita akan mengetahuinya . tentunya asal kalian mau belajar Tekun
dan tidak malu bertanya .
• Dalam Modul Pertama ini, akan dibahas 4 Sifat Koligatif Larutan, antara lain :
– Penurunan Tekanan Uap ( ∆P )
– Penurunan Titik Beku (∆Tf )
– Kenaikan Titik Didih (∆Tb )
– Tekanan Osmotik ( )
• Ke-empat Sifat Koligatif tersebut akan dibahas untuk Larutan Non Elektrolit dan Larutan
Elektrolit .
• Untuk mempelajari materi ini kalian bisa belajar dan berlatih sendiri, namun akan lebih baik
apabila bekerja dalam Kelompok kecil, atau mungkin bisa bekerja sama dengan kelompok
kecil lainnya, ini selain dapat ilmu Kimianya, kamu juga dapat ilmu bersosialisai dengan
Teman sejawat kamu, hal ini akan sangat penting pada saatnya nanti kamu harus terjun di
masyarakat .
• Selamat Belajar, Semoga sukses !!!!!!!!! !
>> 0 >> 1 >> 2 >> 3 >> 4 >>
Sifat Koligatif Larutan :
Yaitu, sifat larutan yang hanya tergantung pada jumlah partikel zat
terlarut, tidak tergantung pada jenis zat terlarut
1. Penurunan Tekanan Uap Jenuh (P)
Tekanan Uap ???
Uap Jenuh ???
Adanya zat terlarut di dalam suatu pelarut (larutan)
menyebabkan Tekanan Uap Jenuhnya menjadi lebih rendah, terjadi
penurunan Tekanan Uap Jenuh (P)
Roult : P = Xt . Po
Keterangan :
Xt = fraksi mol terlarut
Po = Teknanan Uap Jenuh pelarut murni
>> 0 >> 1 >> 2 >> 3 >> 4 >>
Latihan Soal :
1. Pada 20oC Tekanan uap air jenuh adalah 17,5
mmHg. Jika 9 gram Glukosa, C6H12O6 (Mr=180)
dilarutkan dalam 90 gram air, tentukan Tekanan
uap jenuh larutan yang terjadi
2. Diketahui Tekanan uap air jenuh pada suhu 30 oC
adalah 31,84 mmHg. Jika ingin mendapat- kan
larutan dengan tekanan uap jenuh sebesar 27,86
mmHg pada suhu tersebut, Maka massa Glikol
(Mr = 62) yang harus dilarutkan dalam 630 gram
air adalah
>> 0 >> 1 >> 2 >> 3 >> 4 >>
• 2. Penurunan Titik beku (∆ Tf)
Diagram P – T
P
Cair
Gas
Padat
Tf Tfo
T
∆Tf
>> 0 >> 1 >> 2 >> 3 >> 4 >>
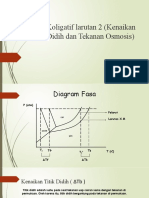
• 3. Kenaikan Titik Didih (∆Tb)
Diagram P – T
P
Cair
Gas
Padat
Tf Tfo Tbo Tb
T
∆Tf ∆Tb
>> 0 >> 1 >> 2 >> 3 >> 4 >>
Tf = m . Kf
Keterangan:
Tf = Penurunan Titik Beku
m = molalitas Larutan
Kf = Tetapan penurunan titik beku molal
Tb = m . Kb
Ket :
Tb = kenaikan Titik Didih
m = molalitas larutan
Kb = Tetapan kenaikan titik didih molal
>> 0 >> 1 >> 2 >> 3 >> 4 >>
1. Latihan Soal
Sebanyak 15 gram Urea (Mr = 60) , dilarutkan dalam 250 gr
air. Tentukan titik beku larutan tersebut ! (diket :Kf = 1,86oC)
2. Suatu senyawa non elektrolit sebanyak 16 gram dilarutkan
dalam 1000 gram air. Ternyata larutan tersebut mendidih
pada suhu 100,052oC. Jika Kb air = 0,52 , Tentukan Mr zat
non elektrolit tersebut !
3. Sebanyak 3 gram zat X non elektrolit dilarutkan dalam
Benzena . Larutan tersebut mendidih pada suhu 105,54 oC.
Jika diketahui Titik didih Benzena adalah 105 oC dan Kb
Benzena = 2,7 oC/m. Maka Mr zat X adalah …..
>> 0 >> 1 >> 2 >> 3 >> 4 >>
>> 0 >> 1 >> 2 >> 3 >> 4 >>
1. Pada suhu 27oC, sebanyak 6,84 gram sukrosa
C12H22O11, Mr = 342 dilarutkan dalam air hingga
volumenya 100 ml . Jika R = 0,082 . Maka Tentukan
Tekanan Osmotik larutan tersebut !
>> 0 >> 1 >> 2 >> 3 >> 4 >>
SIFAT KOLIGATIF LARUTAN
ELEKTROLIT
• Untuk larutan elektrolit , maka persamaan sifat Koligatif
dipengaruhi oleh Faktor Van’t Hoff (i)
i = 1 + (n – 1)
Ket :
n = jumlah ion
= derajat ionisasi
P = Xt . Po. i
Tf = m . Kf .i
Tb = m . Kb . i
= M.R.T.i
>> 0 >> 1 >> 2 >> 3 >> 4 >>
Anda mungkin juga menyukai
- Kimia Larutan - Sifat Koligatif LarutanDokumen31 halamanKimia Larutan - Sifat Koligatif LarutanCaroline DonsiBelum ada peringkat
- 2.titik Beku & Titik Didih Larutan Presentasi Dan Diagram PTDokumen11 halaman2.titik Beku & Titik Didih Larutan Presentasi Dan Diagram PTAudrina ArdiantyBelum ada peringkat
- Pert-8 - Sifat Koligatif LarutanDokumen31 halamanPert-8 - Sifat Koligatif Larutanreza rahmadBelum ada peringkat
- SKL Part 2 (Jenis Jenis SKL)Dokumen21 halamanSKL Part 2 (Jenis Jenis SKL)Anisa Tri MufidahBelum ada peringkat
- LKPDDokumen12 halamanLKPDEstu RahajengBelum ada peringkat
- Koligatif 1Dokumen25 halamanKoligatif 1lova mikuBelum ada peringkat
- Laporan Praktikum Titik Beku LarutanDokumen9 halamanLaporan Praktikum Titik Beku LarutanPrayogi Arinda SetiyoriniBelum ada peringkat
- Kimia Titk Didih Dan BekuDokumen7 halamanKimia Titk Didih Dan Bekukarunia kudusBelum ada peringkat
- Penurunan Titik Beku Larutan XII MIA 1Dokumen2 halamanPenurunan Titik Beku Larutan XII MIA 1Imanuel AbrahamBelum ada peringkat
- Latihan 1 Koligatif NewDokumen9 halamanLatihan 1 Koligatif NewSriwidya PanjaitanBelum ada peringkat
- Sifat Koligatif Larutan 2Dokumen5 halamanSifat Koligatif Larutan 2msy wulandariBelum ada peringkat
- Sifat Koligatif LarutanDokumen31 halamanSifat Koligatif LarutanAnaaBelum ada peringkat
- Materi Kenaikan Titik Didih Dan Penurunan Titik Beku PDFDokumen6 halamanMateri Kenaikan Titik Didih Dan Penurunan Titik Beku PDFStevany CorputtyBelum ada peringkat
- Sifat KoligatifDokumen7 halamanSifat KoligatifOctavio Reinhart SusantoBelum ada peringkat
- Sifat Koligatif Larutan 2Dokumen15 halamanSifat Koligatif Larutan 2Vicky raihan akbar 068Belum ada peringkat
- Sifat Koligatif PresentasiDokumen21 halamanSifat Koligatif PresentasiVella IrnadiaBelum ada peringkat
- Kartu Soal - Rahmi - KimiaDokumen9 halamanKartu Soal - Rahmi - KimiaDini FitriaBelum ada peringkat
- Sifat Koligatif LarutanDokumen6 halamanSifat Koligatif LarutanthujunghBelum ada peringkat
- Rumus Sifat Koligatif Larutan Non Elektrolit Dan ElektrolitDokumen4 halamanRumus Sifat Koligatif Larutan Non Elektrolit Dan ElektrolitYu Indra50% (2)
- Sifat Koligatif LarutanDokumen17 halamanSifat Koligatif Larutantiur nababanBelum ada peringkat
- Hand Out Koligatif BaruDokumen6 halamanHand Out Koligatif BaruAnastasia MarcellinaBelum ada peringkat
- Kelompok 1 Kimia Farmasi DasarDokumen19 halamanKelompok 1 Kimia Farmasi DasarHafni OctavianiBelum ada peringkat
- Laporan Praktikum JiscDokumen6 halamanLaporan Praktikum JiscAnonymous Y9NO3bBZfOBelum ada peringkat
- Sifat Koligatif LarutanDokumen32 halamanSifat Koligatif LarutanIlham Faris PattiasinaBelum ada peringkat
- Percobaan 7Dokumen16 halamanPercobaan 7atik sofiahBelum ada peringkat
- Percobaan 8Dokumen5 halamanPercobaan 8SHINE SHINEBelum ada peringkat
- Sifat Koligatif Larutan..Dokumen4 halamanSifat Koligatif Larutan..Gerrard SitohangBelum ada peringkat
- Jawaban Penurunan Titik Beku LarutanDokumen7 halamanJawaban Penurunan Titik Beku Larutandwi rizkyBelum ada peringkat
- Lanjutan BAB IDokumen8 halamanLanjutan BAB INovi SafitriBelum ada peringkat
- Sifat Koligatif LarutanDokumen16 halamanSifat Koligatif LarutanWinarsaBelum ada peringkat
- Sifat Koligatif LarutanDokumen18 halamanSifat Koligatif LarutanAuliaBelum ada peringkat
- Panas NetralisasiDokumen14 halamanPanas NetralisasiJuandito YudhatamaBelum ada peringkat
- Sifat Koligatif Elektrolit Dan NonelektrolitDokumen29 halamanSifat Koligatif Elektrolit Dan NonelektrolitAnnisa Septian NurkhasanahBelum ada peringkat
- Sifat-Koligatif1, Untk Kuliah, Kul 2Dokumen47 halamanSifat-Koligatif1, Untk Kuliah, Kul 2Dicky HantaturiBelum ada peringkat
- Titik Beku Laporan TetapDokumen10 halamanTitik Beku Laporan TetapViva AlieBelum ada peringkat
- Sifat Koligatif LarutanDokumen24 halamanSifat Koligatif LarutanpostingkimiaBelum ada peringkat
- Sifat Koligatif LarutanDokumen22 halamanSifat Koligatif LarutanUntuk ViuBelum ada peringkat
- Bahan Ajar Kenaikan TDDokumen8 halamanBahan Ajar Kenaikan TDAfni Silpana MustofaBelum ada peringkat
- Bab 1 Sifat Koligatif LarutanDokumen36 halamanBab 1 Sifat Koligatif LarutanMiftakhul khassanahBelum ada peringkat
- Meet 4 - Boiling Point and Osmostic Pressure (Aeris, Aurel, Caroline, Max) 1Dokumen10 halamanMeet 4 - Boiling Point and Osmostic Pressure (Aeris, Aurel, Caroline, Max) 1MICHAEL MAX WILLIAMBelum ada peringkat
- KIMIADokumen11 halamanKIMIAMoch Saminuddin Al MadaniBelum ada peringkat
- Praktikum Kimia Uji Sifat Koligatif LarutanDokumen8 halamanPraktikum Kimia Uji Sifat Koligatif LarutanJufry CrystianicoBelum ada peringkat
- Sifat Koligatif LarutanDokumen19 halamanSifat Koligatif LarutanhtjlBelum ada peringkat
- Penurunan Titik BekuDokumen10 halamanPenurunan Titik BekuQya ZaqyaBelum ada peringkat
- VIDokumen12 halamanVIVy YhatBelum ada peringkat
- Powerpoint Kimia Kenaikan Titik DidihDokumen6 halamanPowerpoint Kimia Kenaikan Titik DidihNadya Audina100% (1)
- Sifat KoligatifDokumen18 halamanSifat KoligatifBeckham K2Belum ada peringkat
- Sifat Koligatif LarutanDokumen15 halamanSifat Koligatif LarutanWndyaprnaBelum ada peringkat
- Kenaikan Titik Didih LarutanDokumen8 halamanKenaikan Titik Didih LarutanOci RosaBelum ada peringkat
- Kelarutan: Pengaruh Suhu & TekananDokumen57 halamanKelarutan: Pengaruh Suhu & TekanannandaBelum ada peringkat
- Satuan Konsentrasi LarutanDokumen13 halamanSatuan Konsentrasi LarutanmisparahayuBelum ada peringkat
- Sifat Koligatif LarutanDokumen34 halamanSifat Koligatif LarutanthaniaBelum ada peringkat
- Contoh SoalDokumen22 halamanContoh SoalYohana Maretta SiagianBelum ada peringkat
- PerhitunganDokumen25 halamanPerhitunganika mawarniBelum ada peringkat
- PerhitunganDokumen25 halamanPerhitunganika mawarniBelum ada peringkat
- Larutan Dan Sifat Koligatif LarutanDokumen9 halamanLarutan Dan Sifat Koligatif LarutanKhazinatulBaitiaNazurah0% (1)
- Modul Al-Jainejad Kelas 3Dokumen75 halamanModul Al-Jainejad Kelas 3pupexBelum ada peringkat
- Kisi-Kisi Soal Pas Sej Xi Wajib Ganjil 22-23Dokumen3 halamanKisi-Kisi Soal Pas Sej Xi Wajib Ganjil 22-23Anisa RizaBelum ada peringkat
- Kisi-Kisi Pas Xi 2022 EkonomiDokumen4 halamanKisi-Kisi Pas Xi 2022 EkonomiAnisa RizaBelum ada peringkat
- Kisi Kisi Big X Xi Pas 22-23Dokumen4 halamanKisi Kisi Big X Xi Pas 22-23Anisa RizaBelum ada peringkat
- Kisi-Kisi Soal PAS Kimia 22-23Dokumen4 halamanKisi-Kisi Soal PAS Kimia 22-23Anisa RizaBelum ada peringkat