Aktivitas Elektrolit Kuat Kelarutan Dan Koefisien
Diunggah oleh
Yulianto Adi NugrohoDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Aktivitas Elektrolit Kuat Kelarutan Dan Koefisien
Diunggah oleh
Yulianto Adi NugrohoHak Cipta:
Format Tersedia
KELARUTAN, AKTIVITAS, DAN KOEFISIEN AKTIVITAS ELEKTROLIT KUAT
A. TUJUAN 1. Mengukur kelarutan Barium Iodat dalam larutan KCl dalam berbagai kekuatan ion. 2. Menghitung kelarutan Barium Iodat pada I= 0 dengan jalan ekstrapolasi. 3. Menghitung kefieien aktifitas rata-rata Barium Iodat pada berbagai nilai I dan menguji penggunaan hukum pembatas Debye-Huckle
B. WAKTU DAN TEMPAT Hari/ Tanggal : Rabu/ 27 April 2011 Pukul Tempat C. TEORI DASAR Salah satu cara untuk memperlihatkan bagaimana ketergantungan aktivitas ion pada kekuatan ion adalah dengan jalan mempelajari perubahan kelarutan elektrolit yang sedikit larut (misalnya Barium Iodat ) sebagai akibat adanya penambahan elektrolit lain(bukan ion senama, misalnya KCl). Agar hukum Debye-Huckle dapat digunakan, konsentrasi larutan elektrolit yang sedikit larut tersebut harusdapat diukur dengan tepat walaupun konsentrasinya rendah. Selain itu kelarutannya dalam air harus berada dalam batas kisaran hukum DebyeHuckle (yaitu kelarutan ion <0,01 M untuk elektrolit 1-1) Barium iodat adalah elektrolit yang memenuhi kriteria diatas dan konsentrasinya dapat ditentukan dengan menggunakan metoda volumetric yang sederhana. Dengan menganalisis data yang diperoleh akan didapat koefisien aktivitas rata-rata (). Aktivitas atau koefisien aktivitas suatu ion secara percobaan tidak dapat ditentukan, karena itu didefinisikan aktivitas rata-rata () dan koefisien aktivitas rata-rata () yang untuk elektrolit 1-2 (uni-bivalen) didefinisikan sebagai berikut : = (+-2)1/3 =(+-2)1/3 : 07.00 s/d 09.40 WIB :Laboratorium kimia fisika
c=(c+c-2)1/3 Bila nilai konsentrasi (c) dinyatakan dalam mol/liter, maka berdasarkan definisi diatas akan diperoleh: =c=K1/3=konstanta Dalam hal ini, K adalah hasil kali aktivitas kelarutan yang dapat diturunkan sebagai berikut : Ba(IO3)2 K=[Ba2+][IO3-]2 Misalnya, dalam larutan terdapat elektrolit lain yang tidak mengandung ion senama dengan Ba(IO3)2 misalnya KCl dan anggap kelarutan Ba(IO3)2 adalah s mol/liter, maka c+ (konsentrasi ion Ba2+ dalam larutan )=S mol/liter dan c- =(konsentrasi ion IO3- dalam larutan = 2s mol/liter. Dari persamaan (1) akan diperoleh : c=1,59S Dengan menggabungkan persamaan (5) dan (2) akan diperoleh : =konstanta=S0 Dimana S0 adalah kelarutan teoritis bila mendekati satu (=1) yaitu pada keadaan kekuatan ion sama dengan nol (I=0). Karena selalu menurun dengan meningkatnya kekuatan ion, maka baik kelarutan (S) dan hasil kali kelarutan (Ksp), dinyatakan dalam konsentrasi bukan dalam aktivitas. Jika nilai S0 dapat ditentukan dengan jalan ekstrapolasi, kekuatan ion sama dengan nol, maka pada berbagai konsentrasi akan dapat dihitung ( ) Ba2++2IO3-
Pada larutan elektrolit, S bergantung pada kekuatan ion yang didefinisikan sebagai : I=1/2CiZi2 Ci adalah konsentrasi ion ke i dalam mol/liter dan Zi adalah muatan ion ke i. Kekuatan ion harus dihitung berdasarkan semua ion yang ada dalam larutan. Nilai I terendah yang dapat digunakan untuk mengukur kelarutan dibatasi oleh kelarutan elektrolit
dalam air. Ekstrapolasi ke kekuatan ion sama dengan nol, dilakukan berdasarkan Teori Debye-Huckle untuk elektrolit kuat. Teori Debye-Huckle menyatakan bahwa untuk larutan dengan kekuatan ion yang rendah (<0,01 untuk elektrolit uni-bivalen (1-1)), koefisien aktivitas rata-rata sutu elektrolit yang berdisosiasi menjadi ion bermuatan Z+ dan Z-, dapat dihitung dengan menggunakan persamaan : log=-A(Z+Z-) A adalah tetapan dan untuk larutan dengan pelarut air pada suhu 250C nilainya adalah 0,509. Dengan menggabungkan persamaan (6) dan (8) untuk Barium Iodat akan diperoleh, LogS=logS0+2A1) Jadi pada kekuatan ion yang rendah, kurva log S sebagai fungsi 1 akan berupa garis lurus.
D. ALAT DAN BAHAN ALAT : 1. 2. 3. 4. 5. labu erlenmeyer 250 mL 8 buah Buret Labu takar 250 mL Labu takar 250 mL Pipet 25 mL
BAHAN 1. KCl 0,1 M 2. Ba(IO3)2
3. Na2S2O3 0,02 M 4. HCl 1 M 5. KI (0,5 gram/L)
6. Larutan kanji 1 %
E. PROSEDUR KERJA
Disiapkan 7 erlenmeyer
No labu larutan KCl (M) (50mL)
0,1
0,05
0,02
0,01
0,005
0,002
air
Tambah Ba(IO3)2 ke tiap labu hingga larutan jenuh, kemudian ditutup
Panaskan dalam penangas air bersuhu 500C 5 menit
Diamkan selama 1 hari
Saring @ larutan
Pipet @ 5 mL larutan, tambah KI 0,5 g/L
Tambah 0,4 mL HCl 1 M
Titrasi @ larutan dengan 0,02 M Na2S2O3 hingga kuning muda
Tambah 2 tetes larutan kanji 1 %
Titrasi lagi hingga larutan jernih
F. DATA PENGAMATAN No Labu Erlenmeyer 1 Konsentrasi HCl (M) 0.1 Jumlah Na2S2O3(mL) 2.9 Konsentrasi IO3- (M) 0.0116 5.8 10-3 -2.24 S Ba(IO3)2 Log S
2 3 4 5 6 7
0.05 0.02 0.01 0.005 0.002 0.001
1 7.6 1.9 0.2 1.2 0.8
0.004 0,0304 0.0076 0.008 0.0048 0.0032
2 10-3 15.2 10-3 3.8 10-3 4 10-3 2.4 10-3 1.6 10-3
-2.69 -1.82 -2.24 -2.39 -2.62 -2.79
No. Labu 1 2 3 4 5 6 7
I 0.1232 0.058 0.0808 0.0252 0.021 0.0116 0.0064
I 1/2 0.35 0.24 0.28 0.158 0.145 0.107 0.08
S0/S= 0.440 0.570 0.518 0.690 0.712 0.778 0.829
Log 0.3563 0.244 0.285 0.1608 0.147 0.1089 0.081
G. PERHITUNGAN 1. Perhitungan Konsentrasi IO3 untuk masing-masing labu adalah :
Ba(IO3)2 Ba 2+ + 2IO3Na2S2O3 2Na+ + S2O32-
S2O32- ~ 2IO3V1 M1 = V2 M2
Rumus yang digunakan untuk menentukan konsentrasi [ IO3- ] adalah : [ IO3- ] =
[ S 2O32]volumeS2O32 volumeIO3
Untuk Labu 1 [ IO3- ] =
0,02M 2,9mL 5mL
= 0.0116 M
Untuk Labu 2 [ IO3- ] =
0,02M 1mL 5mL
= 0.004 M
Untuk Labu 3 [ IO3- ] =
0,02M 7.6mL 5mL
= 0.0304 M
Untuk Labu 4 [ IO3- ] =
0,02M 1.9mL 5mL
= 0.0076 M
Untuk Labu 5 [ IO3- ] =
0,02M 0.2mL 5mL
= 0.008 M
Untuk Labu 6
[ IO3- ] =
0,02M 1.2mL 5mL
= 0.0048 M
Untuk Labu 7 [ IO3- ] =
0,02M 0.8mL 5mL
= 0.0032M
2. Perhitungan kelarutan Barium Iodat adalah : Ba(IO3)2 Ba 2+ + 2IO3S 2S
Sehingga, S Ba(IO3)2 = [IO3-] Untuk Labu 1 S Ba(IO3)2 = 0,0116 = 5.8 10-3 Untuk Labu 2 S Ba(IO3)2 = 0,004 = 2 10-3 Untuk Labu 3 S Ba(IO3)2 = 0.0304 = 15.2 10-3 Untuk Labu 4 S Ba(IO3)2 = 0,0076 = 3.8 10-3 Untuk Labu 5 S Ba(IO3)2 = 0.008 = 4 10-3 Untuk Labu 6 S Ba(IO3)2 = 0.0048 = 2.4 10-3 Untuk Labu 7 S Ba(IO3)2 = 0.0032 = 1.6 10-3
3.
Perhitungan kekuatan ion (I) untuk berbagai konsentrasi KCl adalah :
I = Ci Zi2 Ion-ion yang terlibat : KCl K+ + ClBa(IO3)2 Ba 2+ + 2IO3I = CiZi2 I = { [K+]ZK+2 +[Cl-]ZCl-2 + [Ba2+]ZBa2+2 + 2[IO3-]ZIO3-2} I = { [K+](+1)2 +[Cl-](-1)2 + [Ba2+](+2)2 + 2[IO3-](-1)2} I = { [K+] +[Cl-] + 4[Ba2+]+ 2[IO3-]}
[K+] = [Cl-] = [KCl] [Ba2+] = [IO3-] = [Ba(IO3)2]
Untuk Labu 1 [K+] = [Cl-] = [KCl] = 0,1 M [Ba2+] = [IO3-] = (0.0116) = 0.0058 I = { (0,1) + (0,1) + 4 ( 0,0058 ) + 2( 0,0116 ) }= 0,1232
Untuk Labu 2 [K+] = [Cl-] = [KCl] = 0,05 M [Ba2+] = [IO3-] I = (0,004) = 0,002
= { (0,05) + (0,05) + 4 ( 0,002) + 2( 0,004) }= 0,058
Untuk Labu 3 [K+] = [Cl-] = [KCl] = 0,02 M [Ba2+] = [IO3-] I = (0,0304) = 0,0152
= { (0,02) + (0,02) + 4 ( 0,0152) + 2( 0,0304 ) }= 0,0808
Untuk Labu 4
[K+] = [Cl-] = [KCl] = 0,01 M [Ba2+] = [IO3-] I = (0,0076 ) = 0,0038
= { (0,01) + (0,01) + 4 ( 0,0038 ) + 2( 0,0076 ) }= 0,0252
Untuk Labu 5 [K+] = [Cl-] = [KCl] = 0,005 M [Ba2+] = [IO3-] I = (0,008) = 0,004
= { (0,005) + (0,005) + 4 ( 0,004 ) + 2( 0,008 ) }= 0,021
Untuk Labu 6 [K+] = [Cl-] = [KCl] = 0,002 M [Ba2+] = [IO3-] I = (0,0048 ) = 0,0024
= { (0,002) + (0,002) + 4 ( 0,0024 ) + 2( 0,0048 ) }= 0,0116
Untuk Labu 7 [K+] = [Cl-] = [KCl] = 0 M [Ba2+] = [IO3-] I = (0,0032 ) = 0,0064
= { (0) + (0) + 4 ( 0,0016 ) + 2( 0,0032 ) }= 0,0064
4. Perhitungan Koefisoen Aktivitas rata-rata () :
a. Secara eksperimental Ba(IO3)2 Ba 2+ + 2IO3Ka = [Ba 2+] [IO3-]2 So = =
So S
b. Secara Teoritis Pada labu 1 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,35) log = -0,509 (2) ( 0,35) log = -0,3563 = 0,440 Pada labu 2 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,24) log = -0,509 (2) (0,24 ) log = -0,244 = 0,570
Pada labu 3 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,28) log = -0,509 (2) (0,28) log = -0,285 = 0,518
Pada labu 4 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,158)
log = -0,509 (2) (0,158) log = -0,1608 = 0,69
Pada labu 5 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,145) log = -0,509 (2) ( 0,145) log = -0,147 = 0,712
Pada labu 6 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,107) log = -0,509 (2) ( 0,107) log = -0,1089 = 0,778
Pada labu 7 log = -0,509 | Z+Z-| (I) log = -0,509 |(+2)(-1)| (0,08) log = -0,509 (2) ( 0,08) log = -0,081 = 0,829
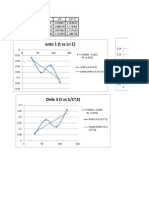
Kurva Log S sebagai fungsi dari I1/2 log = -A | Z+Z-| I log = -A | (+2) (-1) | I
Log So Log S = -2 A I1/2 Log S = Log So + 2A I
+ b
Slope Intersep
= 2A = Log S0
Persamaan regresi dari Log S vs I
Log S (y) -2,24 -2,69 -1,82 -2,42 -2,39 -2,62 -2,79 y = -16,97
I (x) 0,35 0,24 0,28 0,158 0,145 0,107 0,08 x = 1,36
xy -0,784 -0,6456 -0,5096 -0,382 -0,346 -0,280 -0,223 xy = -3,1702
x2 0,1225 0,0576 0,0784 0,025 0,021 0,011 0,0064 x2=0,3219
X rata-rata Y rata-rata Persamaan regesi Y
= =
= a+bx
( (
)( ) (
b b
= = 0,213
)( ( )
y - bx
= -2,424 0,213 0,194 = -2,465
Sehingga persamaan regresinya adalah y = a + bx = -2,465 + 0,213 Atau log S = log So + 2 AI Log S0 = a Slop(tan ) H. PEMBAHASAN = = -2,465 (intersep) = 0,213
Pada percobaaan ini kita akan menentukan kelarutan Barium Iodat dalam larutan KCl dalam berbagai kekuatan ion atau dalam berbagai konsentrasi larutan KCl. Percobaan kali ini, pada prinsipnya berdasarkan pada ketergantungan aktifitas ion pada kekuata ion dengan adanya perubahan kelarutan dari larutan Barium Iodat dimana perubahan kelarutan ini diakibatkan oleh penambahan sejumlah larutan elektrolit lain. Larutan elektrolit lain yang kita gunakan ( bukan ion senama ) yaitu KCl dimana larutan Barium IOdat dilarutkan pada larutan KCl dengan konsentrasi yang berbeda-beda yaitu 0,1 ; 0,05; 0,02; 0,01; 0,005; dan 0,002 M dan dalam air. Untuk menentukan konsentrasi IO3- yang terlarut dalam KCl kita mentitrasi larutan Barium Iodat dengan menggunakan larutan Natrium Tiosulfat (Na2S2O3). Menurut teori, semakin kecil konsentrasi KCl, akan semakin besar Volume larutan Na2S2O3 yang dibutuhkan untk proses titrasi larutan Barium Iodat. Tetapi dari hasil percobaan terdapat sedikit penyimpangan, yaitu pada konsentrasi KCl 0,05M, 0,02M, dan 0,005M dimana volume Na2S2O3 yang dibutuhkan tidak sesuai dengan teori. Volume Na2S2O3 untuk KCl 0,05M cukup sedikit, untuk KCl 0,02M sangat besar, dan untuk KCl 0,005M sangat sedikit. Hal ini disebabkan kesalahan dalam menentukan perubahan warna pada saat proses titrasi. Kita dapat menentukan konsentari IO3- pada masing-masing Erlenmeyer dengan menggunakan rumus pengenceran yaitu V1 M1 = V2 M2. Dari harga konsentrasi IO3- inilah, kita juga bisa menntukan kelarutan Barium Iodat pada masingmasing Erlenmeyer. Dimana kelarutan Ba(IO3)2 = [IO3-] Berdasarkan data yang telah diperoleh, didapatkan koefisien aktifitas rata-rata () bertambah dengan berkurangnya konsentrasi KCL. Hal ini sesuai dengan teori yang menyatakan bahwa () senderung menurun dengan meningkatnaya kekuatan ion. Konsentasi IO3- dan kelarutan Barium Iodat akan semakin besar jika konsentrasi KCl juga semakin besar. Hal ini disebabkan karena semakin besar konsentrasi KCl maka kekuatan ion juga semakin besar. Dari semua data yang telah kita peroleh, kita dapat membuat kurva Log S sebagai Fungi dari I1/2 dan kurva () sebagai fungsi dari I1/2. seharusnya kurva Log S vs I
berupa
garis lurus dengan intersep So dan slope = A. tapi kurva yang kami dapatkan tidak demikian, melainkan membentuk garis yang naik turun. Kelarutan teoritis Barium Iodat dapat diketahui secara ekstrapolasi. Dari kurva Log sebagai fungsi I. Dan dapat ditarik kesimpulan bahwa semakin meningkatnya kekuatan ion, koefisien aktifitas rata-rata cenderung menurun.
I. KESIMPULAN 1. Semakin kecil konsentrasi KCl, maka volume Na2S2O3 yang dibutuhkan semakin besar. 2. Semakin besar konsentrasi KCl, semakin besar pula kekuatan ion. 3. Ketergantungan aktivitas ion dapat dilihat dengan menggunakan rumus DebyeHuckle. 4. Harga koefisien aktivitas rata-rata cenderung menurun dengan meningkatnya kekuatan ion.
DAFTAR PUSTAKA Bird, Tony. 1987. Penuntun Praktikum Kimia Fisika Untuk Universitas. Jakarta: Erlangga Sukoharjo. 1989. Kimia Fisika. Jakarta: PT. Rineka Cipta Syukri, Hardeli. 1999. Kimia Fisika 1. Padang: UNP Tim Kimia Fisika. 2011. Penuntun Praktikum Kimia Fisika 1. Padang: UNP
Anda mungkin juga menyukai
- Penentuan Kelarutan Dan Koefisien Aktivitas Elektrolit KuatDokumen25 halamanPenentuan Kelarutan Dan Koefisien Aktivitas Elektrolit KuatAyu C. RahmaBelum ada peringkat
- Kelarutan Dan Koefisien Aktivitas Elektrolit KuatDokumen14 halamanKelarutan Dan Koefisien Aktivitas Elektrolit KuatKristalia LiaaBelum ada peringkat
- Kelarutan Dan Koefisien Aktivitas Elektrolisis KuatDokumen14 halamanKelarutan Dan Koefisien Aktivitas Elektrolisis KuatayuBelum ada peringkat
- Kelarutan Dan Koefisien Aktivitas Elektrilit KuatDokumen16 halamanKelarutan Dan Koefisien Aktivitas Elektrilit KuatVinna Durrotul AzizahBelum ada peringkat
- OugsodDokumen14 halamanOugsodalfiBelum ada peringkat
- Any Kelarutan Dan Koefisien Aktivitas Elektrolit KuatDokumen16 halamanAny Kelarutan Dan Koefisien Aktivitas Elektrolit KuatAdolf FebriantoBelum ada peringkat
- Cara Membuat Larutan H2SO4 1 N Dalam 1000 MLDokumen4 halamanCara Membuat Larutan H2SO4 1 N Dalam 1000 MLeko nuraini100% (1)
- Pembuatan Asam Asetat Dengan NormalitasDokumen4 halamanPembuatan Asam Asetat Dengan Normalitaseko nurainiBelum ada peringkat
- 1A - Dina Ajeng Septia Azhari - 1918331 - ION SEJENISDokumen11 halaman1A - Dina Ajeng Septia Azhari - 1918331 - ION SEJENISmamanBelum ada peringkat
- Data Pengamatan Kelarutan Dan Koefisien Aktivitas Elektrolit KuatDokumen11 halamanData Pengamatan Kelarutan Dan Koefisien Aktivitas Elektrolit KuatAldaBelum ada peringkat
- Pendalaman Materi Soal Utbk - 2021 - BDokumen9 halamanPendalaman Materi Soal Utbk - 2021 - BLuvi Dwi UtamiBelum ada peringkat
- Kesetimbangan Kelarutan (Buku)Dokumen10 halamanKesetimbangan Kelarutan (Buku)nurismiyanti putriBelum ada peringkat
- Kelompok 3 1D Ion Sejenis-3Dokumen11 halamanKelompok 3 1D Ion Sejenis-3sopiahBelum ada peringkat
- Aktiv Lap Kelarutan Dan Koefisien Aktivitas Elektrilit KuatDokumen28 halamanAktiv Lap Kelarutan Dan Koefisien Aktivitas Elektrilit KuatrimaindriBelum ada peringkat
- Aktifitas Dan Koefisien AktifitasDokumen19 halamanAktifitas Dan Koefisien AktifitasRere NarendraBelum ada peringkat
- Pembahasan UTBK Kimia 2017Dokumen8 halamanPembahasan UTBK Kimia 2017Novita SariBelum ada peringkat
- Soal Objektif Dan ESSAY Kimia Analitik KonduktometriDokumen43 halamanSoal Objektif Dan ESSAY Kimia Analitik KonduktometriToni Ardi100% (3)
- Percobaan 2 Kimia FisikDokumen7 halamanPercobaan 2 Kimia FisikAkbar SyaifarizBelum ada peringkat
- Kelarutan Dan Hasil Kali Kelarutan1Dokumen8 halamanKelarutan Dan Hasil Kali Kelarutan1Alfin ChandraBelum ada peringkat
- KimiaDokumen19 halamanKimiaFikriAuliaNugrahaBelum ada peringkat
- UAS KimiaDokumen7 halamanUAS KimiaMariyatul QibtiyyahBelum ada peringkat
- Dokumen - Tips Latihan Soal Faktor Gravimetri Kimia AnalitikDokumen16 halamanDokumen - Tips Latihan Soal Faktor Gravimetri Kimia Analitikbenjamin panjaitanBelum ada peringkat
- Kesetimbangan KimiaDokumen6 halamanKesetimbangan KimiaIfat TasnimBelum ada peringkat
- KSPDokumen12 halamanKSPrdpBelum ada peringkat
- Bahan Ajar RedoksDokumen42 halamanBahan Ajar RedoksMochamadIqbalJaelaniBelum ada peringkat
- Bahan Diskusi m4 kb3Dokumen5 halamanBahan Diskusi m4 kb3Biyah AdjahBelum ada peringkat
- Oke Siap Laporan Praktikum Keasaman Ion Logam TerhidratDokumen10 halamanOke Siap Laporan Praktikum Keasaman Ion Logam Terhidratcitra septi agi ripyantikaBelum ada peringkat
- Oke Siap Laporan Praktikum Keasaman Ion Logam TerhidratDokumen10 halamanOke Siap Laporan Praktikum Keasaman Ion Logam Terhidratcitra septi agi ripyantikaBelum ada peringkat
- PERCOBAAN - 1 - Keasaman Ion Logam TerhidratDokumen13 halamanPERCOBAAN - 1 - Keasaman Ion Logam TerhidratAfsari AmiatiBelum ada peringkat
- PembahasannDokumen14 halamanPembahasannSri Rizki HardiantiBelum ada peringkat
- Selasa Penentuan Kadar Asam Askorbat PDFDokumen8 halamanSelasa Penentuan Kadar Asam Askorbat PDFIkeu NurafifahBelum ada peringkat
- Soal Kimia OprecDokumen5 halamanSoal Kimia OprecReza AlfarabiBelum ada peringkat
- Kesetimbangan KelarutanDokumen25 halamanKesetimbangan KelarutanRahmawati Nirmala SariBelum ada peringkat
- KD2-5, 6 Kesetimbangan PengendapanDokumen22 halamanKD2-5, 6 Kesetimbangan PengendapanEphram GunawanBelum ada peringkat
- Keset LarutanDokumen11 halamanKeset LarutanYuli YantiBelum ada peringkat
- Soal SBM Paket 1Dokumen10 halamanSoal SBM Paket 1Silvia Widi YantiBelum ada peringkat
- Titrasi IodometriDokumen6 halamanTitrasi IodometriNurul Farhah FBelum ada peringkat
- Soal Sulit Cek Lagi Ya BelloDokumen18 halamanSoal Sulit Cek Lagi Ya BelloAisyahBelum ada peringkat
- 1Dokumen3 halaman1Murni KanoliBelum ada peringkat
- Kelarutan Dan KSPDokumen19 halamanKelarutan Dan KSPpostingkimia100% (1)
- Kunci Pre Test KimiaDokumen10 halamanKunci Pre Test KimiaKhairaBelum ada peringkat
- Soal FiksDokumen7 halamanSoal Fikssepti handayaniBelum ada peringkat
- Soal Kaf Pendidikan Kimia 18-CDokumen12 halamanSoal Kaf Pendidikan Kimia 18-Cdevy ridaBelum ada peringkat
- KSP Kimia Kiki BaruuuuDokumen9 halamanKSP Kimia Kiki BaruuuuRizky NabilaBelum ada peringkat
- Ke Setim Bang AnDokumen13 halamanKe Setim Bang AnLuzi Jasmi Indriana ZahrohBelum ada peringkat
- NM (1) NbgffgygyugDokumen173 halamanNM (1) NbgffgygyugEka WahyuniBelum ada peringkat
- 06 Kesetimbangan RedoksDokumen29 halaman06 Kesetimbangan RedoksBayu Khalifa MuttaqinBelum ada peringkat
- Ion Sejenis Lparak KElompok 3 PDFDokumen12 halamanIon Sejenis Lparak KElompok 3 PDFsopiahBelum ada peringkat
- Titrasi DGN IodometriDokumen9 halamanTitrasi DGN IodometriAnna SutrianahBelum ada peringkat
- Latihan Soal KA DEP-1-BDokumen3 halamanLatihan Soal KA DEP-1-BMaryam EradewiBelum ada peringkat
- Kelarutan DEWDokumen10 halamanKelarutan DEWArif BudimanBelum ada peringkat
- 12 IPA - GTest 4 Soal - KimiaDokumen8 halaman12 IPA - GTest 4 Soal - KimiaCoffee TeaBelum ada peringkat
- Latihan Ujian Sekolah Kelas XiiDokumen29 halamanLatihan Ujian Sekolah Kelas XiiNovian AgniBelum ada peringkat
- Latihan Soal KSM Kimia TerintegrasiDokumen5 halamanLatihan Soal KSM Kimia TerintegrasiNisa YanisaBelum ada peringkat
- Laporan Kimfis KSP - Kelompok 2 Off I 2017Dokumen8 halamanLaporan Kimfis KSP - Kelompok 2 Off I 2017Karina KurniaBelum ada peringkat
- Uji Profil DisolusiDokumen12 halamanUji Profil DisolusiYulianto Adi NugrohoBelum ada peringkat
- Makalah KimiaDokumen5 halamanMakalah KimiaYulianto Adi NugrohoBelum ada peringkat
- G RAFIKDokumen6 halamanG RAFIKYulianto Adi NugrohoBelum ada peringkat
- Bab 3 - Kimia UnsurDokumen49 halamanBab 3 - Kimia UnsurRafidan Alif FakriBelum ada peringkat
- Presentation PaperDokumen40 halamanPresentation PaperYulianto Adi NugrohoBelum ada peringkat
- Resume PPT Pemisahan LanjutDokumen1 halamanResume PPT Pemisahan LanjutYulianto Adi NugrohoBelum ada peringkat
- Tabel Kegiatan Magang MahasiswaDokumen4 halamanTabel Kegiatan Magang MahasiswaYulianto Adi NugrohoBelum ada peringkat
- LPJ TpaDokumen4 halamanLPJ TpaYulianto Adi NugrohoBelum ada peringkat
- Sifatperiodikunsur LibreDokumen2 halamanSifatperiodikunsur LibreYulianto Adi NugrohoBelum ada peringkat
- Irwansyah StereokimiaDokumen6 halamanIrwansyah StereokimiaYulianto Adi NugrohoBelum ada peringkat
- Makalah KimiaDokumen5 halamanMakalah KimiaYulianto Adi NugrohoBelum ada peringkat
- Pengaruh Temperatur Dan PH Terhadap Kestabilan Enzim Xilanase Termofilik Bacillus SP Hasil Fraksinasi Dengan Ammonium Sulfat (Ringkasan)Dokumen1 halamanPengaruh Temperatur Dan PH Terhadap Kestabilan Enzim Xilanase Termofilik Bacillus SP Hasil Fraksinasi Dengan Ammonium Sulfat (Ringkasan)Yulianto Adi NugrohoBelum ada peringkat
- Nessler Totanver JadieeDokumen7 halamanNessler Totanver JadieeToniBelum ada peringkat
- Hikmatud Daroini Praktikum PolarimeterDokumen14 halamanHikmatud Daroini Praktikum PolarimeterYulianto Adi NugrohoBelum ada peringkat
- Nessler Totanver JadieeDokumen7 halamanNessler Totanver JadieeToniBelum ada peringkat
- Isbd Fix!Dokumen16 halamanIsbd Fix!Yulianto Adi NugrohoBelum ada peringkat
- Percobaan 6Dokumen16 halamanPercobaan 6Yulianto Adi NugrohoBelum ada peringkat
- Jawaban No 10Dokumen1 halamanJawaban No 10Yulianto Adi NugrohoBelum ada peringkat
- Envi EduDokumen8 halamanEnvi EduYulianto Adi NugrohoBelum ada peringkat
- Argento MetriDokumen2 halamanArgento MetriYulianto Adi NugrohoBelum ada peringkat
- Analisis KAtionDokumen9 halamanAnalisis KAtionYulianto Adi NugrohoBelum ada peringkat
- Handout Instrumen Uv Vis Susi 1Dokumen32 halamanHandout Instrumen Uv Vis Susi 1MarianusAmaKiiBelum ada peringkat
- Bahaya Limbah Deterjen Terhadap Lingkungan Dan KesehatanDokumen9 halamanBahaya Limbah Deterjen Terhadap Lingkungan Dan KesehatanYulianto Adi NugrohoBelum ada peringkat
- GravimetriDokumen18 halamanGravimetriiki_zoidBelum ada peringkat
- Resume Jurnal Detection of Cryptosporidium SP Infection by PCR and Modifi Ed Acid FastDokumen1 halamanResume Jurnal Detection of Cryptosporidium SP Infection by PCR and Modifi Ed Acid FastYulianto Adi NugrohoBelum ada peringkat
- 4 Kesetimbangan Kimia PDFDokumen14 halaman4 Kesetimbangan Kimia PDFbennypatriaBelum ada peringkat
- Kalorimeter BOMDokumen2 halamanKalorimeter BOMYulianto Adi NugrohoBelum ada peringkat
- Modul P AnorDokumen42 halamanModul P AnorYulianto Adi NugrohoBelum ada peringkat
- Penjelasan Program Array Mengurutkan Data Dari Terbesar Ke TerkecilDokumen2 halamanPenjelasan Program Array Mengurutkan Data Dari Terbesar Ke TerkecilYulianto Adi NugrohoBelum ada peringkat
- Tugas Kimia LingkunganDokumen2 halamanTugas Kimia LingkunganYulianto Adi NugrohoBelum ada peringkat