Partikel Dasar
Diunggah oleh
sixskaaprianaDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Partikel Dasar
Diunggah oleh
sixskaaprianaHak Cipta:
Format Tersedia
1.
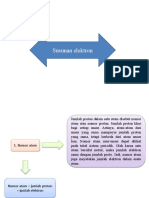
Partikel Dasar Walaupun pada awalnya atom diartikan sebagai partikel terkecil yang tidak dapat dibagi lagi, tetapi dalam perkembangannya ternyata ditemukan bahwa atom tersusun atas tiga jenis partikel sub-atom (partikel dasar), yaitu proton, elektron, dan neutron. Massa partikel dasar dinyatakan dalam satuan massa atom (sma), dimana 1 sma = 1,66 1024 gram. Sedangkan muatan partikel dasar dinyatakan sebagai muatan relatif terhadap muatan elektron (e), di mana muatan 1 elektron = e = 1,60 1019 coloumb. Muatan 1 proton sama dengan muatan 1 elektron, tetapi tandanya berbeda. Massa 1 proton sama dengan massa 1 neutron, masing-masing 1 sma. Massa elektron lebih kecil daripada massa proton atau neutron. 2. Susunan Atom Henry Gwyn-Jeffreys Moseley (1887 1915) pada tahun 1913 menemukan bahwa jumlah muatan positif dalam inti atom merupakan sifat khas masing-masing unsur. Atomatom dari unsur yang sama memiliki jumlah muatan positif yang sama. Moseley kemudian mengusulkan agar istilah nomor atom diberi lambang Z, untuk menyebutkan jumlah muatan positif dalam inti atom. Nomor atom unsur menunjukkan jumlah proton dalam inti. Setelah dilakukan percobaan, diketahui bahwa atom tidak bermuatan listrik yang berarti dalam atom jumlah muatan positif sama dengan jumlah muatan negatif, sehingga nomor atom juga menunjukkan jumlah elektron dalam unsur. Nomor atom (Z) = jumlah proton = jumlah elektron Misalnya, unsur oksigen memiliki nomor atom 8 (Z = 8), berarti dalam atom oksigen terdapat 8 proton dan 8 elektron. Selain nomor atom, ada juga yang disebut dengan nomor massa yang biasanya diberi lambang A. Nomor massa ini digunakan untuk menentukan jumlah nukleon dalam atom suatu unsur. Nukleon sendiri adalah partikel penyusun inti atom yang terdiri dari proton dan neutron. A(nomor massa) = jumlah proton (p) + jumlah neutron (n) Dalam penulisan atom, nomor massa (A) ditulis di sebelah kiri atas, sedangkan nomor atom (Z) ditulis di sebelah kiri bawah dari lambang unsur.
Untuk ion (atom bermuatan positif atau negatif) maka notasi ion, jumlah proton, neutron, dan elektron adalah:
Catatan
Untuk atom netral, jumlah proton sama dengan jumlah elektron. Untuk ion positif, jumlah proton (muatan positif) lebih banyak daripada elektron (muatan negatif). Untuk ion negatif, jumlah elektron (muatan negatif) lebih banyak daripada proton (muatan positif).
Contoh: 1. mempunyai jumlah proton, neutron, dan elektron sebagai berikut. p=Z=6 n = A Z = 12 6 = 6 Karena atom netral (tak bermuatan) maka e = p = 6. 2. Pada ion mempunyai jumlah proton, neutron, dan elektron sebagai berikut. p=Z=9 n = A Z = 19 9 = 10 Karena muatan F adalah 1 maka r = 1, sehingga: e = p + r = 9 + 1 = 10 3. mempunyai jumlah proton, neutron, dan elektron sebagai berikut: p = Z = 38 n = A Z = 88 38 = 50 Karena muatan Sr adalah 2+, maka q = 2 sehingga: e = p q = 38 2 = 36
Anda mungkin juga menyukai
- Kimia 4Dokumen3 halamanKimia 4Mujibul RijalBelum ada peringkat
- Materi - 6 - STRUKTUR ATOM - TKR - TPMDokumen3 halamanMateri - 6 - STRUKTUR ATOM - TKR - TPMPuputh Teea'Belum ada peringkat
- Memahami Struktur AtomDokumen25 halamanMemahami Struktur AtomImam TaufikBelum ada peringkat
- Elektron Proton Neutron Mengenal Partikel Dan Notasi AtomDokumen9 halamanElektron Proton Neutron Mengenal Partikel Dan Notasi AtomNaCL ChannelBelum ada peringkat
- Modul Partikel Penyusun AtomDokumen7 halamanModul Partikel Penyusun AtomRiska AriastutiBelum ada peringkat
- Modul Struktur AtomDokumen12 halamanModul Struktur AtomHer Lan SuherlanBelum ada peringkat
- Partikel Dasar Penyusun AtomDokumen2 halamanPartikel Dasar Penyusun AtomayudianpurnamaBelum ada peringkat
- Materi Atom Dan PenyusunnyaDokumen4 halamanMateri Atom Dan Penyusunnya25 Risma devaBelum ada peringkat
- 3 Partikel Penyusun AtomDokumen6 halaman3 Partikel Penyusun AtomSMK KESEHATAN AZZA WA JALLABelum ada peringkat
- Sistem Periodik UnsurDokumen73 halamanSistem Periodik UnsurDesinta SuciBelum ada peringkat
- Nomor ATOM - Nomor MASSA - Notasi UnsurDokumen7 halamanNomor ATOM - Nomor MASSA - Notasi UnsurSalsabila LalaBelum ada peringkat
- Materi Partikel Dasar Penyusun AtomDokumen3 halamanMateri Partikel Dasar Penyusun Atomhasrining husainBelum ada peringkat
- Materi Struktur AtomDokumen4 halamanMateri Struktur Atomjej jjaBelum ada peringkat
- Struktur AtomDokumen28 halamanStruktur Atomerwin jmBelum ada peringkat
- Struktur Atom Dan Sistem PeriodikDokumen14 halamanStruktur Atom Dan Sistem PeriodikFahmi HidayatBelum ada peringkat
- Materi 2 Struktur Atom Dan Sistem Periodik Unsur Pembelajaran 4: Perkembangan Model Atom Dan Partikel Penyusun Atom Definisi AtomDokumen16 halamanMateri 2 Struktur Atom Dan Sistem Periodik Unsur Pembelajaran 4: Perkembangan Model Atom Dan Partikel Penyusun Atom Definisi AtomevavatonahgmailcomBelum ada peringkat
- A. Prin 1 Kertas Isi 2 HalamanDokumen80 halamanA. Prin 1 Kertas Isi 2 HalamanI Gede SudarmaBelum ada peringkat
- Struktur Atom Dan SpuDokumen6 halamanStruktur Atom Dan SpuMuhamad SobariBelum ada peringkat
- Isotop, Isobar, IsotonDokumen36 halamanIsotop, Isobar, Isotonمحمدفتح ألر شيدBelum ada peringkat
- Bab III (Kimia X)Dokumen61 halamanBab III (Kimia X)NeenkzheeBelum ada peringkat
- BAHAN AJAR Inti AtomDokumen4 halamanBAHAN AJAR Inti AtomAdina Widi AstutiBelum ada peringkat
- Inti AtomDokumen13 halamanInti AtomMeiniaBelum ada peringkat
- Partikel Dasar Penyusun AtomDokumen3 halamanPartikel Dasar Penyusun Atomrbayu1396Belum ada peringkat
- Struktur AtomDokumen9 halamanStruktur AtomFazrul RahmanBelum ada peringkat
- Struktur AtomDokumen9 halamanStruktur AtomAnnisa MutiaraBelum ada peringkat
- 02 Struktur Atom Dan Tabel PeriodikDokumen38 halaman02 Struktur Atom Dan Tabel PeriodikRakhmi Setyani SartikaBelum ada peringkat
- MATERI (Atom, Molekul, Dan Ion)Dokumen42 halamanMATERI (Atom, Molekul, Dan Ion)K SendjajaBelum ada peringkat
- Kedokteran Nuklir - T1 Prinsip Dasar Fisika Atom Dan IntiDokumen12 halamanKedokteran Nuklir - T1 Prinsip Dasar Fisika Atom Dan IntiIsmu Fikrul'Ulla Agas PutraBelum ada peringkat
- K10 - Kim AtomDokumen15 halamanK10 - Kim AtomjahejoteBelum ada peringkat
- Bahan Ajar KD 3.3Dokumen14 halamanBahan Ajar KD 3.3Fahmi IrfanBelum ada peringkat
- MateriDokumen8 halamanMateriQuilea XuBelum ada peringkat
- Makalah Inti Atom Xii Mipa 2Dokumen8 halamanMakalah Inti Atom Xii Mipa 2Drama Terlengkap SubindoBelum ada peringkat
- Nomor Atom Dan Nomor MassaDokumen3 halamanNomor Atom Dan Nomor Massafariz rezaBelum ada peringkat
- Modul Kimia Dasar Pertemuan 2Dokumen18 halamanModul Kimia Dasar Pertemuan 2septianiBelum ada peringkat
- Atom Dan Nomor MassaDokumen3 halamanAtom Dan Nomor MassaMuh HidayatBelum ada peringkat
- Penyusun AtomDokumen5 halamanPenyusun AtomanggipradaniBelum ada peringkat
- D1 Struktur AtomDokumen4 halamanD1 Struktur AtomArif SarifudinBelum ada peringkat
- X TKR 3Dokumen8 halamanX TKR 3maxrophoneBelum ada peringkat
- Inti Atom Dan Radioaktivitas (Fix)Dokumen16 halamanInti Atom Dan Radioaktivitas (Fix)Miftahul Fauzan HanraBelum ada peringkat
- Nomor AtomDokumen2 halamanNomor AtomSyifa RizkiBelum ada peringkat
- Partikel Penyusun AtomDokumen5 halamanPartikel Penyusun AtomFitriani ParinduriBelum ada peringkat
- Notasi AtomDokumen1 halamanNotasi Atomghost killerBelum ada peringkat
- DIKTAT - FISIKA - INTI - Doc Filename UTF-8''DIKTAT FISIKA INTIDokumen55 halamanDIKTAT - FISIKA - INTI - Doc Filename UTF-8''DIKTAT FISIKA INTIliskaBelum ada peringkat
- Struktur AtomDokumen26 halamanStruktur AtomDebbylia AnggrainyBelum ada peringkat
- Ikatan Kimia BookDokumen12 halamanIkatan Kimia BookKuring MangdepeBelum ada peringkat
- Struktur AtomDokumen6 halamanStruktur AtomYola MalauBelum ada peringkat
- AtomDokumen22 halamanAtomJimi JumatullahBelum ada peringkat
- Struktur & Ikatan Atom Bahan TeknikDokumen14 halamanStruktur & Ikatan Atom Bahan TeknikRozi Faqih 17Belum ada peringkat
- Bahan Ajar Kls XDokumen14 halamanBahan Ajar Kls XDesi IndrawatiBelum ada peringkat
- Makalah KLP 4Dokumen13 halamanMakalah KLP 4I Ketut SuenaBelum ada peringkat
- Struktur Atom - Kelompok 2Dokumen48 halamanStruktur Atom - Kelompok 2Muhammad Yudha RamdhaniBelum ada peringkat
- AtomDokumen2 halamanAtomKiki CihayBelum ada peringkat
- Rangkuman Kimia SMADokumen18 halamanRangkuman Kimia SMAyayaBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen16 halamanStruktur Atom Dan Sistem Periodik UnsurUjang RohayaBelum ada peringkat
- KDDokumen7 halamanKDpujiBelum ada peringkat
- Materi Susunan AtomDokumen8 halamanMateri Susunan Atomnhing altingBelum ada peringkat
- BAHAN AJAR ATOM Dan SPUDokumen13 halamanBAHAN AJAR ATOM Dan SPUanggelBelum ada peringkat
- Bab IIDokumen79 halamanBab IIWardi WardiBelum ada peringkat
- Kimia Bab 3Dokumen17 halamanKimia Bab 3Putri Chairany ITIBelum ada peringkat