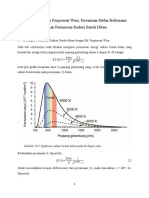
Teori Kepolaran Senyawa
Diunggah oleh
tiara kasih0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
327 tayangan2 halamankepolaran senyawa
Judul Asli
TEORI KEPOLARAN SENYAWA
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inikepolaran senyawa
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
327 tayangan2 halamanTeori Kepolaran Senyawa
Diunggah oleh
tiara kasihkepolaran senyawa
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
KEPOLARAN SENYAWA
Senyawa polar : Senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada unsur-
unsurnya. Hal ini terjadi karena unsur yang berikatan tersebut mempunyai nilai
keelektronegatifitas yang berbeda. Contoh : H2O, HCL, HF, HI dan HBr
Senyawa non polar : Senyawa yang terbentuk akibat adanya suatu ikatan antar elektron pada
unsur-unsur yang membentuknya. Hal ini terjadi karena unsur yang berikatan mempunyai nilai
elektronegatifitas yang sama/hampir sama. Contoh : O2, CO2,CH4 dan Cl2
Ciri-ciri senyawa polar :
1. Dapat larut dalam air dan pelarut polar lain
2. Memiliki kutub( +) dan kutub (-) , akibat tidak meratanya distribusi elektron
3. Memiliki pasangan elektron bebas (bila bentuk molekul diketahui) atau
memiliki perbedaan keelektronegatifan
Contoh : alkohol, HCl, PCl3, H2O, N2O5
Ciri-ciri senyawa non polar :
1. Tidak larut dalam air dan pelarut polar lain
2. Tidak memiliki kutub (+) dan kutub (-) , akibat meratanya distribusi elektron
3. Tidak memiliki pasangan elektron bebas (bila bentuk molekul diketahui) atau
keelektronegatifannya sama
Contoh : Cl2, PCl5, H2, N2
Senyawa polar memiliki perbedaan keelektronegatifan yang besar, perbedaan harga ini
mendorong timbulnya kutub kutub listrik yang permanen ( dipol permanent). Jadi antar molekul
polar terjadi gaya tarik dipol permanent.
Senyawa non polar memiliki perbedaan keelektronegatifan yang kecil, bahkan untuk senyawa
biner dwiatom ( seperti O2,H2) perbedaan keelektronegatifannya = 0 .
Bila terdapat senyawa non polar terjadi gaya tarik dipol sesaat ( gaya dispersi/ gaya london )
gaya ini terjadi akibat muatan + inti atom salah satu atom menginduksi elektron atom lain
sehingga terjadilah kutub kutub yang sifatnya sesaat.
Polarisasi Ikatan Kovalen
Suatu ikatan kovalen disebut polar, jika Pasangan Elektron Ikatan (PEI) tertarik lebih kuat ke
salah 1 atom. Contoh 1 : Molekul HCl
Meskipun atom H dan Cl sama-sama menarik pasangan elektron, tetapi keelektronegatifan Cl
lebih besar daripada atom H. Akibatnya atom Cl menarik pasangan elektron ikatan (PEI) lebih
kuat daripada atom H sehingga letak PEI lebih dekat ke arah Cl (akibatnya terjadi semacam
kutub dalam molekul HCl).
Jadi, kepolaran suatu ikatan kovalen disebabkan oleh adanya perbedaan keelektronegatifan
antara atom-atom yang berikatan. Sebaliknya, suatu ikatan kovalen dikatakan non polar (tidak
berkutub), jika PEI tertarik sama kuat ke semua atom.
Contoh 2 : Dalam tiap molekul di atas, ke-2 atom yang berikatan menarik PEI sama kuat karena
atom-atom dari unsur sejenis mempunyai harga keelektronegatifan yang sama. Akibatnya
muatan dari elektron tersebar secara merata sehingga tidak terbentuk kutub.
Contoh 3 : Meskipun atom-atom penyusun CH4 dan CO2 tidak sejenis, akan tetapi pasangan
elektron tersebar secara simetris diantara atom-atom penyusun senyawa, sehingga PEI tertarik
sama kuat ke semua atom (tidak terbentuk kutub).
Sifat-sifat senyawa kovalen antara lain kebanyakan menunjukkan titik leleh rendah, pada suhu
kamar berbentuk cairan atau gas, larut dalam pelarut non polar dan sedikit larut dalam air, sedikit
menghantarkan listrik, mudah terbakar dan banyak yang berbau. Jadi dapat disimpulkan bahwa
secara umum, senyawa polar larut dalam pelarut polar, sedangkan senyawa nonpolar larut dalam
pelarut nonpolar. Air merupakan pelarut universal yang bersifat polar. Oleh karena itu, air akan
melarutkan senyawa-senyawa yang bersifat polar, dan sebaliknya, tidak melarutkan senyawa
nonpolar. Berdasarkan sifat pelarut air tersebut, maka kita dapat mengetahui kepolaran suatu
senyawa dengan menguji kelarutannya dalam air.
Anda mungkin juga menyukai
- Makalah Ikatan KimiaDokumen7 halamanMakalah Ikatan KimiaStevanus Anggianto Buttu MasarrangBelum ada peringkat
- Ikatan Kovalen Polar-Nonpolar Dan KelarutanDokumen23 halamanIkatan Kovalen Polar-Nonpolar Dan KelarutanElva DevyantiBelum ada peringkat
- Kepolaran Senyawa KovalenDokumen15 halamanKepolaran Senyawa KovalenLatifah R100% (1)
- Teori Kepolaran SenyawaDokumen8 halamanTeori Kepolaran SenyawaFahrunissaBelum ada peringkat
- Afinitas ElektronDokumen2 halamanAfinitas Elektronlianlizakichia0% (1)
- Nuraeni Defek Massa Dan Energi Ikat Inti (60400118048)Dokumen13 halamanNuraeni Defek Massa Dan Energi Ikat Inti (60400118048)Nona NiaBelum ada peringkat
- Bahan Ajar Bentuk MolekulDokumen9 halamanBahan Ajar Bentuk MolekulSaskehBelum ada peringkat
- Tugas Ikatan KimiaDokumen21 halamanTugas Ikatan KimiaアニタBelum ada peringkat
- ELEKTROLISIS Dan HUKUM FARADAYDokumen90 halamanELEKTROLISIS Dan HUKUM FARADAYNikmahBelum ada peringkat
- Kamus Istilah Fisika ST As AJ TRDokumen85 halamanKamus Istilah Fisika ST As AJ TRninakinantiBelum ada peringkat
- Bab 1.ikatan KimiaDokumen35 halamanBab 1.ikatan KimiaandyBelum ada peringkat
- Hukumdasarkimia 1Dokumen28 halamanHukumdasarkimia 1Muhammad Syahrur Ramadhan50% (2)
- Kuantifikasi Momentum Sudut Dan Energi Pada Atom HidrogenDokumen4 halamanKuantifikasi Momentum Sudut Dan Energi Pada Atom Hidrogennovia anggrainiBelum ada peringkat
- Fisika ModernDokumen10 halamanFisika ModernHariyati NababanBelum ada peringkat
- Tugas Kimia Organik Kelompok 8 MAKALAH ISOMER KONFIRMASI ALKANA SIKLIKDokumen11 halamanTugas Kimia Organik Kelompok 8 MAKALAH ISOMER KONFIRMASI ALKANA SIKLIKrinaldy imanuelBelum ada peringkat
- Induktansi - InduktorDokumen8 halamanInduktansi - InduktorFransBelum ada peringkat
- Elektrometri YudaDokumen13 halamanElektrometri YudaFadly ArdianoBelum ada peringkat
- Kestabilan IntiDokumen55 halamanKestabilan IntialfiatusBelum ada peringkat
- Konfigurasi ElektronDokumen21 halamanKonfigurasi ElektronLidia Grestanti100% (1)
- Latihan Radikal Bebas - Nanda Chaerunnisa Kusnadi 11180960000095Dokumen2 halamanLatihan Radikal Bebas - Nanda Chaerunnisa Kusnadi 11180960000095Nanda ChaerunnisaBelum ada peringkat
- Sifat Koligatif LarutanDokumen5 halamanSifat Koligatif LarutanRiskiBelum ada peringkat
- StereokimiaDokumen84 halamanStereokimiaCandrakanta Cayadicilpa MBelum ada peringkat
- Kimia OrganikDokumen18 halamanKimia OrganikLeni RohqimahBelum ada peringkat
- Bahan Ajar Kls XDokumen14 halamanBahan Ajar Kls XDesi IndrawatiBelum ada peringkat
- Tugas m1 KB 4 Bentuk MolekulDokumen9 halamanTugas m1 KB 4 Bentuk MolekulTria ElsaBelum ada peringkat
- Laporan Praktikum Larutan - Sifat Koligatif LarutanDokumen27 halamanLaporan Praktikum Larutan - Sifat Koligatif Larutannia puspitaBelum ada peringkat
- Geometri Bentuk MolekulDokumen11 halamanGeometri Bentuk MolekulRizky TricahyaBelum ada peringkat
- Kimia ElektrolitDokumen27 halamanKimia Elektrolitnidyaa nBelum ada peringkat
- HibridisasiDokumen7 halamanHibridisasiCitra OktasariBelum ada peringkat
- KonformasiDokumen4 halamanKonformasiSeskia RenensenataBelum ada peringkat
- 2teori Ikatan ValensiDokumen28 halaman2teori Ikatan ValensiIma いまBelum ada peringkat
- Elektrolit Kuat Dan Elektrolit LemahDokumen4 halamanElektrolit Kuat Dan Elektrolit LemahSyukBelum ada peringkat
- Ikatan KimiaDokumen37 halamanIkatan KimiaripuBelum ada peringkat
- Konsentrasi Larutan PDFDokumen5 halamanKonsentrasi Larutan PDFSalis Nur KBelum ada peringkat
- Makalah Kimia Anorganik 1 - Struktur ResonansiDokumen3 halamanMakalah Kimia Anorganik 1 - Struktur ResonansiNatalie CarReen RadjahBelum ada peringkat
- Analisis KD 3.7Dokumen5 halamanAnalisis KD 3.7Rizky Anggi SuhairaBelum ada peringkat
- Bentuk Molekul Dan Gaya AntarDokumen11 halamanBentuk Molekul Dan Gaya AntarAyahcintabundaBelum ada peringkat
- Hubungan Ilmu Kimia Dengan Ilmu Pengetahuan LainDokumen4 halamanHubungan Ilmu Kimia Dengan Ilmu Pengetahuan LainDananjaya83% (6)
- Umpan Balik SoalDokumen4 halamanUmpan Balik SoalEni WardaniBelum ada peringkat
- Hubungan Hukum Pergeseran Wien, Pers. Stefan Boltzmann Dengan Perumusan Radiasi Benda HitamDokumen5 halamanHubungan Hukum Pergeseran Wien, Pers. Stefan Boltzmann Dengan Perumusan Radiasi Benda HitamEko Ari WibowoBelum ada peringkat
- Gaya SentripetalDokumen11 halamanGaya SentripetalFathuddin BasriBelum ada peringkat
- Bahan Kls XI Teori Kinetik GasDokumen27 halamanBahan Kls XI Teori Kinetik Gasrudi100% (1)
- Buku Siswa Perpindahan KalorDokumen6 halamanBuku Siswa Perpindahan KalorRetno Dian ABelum ada peringkat
- Kumpulan Struktur Lewis Berbagai SenyawaDokumen4 halamanKumpulan Struktur Lewis Berbagai SenyawaMaroh ImuetzBelum ada peringkat
- Ugi Hermawati - Tugas Kimia TermodinamikaDokumen17 halamanUgi Hermawati - Tugas Kimia TermodinamikaUgi HermawatiBelum ada peringkat
- Contoh Modul Kegiatan Belajar 1-2 (Model Atom)Dokumen20 halamanContoh Modul Kegiatan Belajar 1-2 (Model Atom)abubakarBelum ada peringkat
- Makalah StereokimiaDokumen13 halamanMakalah StereokimiaAnnisa WindraBelum ada peringkat
- Senyawa Kovalen Polar Dan Nonpolar Materi FixDokumen4 halamanSenyawa Kovalen Polar Dan Nonpolar Materi FixSuci ParlianiBelum ada peringkat
- Aturan OktetDokumen4 halamanAturan OktetIrsan Ihsani MBelum ada peringkat
- Kelompok I Vibrasi Dan Rotasi MolekulDokumen19 halamanKelompok I Vibrasi Dan Rotasi Molekulsyadzaafifah6Belum ada peringkat
- Whitten Kimia Bab 2 MadagaskarDokumen37 halamanWhitten Kimia Bab 2 MadagaskarJerry Marlian100% (1)
- Senyawa PolarDokumen3 halamanSenyawa PolarPutry ArianiiBelum ada peringkat
- Senyawa Polar Dan Non PolarDokumen4 halamanSenyawa Polar Dan Non PolarMaria Kristiani PasaribuBelum ada peringkat
- Senyawa Polar Dan Non PolarDokumen5 halamanSenyawa Polar Dan Non PolarBella Safira100% (1)
- Senyawa Polar Dan Non PolarDokumen6 halamanSenyawa Polar Dan Non PolarHacker TransparanBelum ada peringkat
- Makalah Kepolaran Alda RosyiDokumen8 halamanMakalah Kepolaran Alda RosyiRevalda MarcelinaBelum ada peringkat
- Sifat Fisis Senyawa Kovalen Ada 2 Yaitu Kovalen Polar Dan Non PolarDokumen3 halamanSifat Fisis Senyawa Kovalen Ada 2 Yaitu Kovalen Polar Dan Non PolarMuhaajiriinn100% (1)
- Kimia Dasar, Muhammad Fariq Umri & Kemas Rangga Alwiono (Kepolaran)Dokumen9 halamanKimia Dasar, Muhammad Fariq Umri & Kemas Rangga Alwiono (Kepolaran)Fariq UmriBelum ada peringkat
- Kata PengantarDokumen13 halamanKata PengantarRevalda MarcelinaBelum ada peringkat
- KovalenDokumen8 halamanKovalenTian Amalda SabrinaBelum ada peringkat
- HendryDokumen1 halamanHendrytiara kasihBelum ada peringkat
- Makalah Kimor Kel 4beDokumen10 halamanMakalah Kimor Kel 4betiara kasihBelum ada peringkat
- Tata Nama Senyawa OrganikDokumen14 halamanTata Nama Senyawa Organiktiara kasihBelum ada peringkat
- Contoh Senyawa HidrokarbonDokumen1 halamanContoh Senyawa Hidrokarbontiara kasihBelum ada peringkat
- Makalah KimorDokumen60 halamanMakalah Kimortiara kasihBelum ada peringkat
- Makalah Kimor Kel 4beDokumen10 halamanMakalah Kimor Kel 4betiara kasihBelum ada peringkat
- Tata Nama Aldehid Dam KetonDokumen5 halamanTata Nama Aldehid Dam Ketontiara kasihBelum ada peringkat
- Tata Nama Senyawa OrganikDokumen14 halamanTata Nama Senyawa Organiktiara kasihBelum ada peringkat
- Teori Kepolaran SenyawaDokumen2 halamanTeori Kepolaran Senyawatiara kasihBelum ada peringkat
- Buku Ajar Pancasila 2017Dokumen264 halamanBuku Ajar Pancasila 2017ananda100% (1)
- Nomor AtomDokumen14 halamanNomor Atomtiara kasihBelum ada peringkat
- Makalah KimorDokumen60 halamanMakalah Kimortiara kasihBelum ada peringkat
- Tata Nama Aldehid Dam KetonDokumen5 halamanTata Nama Aldehid Dam Ketontiara kasihBelum ada peringkat
- Tata Nama Aldehid Dam KetonDokumen5 halamanTata Nama Aldehid Dam Ketontiara kasihBelum ada peringkat
- Definisi Spektroskopi Inframerah SpektroskopiDokumen29 halamanDefinisi Spektroskopi Inframerah Spektroskopitiara kasihBelum ada peringkat
- Isomer Optis Dan Tata Nama Asam KabosiklatDokumen6 halamanIsomer Optis Dan Tata Nama Asam Kabosiklattiara kasihBelum ada peringkat
- Teori Asam BasaDokumen6 halamanTeori Asam BasaWayan WahyuBelum ada peringkat
- Kimia OrganikDokumen43 halamanKimia Organiktiara kasihBelum ada peringkat
- Materi Ester Dan AminaDokumen20 halamanMateri Ester Dan Aminarizky risnoBelum ada peringkat
- Sel Volta Dan Elektrolisi PrintDokumen21 halamanSel Volta Dan Elektrolisi Printtiara kasihBelum ada peringkat
- Teori Asam PrintDokumen9 halamanTeori Asam Printtiara kasihBelum ada peringkat
- Tata Nama AlkoholDokumen5 halamanTata Nama Alkoholtiara kasihBelum ada peringkat
- Persoalan Ekonomi PertanianDokumen3 halamanPersoalan Ekonomi Pertaniantiara kasihBelum ada peringkat
- Nomor AtomDokumen14 halamanNomor Atomtiara kasihBelum ada peringkat
- Tata Nama Aldehid Dam KetonDokumen5 halamanTata Nama Aldehid Dam Ketontiara kasihBelum ada peringkat
- Isomer Optis Dan Tata Nama Asam KabosiklatDokumen6 halamanIsomer Optis Dan Tata Nama Asam Kabosiklattiara kasihBelum ada peringkat
- Tata Nama AlkoholDokumen5 halamanTata Nama Alkoholtiara kasihBelum ada peringkat
- Isomer Optis Dan Tata Nama Asam KabosiklatDokumen6 halamanIsomer Optis Dan Tata Nama Asam Kabosiklattiara kasihBelum ada peringkat
- Isomer Optis Dan Tata Nama Asam KabosiklatDokumen6 halamanIsomer Optis Dan Tata Nama Asam Kabosiklattiara kasihBelum ada peringkat
- Materi Ester Dan AminaDokumen20 halamanMateri Ester Dan Aminarizky risnoBelum ada peringkat