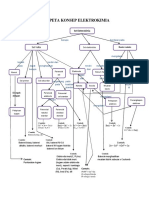
Label Konsep Elektrokimia
Diunggah oleh
Yaumil Agus Akhir0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
93 tayangan10 halamanJudul Asli
Label Konsep elektrokimia.docx
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
93 tayangan10 halamanLabel Konsep Elektrokimia
Diunggah oleh
Yaumil Agus AkhirHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 10
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
Sel Sel Konsep - Sel - Jenis Elektro- - - Sel volta Aki, baterai NaCl(aq) →
Elektrokimia elektrokimia konkrit - elektrokimia elektroda kimia - Sel Na+(aq) + Cl- (aq)
terdiri dari - Terdiri dari logam elektroli-
sepasang sepasang - Jenis sis
elektroda elektroda larutan
dalam - Larutan elektrolit
larutan elektrolit - Jenis
elektrolit yang - Dihubungkan senyawa
dihubungkan dengan - Potensial sel
dengan penghantar standar
penghantar logam - Potensial sel
logam pada - Pada
rangkaian luar rangkaian
luar
Sel Volta/ Sel volta Konsep - Sel volta - Jenis Sel Sel - Sel Baterai kering, Sel diafragma
Galvani mengalami konkret - Reaksi elektroda Elektro- elektrolisis primer Accumulator dan Penyepuhan
reaksi redoks redoks logam kimia - Sel logam besi
spontan yang spontan - Jenis larutan sekunder dengan emas,
mengubah - Mengubah elektrolit - Sel Pemurnian
energi energi kimia - Jembatan bahan logam Cu
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
kimia menjadi menjadi garam bakar
energi energi - Potensial sel
listrik listrik standar
- Potensial sel
Sel Sel elektrolisis Konsep - Sel - Besarnya Sel Sel volta - Hukum Alat Hoffman Baterai
elektrolisis mengubah konkret elektrolisis arus listrik elektro Faraday
energi - Mengubah - Jenis kimia - Muatan
listrik menjadi energi listrik senyawa - listrik
energi menjadi - Jenis - Elektro-
kimia energi kimia elektroda da
menghasilkan - Menghasil- - Waktu - Penyepu
reaksi reduksi- kan reaksi han
oksidasi reduksi logam
oksidasi (elektrop
lating)
Sel primer/ Sel primer Konsep - Sel primer - Nilai Sel volta Sel - Anoda Baterai biasa, Aki, baterai Ni-
Sel kering termasuk berdasarkan - Sel volta potensial sel sekunder - Katoda baterai alkalin, Cd, baterai Ni-
sel volta yang prinsip - Tidak dapat Sel bahan baterai merkuri logam hidrida,
tidak dapat diperbaharui bakar oksida, dan dan baterai ion
diperbaharui - Bersifat baterei litium litium.
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
dan irreversibel
bersifat
irreversible
Sel Sekunder Sel sekunder Konsep - Sel sekunder - Nilai Sel volta Sel primer - Anoda Aki, baterai Ni- Baterei biasa,
/ sel basah termasuk sel berdasarkan - Sel volta potensial sel Sel bahan - Katoda Cd, baterai Ni- baterei alkalin,
volta yang prinsip - Dapat bakar logam hidrida, baterei merkuri
dapat diperbaharui dan baterai ion oksida, dan
diperbaharui - Bersifat litium. baterei litium
dan bersifat Reversibel
reversible
Sel bahan Sel bahan Konsep - Sel bahan - Nilai Sel volta Sel primer - Anoda Sel campuran Aki, baterei Ni-
bakar bakar (fuelcell) berdasarkan bakar potensial sel Sel - Katoda hidrogen dan Cd, baterei Ni
(fuel cell) termasuk sel prinsip - Sel volta sekunder oksigen yang logam hidrida,
volta yang - Tidak dapat digunakan dan baterei ion
tidak dapat diperbaharui sebagai bahan litium.
diperbaharui - Tidak habis bakar pesawat
tetapi luar angkasa
tidak habis
Hukum Hukum Konsep - Hukum - Jenis-jenis Sel Hukum - Hukum Bila arus 20 A Jika arus 1 F
Faraday Faraday berdasarkan Faraday elektroda elektrolisis Lenz 1 dan 2 dialirkan dialirkan ke
menerangkan simbol - Hubungan - Jenis ion faraday melalui leburan dalam tiga
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
hubungan kuantitatif logam kriolit yang larutan, yaitu
kuantitatif antara arus - Kuat lemah mengandung CuSO4, AuCl3
antara kuat listrik, waktu arus listrik Al2O3 selama 50 dan AgNO3,
arus listrik, dan muatan 1 - Perubahan menit, berapa maka
waktu, dan mol electron waktu gram Al yang perbandingan
muatan 1 mol - Terjadi di terbentuk dan massa Cu : Au :
electron yang elektroda berapa liter gas Ag sesuai
terjadi di O2 yang timbul dengan
elektroda jika diukur pada perbandingan
keadaan standar massa
(STP) ekivalennya,
yaitu:
Muatan Muatan listrik Konsep yang - Muatan - Besarnya Sel - Elektroda - Baterai Muatan elektron
Listrik menyatakan menyatakan listrik muatan elektrolisis penyepuh- menghasilkan sebesar 1,9x1019
jumlah sifat dan - Jumlah arus - Arus listrik an logam muatan listrik Coulomb
arus listrik nama atribut listrik - Waktu (elektro- sebesar x
yang - Mengalir plating) Coulomb
mengalir dalam waktu
dalam waktu tertentu
tertentu
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
Elektroda Elektroda Konsep - Elektroda - Jenis Sel - Muatan - Anoda - Elektroda Elektroda
tempat dengan - Tempat elektroda elektrolisis listrik - Katoda inert(C, Pt,Au) kalomel
berlangsung- atribut kritis berlangsung- - Muatan - Penyepuh - Elektroda
nya reaksi abstrak tapi nya reaksi elektroda -an tidak inert
reduksi- contohnya reduksi logam - (logam selain
oksidasi konkret oksidasi (elektro- elektroda
plating) inert), seperti:
tembaga
(Cu), Perak
(Ag), Nikel
(Ni), besi (Fe),
dll
Katoda Katoda tempat Konsep - Katoda - Elektroda Sel volta - Anoda - Pb/Pb2+// Pb/Pb2+//
terjadinya konkret - Tempat - Bilangan Zn2+/Zn Zn2+/Zn
reaksi terjadinya oksidasi Zn sebagai Pb sebagai
reduksi reaksi reduksi Katoda Katoda
Anoda Anoda tempat Konsep - Anoda - Elektroda Sel volta - Katoda - Korosi Pb/Pb2+// Pb/Pb2+//
terjadinya konkret - Tempat - Bilangan Zn2+/Zn Zn2+/Zn
reaksi terjadinya oksidasi Pb sebagai Anoda Zn sebagai
oksidasi reaksi Anoda
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
oksidasi
Reaksi Reaksi Konsep - Reaksi - Jumlah Anoda - Reaksi - Zn(s) → Cu2+(aq) +2e →
Oksidasi oksidasi menyatakan oksidasi elektron reduksi Zn2+(aq) + 2e Cu(s)
melepaskan proses - Melepaskan
electron elektron
Korosi Korosi Konsep yang - Terbentuk- - Jenis logam Reaksi - - Perkaratan Reaksi
mengalami menyatakan nya oksidasi logam fotosintesis
Peristiwa nama proses - Oksida
terbentuknya logam
oksida logam - Terjadinya
akibat reaksi
terjadinya oksidasi
reaksi dari logam
oksidasi dari
logam
tersebut
Reaksi Reaksi reduksi Konsep - Reaksi - Jumlah Katoda - Reaksi - Cu2+(aq) + 2e → Zn(s) → Zn2+(aq) +
Reduksi menerima menyatakan reduksi elektron oksidasi Cu(s) 2e
electron proses - Menerima
elektron
Potensial Potensial Konsep - Potensial - Jenis Reaksi - Potensial - Potensial - Zn2+ + 2e → Pb/Pb2+//
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
Elektroda elektroda berdasarkan elektroda elektroda. Reduksi sel reduksi Zn(s) Zn2+/Zn
menunjukkan prinsip - Potensial sel oksidas - Potensial - Potensial = -0,763 v E sel = + 0,638
potensial sel - Elektroda sel standar oksidasi - Zn(s) → Zn2+ + Volt
yang hidrogen 2e
dihasilkan = +0,763 v
dari suatu
elektroda
dengan
elektroda
hidrogen
Potensial Potensial sel Konsep - Potensial sel - Jenis Reaksi - Potensial - Potensial Pb/Pb2+// Potensial
sel menyatakan berdasarkan - Potensial elektroda reduksi elektroda reduksi Zn2+/Zn standard
selisih prinsip reduksi pada - Nilai oksidas - Potensial - Potensial E sel = + 0,638 Zn2++ 2e → Zn(s)
antara katoda potensial sel sel standar oksidasi Volt = -0,763 v
potensial - Potensial - Anoda
reduksi pada reduksi pada - Katoda
katoda anoda
dengan
potensial
reduksi pada
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
anoda
Potensial Potensial sel Konsep - Potensial sel - Tinggi Reaksi - Potensial - Potensial Potensial Pb/Pb2+//Zn2+/
sel standar standar berdasarkan - Standar rendahnya reduksi- elektroda reduksi standard Zn
menyatakan prinsip Potensial sel suhu oksidasi - Potensial - Potensial Zn2++ 2e → Zn(s) E sel = + 0,638
potensial sel - Di ukur pada - Besar sel oksidasi = -0,763 v Volt
yang suhu 250C kecilnya
diukur pada - Konsentrasi konsentrasi
suhu 250C ion-ion 1M - Besar
dengan dan tekanan kecilnya
konsentrasi gas 1atm tekanan gas
ion-ion 1M
dan
tekanan 1atm.
Potensial Potensial Konsep - Potensial - Jenis - Potensial - Potensial - Zn2+ + 2e → Zn(s)→Zn2+ +2e
reduksi reduksi berdasarkan reduksi elektroda elektro- oksidasi Zn(s) =+0,763 v
terjadi pada prinsip - Terjadi pada da = -0,763 v
katoda katoda - Potensial
sel
- Potensial
sel
Atribut Posisi
Label Definisi Jenis
Super Sub- Contoh Non Contoh
Konsep Konsep Konsep Kritis Variabel Koordinat
ordinat ordinat
standar
Potensial Potensial Konsep - Potensial - Jenis - Potensial - Potensial - Zn(s) → Zn2+ + Zn2++ 2e→Zn(s)
oksidasi oksidasi berdasarkan oksidasi elektroda elektro- reduksi 2e = -0,763 v
terjadi pada prinsip - Terjadi pada da =+0,763 v
anoda anoda - Potensial
sel
- Potensial
sel
standar
Penyepuh- Penyepuhan Konsep - Penyepuhan - Jenis - Sel - Muatan - Penyepuhan Elektrolisis air
an logam logam menya logam logam elektroli- listrik emas dengan
(elektro- (elektropla- takan (elektropla- sis - Elektroda elektroda
plating) ting) melapisi proses ting) inert
logam dengan - Melapisi
logam lainnya logam
menggunakan dengan
arus listrik logam lain
- Mengguna-
kan arus
listrik
Analisis Konsep Elektrokimia
Anda mungkin juga menyukai
- Metode-Metode ElektroanalisisDokumen63 halamanMetode-Metode ElektroanalisisfadlyBelum ada peringkat
- A.1 Analisis Konsep ElektrokimiaDokumen3 halamanA.1 Analisis Konsep ElektrokimiaRizalul Welly0% (1)
- Konsep KimiaDokumen12 halamanKonsep Kimiahutri rahayuBelum ada peringkat
- Peta Konsep ElektrokimiaDokumen1 halamanPeta Konsep ElektrokimiaDwi Cahya AgustinaBelum ada peringkat
- 5 Bahan Ajar VoltaDokumen26 halaman5 Bahan Ajar VoltaAmmar FarabyBelum ada peringkat
- KIMIADokumen10 halamanKIMIAGilang Afriansyah100% (2)
- Tugas Kuliah ElektrokimiaDokumen18 halamanTugas Kuliah ElektrokimiaIkhsan ArifBelum ada peringkat
- POTENSIOMETRI Sel VoltaDokumen24 halamanPOTENSIOMETRI Sel Voltaalif ramdaniBelum ada peringkat
- Format Tugas Jenis Jenis Pengetahuan - Aisyah Putri Oktaviani - 2013031010Dokumen4 halamanFormat Tugas Jenis Jenis Pengetahuan - Aisyah Putri Oktaviani - 2013031010Aisyah Putri OktavianiPendidikan KimiaSmt 1Belum ada peringkat
- Bahan Ajar KuDokumen12 halamanBahan Ajar Kuazizah.irwansyah27Belum ada peringkat
- KELOMPOK 1 - XII IPA 1 - SEL VOLTA Dan SEL ELEKTROLISISDokumen25 halamanKELOMPOK 1 - XII IPA 1 - SEL VOLTA Dan SEL ELEKTROLISISAnisa AyuBelum ada peringkat
- Materi PotensiometriDokumen10 halamanMateri PotensiometriThrowaway LohanBelum ada peringkat
- Analisis KonsepDokumen5 halamanAnalisis KonsepEka TinaBelum ada peringkat
- Kelompok 8Dokumen33 halamanKelompok 8Reihan FaizaldiBelum ada peringkat
- Analisis Konsep Reaksi Redoks Dan Sel ElektrokimiaDokumen5 halamanAnalisis Konsep Reaksi Redoks Dan Sel ElektrokimiaWira rahmalizaBelum ada peringkat
- Elektrokimia & Dasar-Dasar ElektroanalisisDokumen40 halamanElektrokimia & Dasar-Dasar ElektroanalisisHaryadi AlbantaniBelum ada peringkat
- Konsep Dasar Elektrokimia 1Dokumen18 halamanKonsep Dasar Elektrokimia 1Reshinta AyuBelum ada peringkat
- Elektrokimia - Alfira Junita - 082001900003Dokumen11 halamanElektrokimia - Alfira Junita - 082001900003Alfira JunitaBelum ada peringkat
- Analisis Konsep Redoks Dan Elektrokimia NyooDokumen7 halamanAnalisis Konsep Redoks Dan Elektrokimia NyooInne MineBelum ada peringkat
- Ppt. Sel Elktrokimia (Kimia Sma Xii Ipa)Dokumen10 halamanPpt. Sel Elktrokimia (Kimia Sma Xii Ipa)Acha AchaBelum ada peringkat
- Metode Elektroanalisis Bagian 1Dokumen36 halamanMetode Elektroanalisis Bagian 1Chintya JessicaBelum ada peringkat
- Struktur Makro Sel VoltaDokumen3 halamanStruktur Makro Sel Voltanaura.tsabitaBelum ada peringkat
- ElektrokimiaDokumen11 halamanElektrokimiaUmi Kalsum AzisBelum ada peringkat
- Materi-1 (Sel Elektrokimia) - 1Dokumen6 halamanMateri-1 (Sel Elektrokimia) - 1nailasadah11Belum ada peringkat
- Elektrokimia - Zannatul MunnaDokumen34 halamanElektrokimia - Zannatul MunnazanatulmunaBelum ada peringkat
- Jurnal Refleksi DiriDokumen29 halamanJurnal Refleksi Dirimawaddatul hasanahBelum ada peringkat
- ElektrokimiaDokumen17 halamanElektrokimiaZhafirra AnpBelum ada peringkat
- Reaksi Redoks & Sel Elektrokimia: Sel Volta (Sel Galvani) - ElektrolisisDokumen33 halamanReaksi Redoks & Sel Elektrokimia: Sel Volta (Sel Galvani) - ElektrolisisNahya AndhiniBelum ada peringkat
- Elkim Slide 3Dokumen30 halamanElkim Slide 3Monika RamazelaBelum ada peringkat
- Sel ElektrokimiaDokumen13 halamanSel ElektrokimiaNinda NuralimahBelum ada peringkat
- Makalah Kimdas UasDokumen87 halamanMakalah Kimdas UasPoppy MinataBelum ada peringkat
- Sel Volta-1Dokumen18 halamanSel Volta-1Itang SaputroBelum ada peringkat
- 1322 3240 1 SMDokumen4 halaman1322 3240 1 SMMUHAMMAD RIZQI PRATAMA -Belum ada peringkat
- Kelompok 5 - ElektrokimiaDokumen15 halamanKelompok 5 - ElektrokimiaRian FirmandaBelum ada peringkat
- Kimia ElektrolisisDokumen28 halamanKimia Elektrolisisgerardmarthin13Belum ada peringkat
- Bab 6 ElektrokimiaDokumen15 halamanBab 6 ElektrokimiashidanaimBelum ada peringkat
- ANALISIS KONSEP REDOKS DAN ELEKTROKIMIA NyooDokumen8 halamanANALISIS KONSEP REDOKS DAN ELEKTROKIMIA NyooHasma QueenBelum ada peringkat
- Laporan Resmi Deret Galvanis Logam-LogamDokumen9 halamanLaporan Resmi Deret Galvanis Logam-LogamMoch Farhein FerdinalBelum ada peringkat
- Sel VoltaDokumen8 halamanSel VoltaIni. AjengBelum ada peringkat
- P3 - Elektroda BiopotensialDokumen44 halamanP3 - Elektroda BiopotensialRaka RidaBelum ada peringkat
- Makalah Kimdas Rafael GilangDokumen60 halamanMakalah Kimdas Rafael GilangRafael Juvito Peter ThangBelum ada peringkat
- NOTA Penghasilan Tenaga Elektrik Daripada Tindak Balas KimiaDokumen4 halamanNOTA Penghasilan Tenaga Elektrik Daripada Tindak Balas KimiananarahmannaimBelum ada peringkat
- Modul Sel Volta KD 3.4Dokumen17 halamanModul Sel Volta KD 3.4endangBelum ada peringkat
- Sel VoltaDokumen11 halamanSel VoltaweniBelum ada peringkat
- Bahan Ajar Ke 2Dokumen3 halamanBahan Ajar Ke 2Elma ShofaBelum ada peringkat
- ELEKTROGRAVIMETRIDokumen17 halamanELEKTROGRAVIMETRIPKI072Galuh ClarisaBelum ada peringkat
- LKPD 3.4 Sel VoltaDokumen7 halamanLKPD 3.4 Sel VoltajeannBelum ada peringkat
- Elektrokimia Kimia Fisika 2Dokumen35 halamanElektrokimia Kimia Fisika 2nurayniBelum ada peringkat
- Makalah Sel VoltaDokumen6 halamanMakalah Sel VoltaAlit Supriyana Putra100% (1)
- Pengaplikasian Sel Volta Dalam Kehidupan Sehari-Hari: Annesa Fatimah Azzahra - XII MIPA 1Dokumen13 halamanPengaplikasian Sel Volta Dalam Kehidupan Sehari-Hari: Annesa Fatimah Azzahra - XII MIPA 1annesa fatimahBelum ada peringkat
- Analisis Konsep Redoks Dan Elektrokimia NyooDokumen8 halamanAnalisis Konsep Redoks Dan Elektrokimia NyooarwantoBelum ada peringkat
- Instrumentasi AmperometriDokumen10 halamanInstrumentasi AmperometriAnanda PattuBelum ada peringkat
- Susunan Sel ElektrolisisDokumen4 halamanSusunan Sel ElektrolisisFaqih SultonfaqBelum ada peringkat
- Volta MetriDokumen30 halamanVolta MetriwellaBelum ada peringkat
- Bahan Ajar Sel Volta 2Dokumen6 halamanBahan Ajar Sel Volta 2putry ayuningtyasBelum ada peringkat
- Jurnal Lapres ADokumen10 halamanJurnal Lapres AHilyaa Hilya0% (1)
- Mind Map ElektrokimiaDokumen1 halamanMind Map Elektrokimiawulandari wasioBelum ada peringkat
- Bahan Ajar Volta - UblDokumen26 halamanBahan Ajar Volta - UblSolihin KslBelum ada peringkat
- Rangkuman RedoksDokumen7 halamanRangkuman RedoksYaumil Agus AkhirBelum ada peringkat
- Proposal PTKDokumen29 halamanProposal PTKYaumil Agus AkhirBelum ada peringkat
- Rangkuman RedoksDokumen7 halamanRangkuman RedoksYaumil Agus AkhirBelum ada peringkat
- GagneDokumen6 halamanGagneYaumil Agus AkhirBelum ada peringkat
- Tugas TIK DedekkDokumen1 halamanTugas TIK DedekkYaumil Agus AkhirBelum ada peringkat
- Manajemen LaboratoriumDokumen11 halamanManajemen LaboratoriumIma PuspitaBelum ada peringkat
- Macam-Macam Tipe DataDokumen12 halamanMacam-Macam Tipe DataYaumil Agus AkhirBelum ada peringkat
- Masalah 1Dokumen36 halamanMasalah 1innekekusumaBelum ada peringkat
- Susunan PanitiaDokumen15 halamanSusunan PanitiaYaumil Agus AkhirBelum ada peringkat
- ProteinDokumen1 halamanProteinYaumil Agus AkhirBelum ada peringkat
- Rameyza AlyaDokumen1 halamanRameyza AlyaYaumil Agus AkhirBelum ada peringkat
- Heterosiklik: A. PengertianDokumen21 halamanHeterosiklik: A. PengertianYaumil Agus AkhirBelum ada peringkat
- Mollusca KlasifikasiDokumen2 halamanMollusca KlasifikasiYaumil Agus AkhirBelum ada peringkat
- Bab 6 Perencanaan Dan Pelaksanaan PembelajaranDokumen16 halamanBab 6 Perencanaan Dan Pelaksanaan PembelajaranLili YusliantiBelum ada peringkat
- KewarganegaraanDokumen11 halamanKewarganegaraanYaumil Agus AkhirBelum ada peringkat
- Sumber Nilai B. IndoDokumen2 halamanSumber Nilai B. IndoYaumil Agus AkhirBelum ada peringkat
- Mollusc ADokumen23 halamanMollusc AYaumil Agus AkhirBelum ada peringkat
- Tgs SsssDokumen2 halamanTgs SsssYaumil Agus AkhirBelum ada peringkat
- Sinopsis CeritaDokumen2 halamanSinopsis CeritaYaumil Agus AkhirBelum ada peringkat
- Perangkat LunakDokumen2 halamanPerangkat LunakYaumil Agus AkhirBelum ada peringkat
- Nyamuk AnophelesDokumen3 halamanNyamuk AnophelesYaumil Agus AkhirBelum ada peringkat
- Presentasi Bahasa IndonesiaDokumen8 halamanPresentasi Bahasa IndonesiaYaumil Agus AkhirBelum ada peringkat
- Bab 4 Dunia MoneraDokumen21 halamanBab 4 Dunia MoneraYaumil Agus AkhirBelum ada peringkat
- Teori AtomDokumen31 halamanTeori AtomMohamad SalsabilaBelum ada peringkat
- Teori Belajar KonstuktivismeDokumen18 halamanTeori Belajar KonstuktivismeYaumil Agus AkhirBelum ada peringkat
- Bab 3 Optika FisisDokumen23 halamanBab 3 Optika FisisYaumil Agus AkhirBelum ada peringkat
- Konsep Media PembelajaranDokumen5 halamanKonsep Media PembelajaranYaumil Agus AkhirBelum ada peringkat
- ProteinDokumen1 halamanProteinYaumil Agus AkhirBelum ada peringkat
- Penyusunan GBPP Dan SapDokumen26 halamanPenyusunan GBPP Dan SapYaumil Agus AkhirBelum ada peringkat