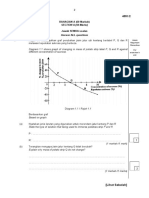
KIMIA T4 KSSM BAB 3 Konsep Mol, Formula Dan Persamaan Kimia
Diunggah oleh
Fidree Aziz0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
202 tayangan83 halamanBab 3 membincangkan konsep asas dalam kimia seperti jisim atom relatif, jisim molekul relatif, konsep mol, formula kimia, penamaan sebatian dan penggunaan persamaan kimia untuk mewakili tindak balas kimia. Konsep-konsep ini membolehkan ahli kimia menganalisis dan memahami tindak balas kimia secara kuantitatif dan kualitatif.
Deskripsi Asli:
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniBab 3 membincangkan konsep asas dalam kimia seperti jisim atom relatif, jisim molekul relatif, konsep mol, formula kimia, penamaan sebatian dan penggunaan persamaan kimia untuk mewakili tindak balas kimia. Konsep-konsep ini membolehkan ahli kimia menganalisis dan memahami tindak balas kimia secara kuantitatif dan kualitatif.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
202 tayangan83 halamanKIMIA T4 KSSM BAB 3 Konsep Mol, Formula Dan Persamaan Kimia
Diunggah oleh
Fidree AzizBab 3 membincangkan konsep asas dalam kimia seperti jisim atom relatif, jisim molekul relatif, konsep mol, formula kimia, penamaan sebatian dan penggunaan persamaan kimia untuk mewakili tindak balas kimia. Konsep-konsep ini membolehkan ahli kimia menganalisis dan memahami tindak balas kimia secara kuantitatif dan kualitatif.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 83
BAB 3 KONSEP
KIMIA TINGKATAN 4 KSSM MOL, FORMULA
OLEH CIKGU NORAZILA KHALID
SMK ULU TIRAM JOHOR
DAN PERSAMAAN
KIMIA
3.1 JISIM ATOM
RELATIF DAN JISIM
MOLEKUL RELATIF
JISIM ATOM
RELATIF, JAR
• Ahli kimia menggunakan
konsep ‘jisim atom relatif ’
dengan membandingkan jisim
atom sesuatu unsur dengan
jisim atom unsur lain yang
dipilih sebagai piawai.
• Oleh itu, jisim sebenar
sesuatu atom tidak perlu
diketahui.
JISIM ATOM RELATIF, JAR
• Pada awalnya, atom hidrogen
dijadikan sebagai atom piawai kerana
atom hidrogen adalah paling ringan.
• Jisim atom semua unsur lain
dibandingkan dengan atom hidrogen.
• Misalnya, satu atom karbon adalah
seberat 12 atom hidrogen.
• Oleh itu, jisim atom relatif karbon
ialah 12 manakala jisim atom relatif
hidrogen diambil sebagai satu
JISIM ATOM RELATIF, JAR
• Namun, pada tahun 1961, ahli kimia seluruh dunia
telah bersetuju menjadikan atom karbon-12
sebagai atom piawai setelah mendapati
penggunaan atom hidrogen sebagai atom piawai
menemui pelbagai masalah.
• Jisim atom relatif, JAR sesuatu unsur ditakrifkan
sebagai jisim purata satu atom unsur tersebut
berbanding dengan 1/12 kali jisim satu atom
karbon-12.
• Karbon-12 dipilih sebagai piawai kerana mudah
dikendalikan memandangkan unsur ini merupakan
pepejal pada suhu bilik.
• Karbon-12 mudah bergabung dengan unsur-unsur lain.
• Jadi, unsur ini mudah dijumpai dalam kebanyakan bahan.
• Walaupun karbon mempunyai tiga isotop, karbon-12
ialah isotop utama dengan kelimpahan 99%.
• Hal ini menyebabkan jisim atom relatif karbon-12 adalah
tepat 12.0.
JISIM MOLEKUL RELATIF,
JMR
• Melalui cara yang sama juga, kita
boleh membandingkan jisim
molekul sesuatu bahan dengan atom
piawai karbon-12.
• Jisim molekul relatif, JMR sesuatu
molekul ialah jisim purata molekul
tersebut berbanding dengan 1/12
kali jisim satu atom karbon-12.
• Rajah menunjukkan satu
molekul air mempunyai jisim
molekul relatif 18.
• Hal ini menunjukkan jisim satu
molekul air adalah 18 kali lebih
besar daripada 1/12 kali jisim
satu atom karbon-12.
• Jisim molekul relatif sesuatu molekul
boleh dihitung dengan menjumlahkan
jisim atom relatif bagi semua atom
yang membentuk molekul tersebut
• Jisim molekul relatif sesuatu molekul
menyamai jumlah jisim atom relatif
bagi semua atom di dalam molekul
tersebut.
JISIM FORMULA RELATIF, JFR
• Konsep jisim relatif ini juga diguna pakai untuk bahan
ion.
• Jisim relatif bahan ion dipanggil jisim formula relatif,
JFR.
• Jisim formula relatif dihitung dengan
menjumlahkan jisim atom relatif semua atom yang
ditunjukkan oleh formula bahan ion.
• Hal ini kerana jisim sesuatu ion tidak banyak
berbeza daripada jisim atom yang membentuk ion
tersebut.
3.2 KONSEP MOL
KONSEP MOL
DALAM BIDANG KIMIA, UNIT MOL DIGUNAKAN
DALAM PENYUKATAN KUANTITI BAHAN
BILANGAN MOL DAN BILANGAN
ZARAH
• Penggunaan unit mol adalah sama seperti
penggunaan unit dozen
• .Misalnya, 2 dozen pensel mewakili 2 ×
12 atau 24 batang pensel.
• Dengan cara yang sama, pemalar
Avogadro, NA digunakan sebagai faktor
penukaran antara bilangan mol dengan
bilangan zarah.
• Pemalar Avogadro dinamakan
PEMALAR sempena nama seorang ahli sains
AVOGADRO terkenal berbangsa Itali, iaitu Amedeo
Avogadro (1776 -1856).
BILANGAN MOL DAN JISIM BAHAN
• Bilangan mol bagi sesuatu bahan adalah
mustahil untuk ditentukan dengan
menghitung bilangan zarah sesuatu
bahan.
• Oleh itu, bagi mendapatkan bilangan
mol, jisim sesuatu bahan tersebut
perlulah disukat dan jisim molar perlulah
diketahui.
• Jisim bagi sebarang pecahan mol sesuatu
bahan boleh ditimbang, misalnya 12 g
karbon untuk 1 mol karbon, 6 g serbuk
karbon untuk 0.5 mol karbon dan
seterusnya.
• Jisim molar digunakan sebagai faktor
penukaran antara bilangan mol dengan
jisim bahan.
• Menyukat isi padu sesuatu gas adalah
lebih mudah berbanding dengan
menyukat jisimnya kerana gas amat
ringan
BILANGAN MOL
DAN ISI PADU • Melalui kajian, ahli kimia mendapati isi
GAS padu bagi 1 mol sebarang gas
mempunyai nilai yang sama pada
keadaan suhu dan tekanan yang sama.
• Jadi, konsep isi padu molar dikemukakan.
3.3 FORMULA
KIMIA
FORMULA KIMIA
• Formula kimia ialah perwakilan
sesuatu bahan kimia dengan
menggunakan huruf bagi
mewakili atom dan nombor
subskrip untuk menunjukkan
bilangan setiap jenis atom yang
terdapat di dalam entiti asas
bahan itu.
• Formula empirik ialah formula
kimia yang menunjukkan nisbah
paling ringkas bagi bilangan
atom setiap jenis unsur dalam
sesuatu sebatian.
FORMULA
EMPIRIK • Formula molekul pula ialah
formula kimia yang
menunjukkan bilangan sebenar
atom setiap jenis unsur yang
terdapat di dalam satu molekul
sesuatu sebatian.
PENENTUAN FORMULA EMPIRIK
• Formula empirik diperoleh melalui
analisis peratus komposisi sesuatu
bahan.
• Hal ini dilakukan dengan
menentukan nisbah paling ringkas
bilangan mol atom setiap unsur
yang berpadu melalui eksperimen.
• Bagi logam reaktif seperti magnesium, logam hanya
perlu dipanaskan sedikit sebelum dapat bertindak
balas dengan oksigen di udara.
• Namun begitu, kaedah ini tidak sesuai digunakan untuk penentuan formula
empirik bagi kuprum(II) oksida kerana kuprum kurang reaktif terhadap
oksigen.
• Oleh itu, kuprum(II) oksida perlu dipanaskan dalam aliran gas hidrogen
supaya hidrogen dapat menyingkirkan oksigen daripada oksida tersebut
PENENTUAN FORMULA MOLEKUL
FORMULA KIMIA SEBATIAN ION
• Sebatian ion terdiri daripada kation,
iaitu ion bercas positif dan anion,
iaitu ion bercas negatif.
• Bagi menulis formula kimia sebatian
ion, formula kation dan anion perlu
diketahui
PENAMAAN SEBATIAN KIMIA
PENAMAAN SEBATIAN KIMIA
• Sebatian kimia dinamakan secara sistematik berdasarkan
saranan yang dibuat oleh Kesatuan Antarabangsa Kimia
Tulen dan Gunaan.
• Sesetengah logam membentuk lebih daripada satu jenis ion.
Bagi membezakan ion-ion itu, huruf Roman digunakan
dalam penamaan.
• Misalnya, ferum membentuk dua jenis kation, iaitu Fe2+
dan Fe3+. Ion Fe2+ dinamakan sebagai ion ferum(II)
manakala ion Fe3+ dinamakan sebagai ion ferum(III).
• Bagi penamaan sebatian molekul yang ringkas,
unsur yang lebih elektropositif dinamakan terlebih
dahulu, diikuti dengan nama unsur yang lebih
elektronegatif.
• Nama unsur pertama dikekalkan manakala nama
unsur kedua mempunyai akhiran “ida”.
• Awalan Yunani digunakan untuk mewakili bilangan
atom setiap unsur dalam sebatian molekul ringkas.
3.4 PERSAMAAN
KIMIA
• Ahli kimia mempunyai cara yang
PERSAMAAN ringkas dan tepat untuk
KIMIA menghuraikan tindak balas kimia,
iaitu melalui persamaan kimia.
CARA MENULIS PERSAMAAN KIMIA
• Persamaan kimia boleh ditulis dalam bentuk perkataan
atau menggunakan formula kimia.
• Bahan pemula atau bahan tindak balas ditulis di sebelah
kiri persamaan, manakala bahan baharu yang terhasil atau
hasil tindak balas ditulis di sebelah kanan persamaan.
• Anak panah ‘˜’ mewakili ‘menghasilkan’.
• Keadaan fizik setiap bahan, iaitu sama ada pepejal(p),
cecair(ce), gas(g) atau larutan akueus(ak) juga ditunjukkan
dalam persamaan kimia.
PERSAMAAN
KIMIA
• Persamaan kimia haruslah
seimbang.
• Berdasarkan hukum keabadian
jisim, jirim tidak boleh dicipta
atau dimusnahkan.
• Oleh itu, bilangan atom bagi
setiap jenis unsur pada kedua-dua
belah persamaan mestilah sama.
MENGGUNAKAN PERSAMAAN
KIMIA
• Persamaan kimia boleh ditafsirkan
secara kualitatif dan kuantitatif.
• Melalui aspek kualitatif, persamaan
kimia membolehkan kita mengenal
pasti bahan tindak balas dan hasil
tindak balas serta keadaan fizik bahan.
• Melalui aspek kuantitatif pula, kita boleh mengkaji stoikiometri persamaan
kimia.
• Stoikiometri ialah kajian kuantitatif komposisi bahan yang terlibat dalam
tindak balas kimia.
• Pekali dalam persamaan kimia menunjukkan nisbah bahan yang terlibat,
sama ada sebagai nisbah entiti asas bahan mahupun nisbah bilangan mol.
• Berdasarkan nisbah bilangan mol bahan daripada
persamaan kimia yang seimbang, kita boleh
menyelesaikan pelbagai masalah numerikal dengan
menghitung secara perkadaran bilangan mol bahan yang
dikehendaki.
• Bilangan mol yang telah ditentukan boleh ditukar
kepada jisim, bilangan zarah atau isi padu gas melalui
jisim molar, pemalar Avogadro atau isi padu molar dengan
menggunakan hubung kait yang telah dipelajari sebelum
ini.
TAMAT
Anda mungkin juga menyukai
- Bab9 HABADokumen76 halamanBab9 HABAFidree Aziz85% (13)
- UNIT 4 Tindak Balas KimiaDokumen13 halamanUNIT 4 Tindak Balas KimiaJamrah JelaniBelum ada peringkat
- Amali Kimia T4 Dan T5Dokumen4 halamanAmali Kimia T4 Dan T5nurulabror75% (4)
- 3.2 Haba PenyesaranDokumen13 halaman3.2 Haba PenyesaranJordon AlvaradoBelum ada peringkat
- Fizik 1 Trial SPM SBP 2006Dokumen27 halamanFizik 1 Trial SPM SBP 2006nani98Belum ada peringkat
- Bab 3 - DAYA DAN TEKANAN Modul Fizik SPM Bahasa MelayuDokumen23 halamanBab 3 - DAYA DAN TEKANAN Modul Fizik SPM Bahasa MelayuCikgu Faizal100% (4)
- Gas AdiDokumen6 halamanGas AdiVikki Chan KjBelum ada peringkat
- 3.3 Pergerakan Bahan Merentasi Membran Plasma Dalam Organisma HidupDokumen37 halaman3.3 Pergerakan Bahan Merentasi Membran Plasma Dalam Organisma Hidupwickedbiology101100% (1)
- Soalan 1Dokumen4 halamanSoalan 1anon_5520482Belum ada peringkat
- 10 Keradioaktifan GDokumen44 halaman10 Keradioaktifan GMaZs AmIrulBelum ada peringkat
- Fizik - Kertas 1 Peperiksaan Pertengahan Tahun MPP2 Terengganu 2020 - SoalanDokumen28 halamanFizik - Kertas 1 Peperiksaan Pertengahan Tahun MPP2 Terengganu 2020 - SoalanNUR BALQIS BINTI JAFAR MoeBelum ada peringkat
- Praktis Kimia Bab 7 T4?Dokumen5 halamanPraktis Kimia Bab 7 T4?Hemendren ManimaranBelum ada peringkat
- 2021 K2 Matematik Tingkatan5 MPSMDokumen26 halaman2021 K2 Matematik Tingkatan5 MPSMyatee ramliBelum ada peringkat
- Bank Soalan Biologi Kertas 2Dokumen107 halamanBank Soalan Biologi Kertas 2hanafiza100% (2)
- RedoksDokumen85 halamanRedoksSHARIN HANUM AB RAHMANBelum ada peringkat
- Buat Bateri Daripada KentangDokumen3 halamanBuat Bateri Daripada KentangRopiah NoorBelum ada peringkat
- Eksperimen Kadar KeterlarutanDokumen4 halamanEksperimen Kadar KeterlarutanAh TaiBelum ada peringkat
- Bab 1 - Progression Tingkatan 5Dokumen22 halamanBab 1 - Progression Tingkatan 5Deen ZakariaBelum ada peringkat
- Koleksi Topikal Soalan Percubaan SPM Matematik 2021Dokumen44 halamanKoleksi Topikal Soalan Percubaan SPM Matematik 2021Nuan Ting NgBelum ada peringkat
- Assignment SpreadsheetDokumen12 halamanAssignment SpreadsheethoneysizukaBelum ada peringkat
- LAPORAN AMALI NelsonDokumen12 halamanLAPORAN AMALI NelsonNelson BernardBelum ada peringkat
- Amali 2 AloiDokumen2 halamanAmali 2 AloiAchett AmidBelum ada peringkat
- Nota SBEDokumen6 halamanNota SBEChong Wai LeongBelum ada peringkat
- Persamaan Dan PerbezaanDokumen1 halamanPersamaan Dan Perbezaankembara08100% (1)
- Math SPM Trial 2018 Kedah P2&Ans PDFDokumen53 halamanMath SPM Trial 2018 Kedah P2&Ans PDFLalitha ManiamBelum ada peringkat
- Eksperimen Ting 4 (Jawapan) (Takat Didih Dan Kekonduksian Elektrik)Dokumen3 halamanEksperimen Ting 4 (Jawapan) (Takat Didih Dan Kekonduksian Elektrik)NainBelum ada peringkat
- Panduan Amali FizikDokumen6 halamanPanduan Amali Fizikzila100% (1)
- Modul Back To Basic KimiaDokumen14 halamanModul Back To Basic Kimiaanon_991690121Belum ada peringkat
- Rumusan 3 BahanDokumen3 halamanRumusan 3 BahanHAFIZBelum ada peringkat
- Trial BIO 2 2021 - 220310 - 222853 KedahDokumen23 halamanTrial BIO 2 2021 - 220310 - 222853 KedahSHARIFAH BINTI MOHAMAD HADI MoeBelum ada peringkat
- Kelantan - Add Maths K1K2 Dan Skema K1K2 Trial SPM 2020Dokumen77 halamanKelantan - Add Maths K1K2 Dan Skema K1K2 Trial SPM 2020Faizilanor SutiaraBelum ada peringkat
- Sekolah Satu SesiDokumen4 halamanSekolah Satu SesiRaudhahNoordinBelum ada peringkat
- Konsep Belon Udara PanasDokumen1 halamanKonsep Belon Udara PanasMohd AzifBelum ada peringkat
- Penulisan Persamaan Kimia Seimbang 2018Dokumen9 halamanPenulisan Persamaan Kimia Seimbang 2018Mohd Jamalil Azam MustafaBelum ada peringkat
- Addmaths LatihanDokumen26 halamanAddmaths LatihanÅyå ThɇChḁinSäw-Mäniäc Drèvïs100% (1)
- Experiment Bio f4 PDFDokumen33 halamanExperiment Bio f4 PDFNUR BATRISYIA AMALYA100% (1)
- Soalan PeneutralanDokumen6 halamanSoalan PeneutralanABDUL MANAF BIN CHE AMAT MoeBelum ada peringkat
- 6.6 BMDokumen2 halaman6.6 BMfisabil84Belum ada peringkat
- BAB 4 - Komposisi Kimia Dalam SelDokumen15 halamanBAB 4 - Komposisi Kimia Dalam SelMazzianty GhazaliBelum ada peringkat
- Termokimia NotaDokumen4 halamanTermokimia NotaSarah WongBelum ada peringkat
- Kumpulan 17Dokumen19 halamanKumpulan 17Theesha SophieBelum ada peringkat
- 3.4 Haba PeneutralanDokumen19 halaman3.4 Haba PeneutralanNajwaAbdullahBelum ada peringkat
- Nota GaramDokumen1 halamanNota GaramHafinaz BahariBelum ada peringkat
- Amali BIO TAK BerpanduDokumen3 halamanAmali BIO TAK BerpanduAmrienaBelum ada peringkat
- Bab 6.4 PembelauanDokumen8 halamanBab 6.4 PembelauanNiekey JohnBelum ada peringkat
- Modul GERAKAN AIR DAN UDARADokumen10 halamanModul GERAKAN AIR DAN UDARANorliyana AliBelum ada peringkat
- Jadual TiraniDokumen2 halamanJadual TiraniAnonymous TtWCRO5sxy0% (1)
- Amali TransformerDokumen4 halamanAmali TransformerVoid DesBelum ada peringkat
- Aplikasi Prinsip Keabadiaan MomentumDokumen2 halamanAplikasi Prinsip Keabadiaan MomentumRoziah Mohamad0% (1)
- Perbezaan Alkana Dan AlkenaDokumen5 halamanPerbezaan Alkana Dan AlkenaLau Yong King100% (1)
- 23-Kimia-Modul-Tingkatan 5-Modul TermokimiaDokumen28 halaman23-Kimia-Modul-Tingkatan 5-Modul TermokimiaZulBelum ada peringkat
- BAB 6.11 Mekanisme FotosintesisDokumen14 halamanBAB 6.11 Mekanisme FotosintesisNorazamaton Aida100% (2)
- Amali Fotosintesis 1Dokumen10 halamanAmali Fotosintesis 1PuvendranBelum ada peringkat
- Modul 8 Sukatan MembulatDokumen29 halamanModul 8 Sukatan MembulataliifismailBelum ada peringkat
- Resume Kimia Nur Isyams S.I.DDokumen3 halamanResume Kimia Nur Isyams S.I.DPatria WibowoBelum ada peringkat
- Kimia Dasar PendahuluanDokumen61 halamanKimia Dasar PendahuluanAprilia MedatuaBelum ada peringkat
- Analis StoikiometriDokumen20 halamanAnalis StoikiometriSulis putri Sipil DBelum ada peringkat
- Atom, Unsur, Molekul, SenyawaDokumen33 halamanAtom, Unsur, Molekul, Senyawa199 shjtBelum ada peringkat
- Kimia Dasar - Kel6 - 1Dokumen24 halamanKimia Dasar - Kel6 - 1muhabizartrigandi14Belum ada peringkat
- Percobaan 3Dokumen23 halamanPercobaan 3Maha OktegaBelum ada peringkat
- Chemistry 21Dokumen55 halamanChemistry 21Agape AnggaraBelum ada peringkat
- Ting. 2 KSSM Bab 4Dokumen18 halamanTing. 2 KSSM Bab 4arasiBelum ada peringkat
- Pat Sains T2Dokumen12 halamanPat Sains T2Fidree Aziz100% (1)
- Bab 11 SainsDokumen4 halamanBab 11 Sainsfidah100% (1)
- F2 C11malayDokumen33 halamanF2 C11malayFidree AzizBelum ada peringkat
- Ting2 Bab3 NutrisiDokumen103 halamanTing2 Bab3 NutrisiAbdul Rahman B. NarawiBelum ada peringkat
- Ting2 Bab3 NutrisiDokumen103 halamanTing2 Bab3 NutrisiAbdul Rahman B. NarawiBelum ada peringkat
- 12 Sistem SuriaDokumen42 halaman12 Sistem SuriaFidree AzizBelum ada peringkat
- Ting. 2 KSSM Bab 4Dokumen18 halamanTing. 2 KSSM Bab 4arasiBelum ada peringkat
- F2 C11malayDokumen33 halamanF2 C11malayFidree AzizBelum ada peringkat
- Ting2 Bab3 NutrisiDokumen103 halamanTing2 Bab3 NutrisiAbdul Rahman B. NarawiBelum ada peringkat
- Bab 4 - Kesihatan ManusiaDokumen20 halamanBab 4 - Kesihatan ManusiaFidree AzizBelum ada peringkat
- Bab 4 - Kesihatan ManusiaDokumen20 halamanBab 4 - Kesihatan ManusiaFidree AzizBelum ada peringkat
- F2 C11malayDokumen33 halamanF2 C11malayFidree AzizBelum ada peringkat
- Bab11 Bintang Dan Galaksi Dalam Alam SemestaDokumen21 halamanBab11 Bintang Dan Galaksi Dalam Alam SemestaFidree Aziz71% (7)
- Bab11 Bintang Dan Galaksi Dalam Alam SemestaDokumen21 halamanBab11 Bintang Dan Galaksi Dalam Alam SemestaFidree Aziz71% (7)
- 12 Sistem SuriaDokumen42 halaman12 Sistem SuriaSyakirYusof100% (1)
- 12 Sistem SuriaDokumen42 halaman12 Sistem SuriaSyakirYusof100% (1)
- Ujian Anion & Kation EditedDokumen2 halamanUjian Anion & Kation EditedFidree Aziz50% (2)
- F2 C11malayDokumen33 halamanF2 C11malayFidree AzizBelum ada peringkat
- Bab11 Bintang Dan Galaksi Dalam Alam SemestaDokumen21 halamanBab11 Bintang Dan Galaksi Dalam Alam SemestaFidree Aziz71% (7)
- Bab 4 - Kesihatan ManusiaDokumen20 halamanBab 4 - Kesihatan ManusiaFidree AzizBelum ada peringkat