1.1 Ebook Asam Basa
Diunggah oleh
Yosef Kristian TirtaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
1.1 Ebook Asam Basa
Diunggah oleh
Yosef Kristian TirtaHak Cipta:
Format Tersedia
BAB IV
ASAM BASA
Pendahuluan
Dalam kehidupan sehari-hari asam dan basa telah banyak digunakan dalam untuk berbagai
keperluan. Asam dan basa ikut berperan dalam berbagai hal, mulai dari yang kalian makan
hingga obat yang kalian minum dan bahkan produk pembersih yang kalian gunakan. Tanpa
asam dan basa, banyak produk yang kalian gunakan saat ini tidak berguna.
Teori Asam Basa
pH
Titrasi Asam
Basa
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 1
ASAM BASA
Asam Basa dalam Kehidupan
Berikut ini beberapa benda di sekitar kita yang bersifat asam dan basa.
ASAM BASA
• Asam asetat (CH3COOH): cuka, asam asetat • Ammonium hidroksida (NH4OH):
• Asam asetilsalisilat (HOOCC6H4OOCCH3): pembersih kaca
aspirin • Kalsium hidroksida (Ca(OH)2): kapur
• Asam askorbat (H2C6H6O6): vitamin C kaustik, mortir, plester
• Asam karbonat (H2CO3): minuman ringan, • Magnesium hidroksida (Mg(OH)2):
air seltzer antasida (obat maag)
• Asam sitrat (C6H8O7): buah jeruk, perasa • Natrium hidroksida (NaOH): alkali,
buatan pembersih pipa saluran dan oven
• Asam nitrat (HNO3): pupuk, bahan peledak
• Asam sulfat (H2SO4): aki mobil
A. TEORI ASAM BASA
Pengertian asam dan basa dari suatu larutan dapat dijelaskan menggunakan
beberapa teori, yaitu teori asam basa.
Teori yang dikemukakan oleh para ahli antara lain:
1. Teori Arrhenius
Svante Arrhenius (1859-1927) mengemukakan teori asam basa untuk larutan
dengan pelarut air. Sebagai contoh, hidrogen klorida dalam air terionisasi
menghasilkan ion hidrogen.
HCl(g)H→
2O
H+(aq) + Cl-(aq) atau bisa ditulis HCl(aq) → H+(aq) + Cl-(aq)
Menurut Arrhenius, hidrogen klorida yang dilarutkan dalam air bersifat asam.
Jadi, bagaimana pengertian asam menurut teori Arrhenius?
………………………………………………………………………………………
………………………………………………………………………………………
……………………………………………………………………………………
Berbeda dengan hidrogen klorida, natrium hidroksida (NaOH) jika dilarutkan
dalam air akan terionisasi menghasilkan ion OH- dan bersifat basa.
H2O
NaOH(s) → Na+(aq) + OH-(aq) atau bisa ditulis NaOH(aq) → Na+(aq) + OH-(aq)
Bagaimana pengertian basa menurut teori Arrhenius?
………………………………………………………………………………………
………………………………………………………………………………………
……………………………………………………………………………………
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 2
Dengan mengacu pada definisi asam-basa Arrhenius, manakah dari zat-zat
berikut jika dilarutkan dalam air bersifat asam atau basa? Tuliskan reaksi
ionisasinya! Coret salah satu pada pilihan (asam/basa)
• Ba(OH)2 → …………………………………………………………………………….…(asam/basa)
• HCOOH ⇄………………………………………………………………………………...(asam/basa)
• HF ⇄ ……………………………………………………………………………………....(asam/basa)
• KOH → …………………………………………………………………………………(asam/basa)
• CH3COOH ⇄ …………………………………………………………………………(asam/basa)
Beberapa hal yang berkaitan dengan asam basa tidak dapat dijelaskan dengan
menggunakan teori Arrhenius, sehingga kekurangan teori asam basa Arrhenius
adalah:
1. Teori Arrhenius hanya dapat menjelaskan reaksi yang terjadi pada air saja,
tidak dapat menjelaskan reaksi selain pelarut air.
2. Teori Arrhenius tidak mampu menjelaskan alasan beberapa senyawa yang
mengandung H atau hidrogen bukan termasuk asam, seperti CH4, NH3.
3. Tidak dapat menjelaskan alasan mengapa suatu senyawa yang tidak memiliki
ion OH-, contoh Na2CO3 memiliki sifat dan karakteristik seperti basa.
Untuk mendefinisikan konsep asam basa yang tidak dapat dijelaskan oleh
Arrhenius, ilmuwan lain memberikan teori asam basa dengan konsep yang
berbeda.
2. Teori Bronsted- Lowry
Pada tahun 1923, Johannes Bronsted dan Thomas Lowry memberikan asumsi
bahwa asam akan memberikan satu ion H+ pada ion atau molekul pasangan
reaksinya yang bertindak sebagai basa (asam adalah donor proton atau donor
ion H+), sedangkan basa merupakan penerima proton. Teori itu disebut dengan
konsep asam basa Bronsted-Lowry.
Contoh: HCl(g) + H2O(l) ⇄ H3O+(aq) + Cl-(aq)
Gambar di atas menunjukkan bahwa pada reaksi dari kiri ke kanan, HCl bersifat
asam dan H2O bersifat basa.
Lalu bagaimana dengan reaksi dari kanan ke kiri?
Apa sifat H3O+ dan Cl-?
HCl(g) + H2O(l) ⇄ Cl-(aq) + H3O+(aq)
Asam Basa ……… …..…..
Ternyata dari reaksi bolak balik di atas terdapat pasangan asam basa yang
kemudian disebut asam basa konjugasi atau konjugat (berasal dari bahasa Latin
yang berarti “pasangan”). Setiap asam yang berlaku sebagai donor H+ sekaligus
membentuk basa konjugat.
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 3
Sebagai contoh, jika suatu asam HA mendonorkan ion H+ pada air, salah satu produk
reaksinya adalah ion A-.
Jadi ion A- adalah basa konjugat dari HA.
HA + H2O ⇄ H3O+ + A-
asam basa konjugat
Sebaliknya, setiap basa menerima satu ion H+ sekaligus membentuk asam konjugat.
HA + H2O ⇄ H3O+ + A-
basa as. konjugat
Lengkapilah tabel di bawah ini sesuai dengan asam atau basa konjugasinya!
Asam Basa Konjugasi
H3O+ H2O
H2O ………….
……… O2-
………. Cl-
H2SO4 ………….
NH4+ ………….
………... NH2-
Perhatikan kembali reaksi asam basa berikut:
HCl(g) + H2O(l) ⇄ H3O+(aq) + Cl-(aq)
Asam Basa
Menurut teori Bronsted-Lowry, molekul H2O berlaku sebagai basa karena mengikat
sebuah proton yang berasal dari molekul HCl. Mengapa molekul H2O dapat
mengikat proton tersebut? Teori Bronsted-Lowry memiliki kelemahan yaitu tidak
mampu menjelaskan alasan suatu reaksi asam dengan basa dapat terjadi tanpa adanya
transfer proton dari yang bersifat asam ke yang bersifat basa. Alasan tersebut dapat
dijelaskan pada teori Asam Basa Lewis.
3. Teori Lewis
Perhatikan reaksi di bawah ini!
..
H2O + H+ → H3O+
Basa
Apabila reaksi diperhatikan dari sudut pembentukan ikatan kimianya, ternyata
penyerapan ion H+ oleh molekul H2O dapat terjadi karena molekul H2O dapat
mendonorkan pasangan elektron bebas kepada ion H+ melalui pembentukan kovalen
koordinasi.
Teori asam basa berdasarkan serah terima pasangan elektron tersebut dikemukakan
oleh Gilbert N. Lewis dan dikenal dengan konsep asam basa Lewis. Bagaimana
pengertian asam dan basa menurut Lewis?
………………………………………………………………………………………
………………………………………………………………………………………
………………………………………………………………………………………
………………………………………………………………………………………
……………………………………………………………………………………
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 4
B. KEKUATAN ASAM DAN BASA
1. Asam Kuat
Asam kuat terionisasi sempurna atau hampir sempurna dalam air (100%). Asam
lemah terionisasi kurang dari 100% dalam air.
Tabel Asam Kuat
Nama Asam Rumus Reaksi ionisasi
Asam sulfat H2SO4 H2SO4 → 2H+ + SO42-
Asam nitrat HNO3 HNO3 → H+ + NO3-
Asam bromida HBr HBr → H+ + Br-
Asam iodida HI HI → H+ +I-
Asam klorida HCl HCl → H+ + Cl-
Asam klorat HClO3 HClO3 → H+ + ClO3-
Asam perklorat HClO4 HClO4 → H+ + ClO4-
Tabel Asam Lemah
Nama Asam Rumus Kimia Ionisasi Nilai Ka
Asam fluorida HF HF(aq) ⇄ H (aq) + F-(aq)
+ 7,2 x 10-4
Asam sianida HCN HCN(aq) ⇄ H+ (aq) + CN-(aq) 6 x 10-10
Asam asetat CH3COOH CH3COOH(aq) ⇄ H+(aq) + CH3COO-(aq) 1,75 x 10-5
Asam sulfida H2S H2S(aq) ⇄ H+(aq) + HS-(aq) Ka1 = 1 x 10-7
HS-(aq) ⇄ H+(aq) + S2-(aq) Ka2 = 1,3 x 10-13
Asam H2CO3 H2CO3(aq) ⇄ H+(aq) + HCO3-(aq) Ka1 = 4,5 x 10-7
karbonat HCO3-(aq) ⇄ H+(aq) + CO32-(aq) Ka2 = 4,7 x 10-11
Asam fosfat H3PO4 H3PO4(aq) ⇄ H+(aq) + H2PO4-(aq) Ka1 = 7,1 x 10-3
H2PO4-(aq) ⇄ H+(aq) + HPO42-(aq) Ka2 = 6,3 x 10-8
HPO42-(aq) ⇄ H+(aq) + PO43-(aq) Ka3 = 4,2 x 10-15
dan lain-lain
2. Basa Kuat
Contoh Basa Lemah
No Nama Asam Rumus Kimia Ionisasi Nilai Kb
1 Amonia NH3 NH3(aq) + H2O(l) ⇄ NH4+ (aq)+ OH-(aq) 1,8 x 10-5
2 Berelium hidroksida Be(OH)2 Be(OH)2(aq)) ⇄ Be2+ (aq)+ OH-(aq) 5 x 10-11
3 Seng hidroksida Zn(OH)2 Zn(OH)2(aq) ⇄ Zn2+ (aq)+ 2OH-(aq) 9,6 x 10-4
4 Perak hidroksida AgOH AgOH(aq) ⇄ Ag+ (aq)+ OH-(aq) 1,1 x 10-4
5 dan lain-lain
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 5
C. DERAJAT KEASAMAN (pH)
Kesetimbangan air
Air merupakan elektrolit yang sangat lemah karena sebagian kecil dari molekul
air terionisasi dengan reaksi:
H2O(l) ⇄ H+ (aq)+ OH-(aq)
Reaksi di atas merupakan reaksi kesetimbangan, sehingga berlaku hukum
kesetimbangan:
[H+ ][OH− ]
K= [H2 O]
Air murni mempunyai konsentrasi yang tetap sehingga hasil kali konsentrasi air
murni dengan K akan menghasilkan nilai yang tetap.
K[H2O] = [H+][OH-] = tetap
Oleh karena nilai K[H2O] tetap, tetapan kesetimbangan air dinyatakan sebagai
tetapan ionisasi air dan diberi lambing Kw.
Kw = [H+][OH-]
Pada suhu kamar T= 25°C, konsentrasi kedua ion tersebut dalam air adalah sama,
yaitu 1,0 x 10-7 mol/L
[H+] = [OH-] = 10-7,,sehingga Kw = [H+] [OH-] = 10-14
1. Konsep pH
pH merupakan nilai derajat keasaman /kebasaan dari suatu larutan.
pH menujukkan aktivitas ion hidrogen dalam larutan.
Untuk derajat kebasaan dikenal dengan pOH.
Karena pada air yang netral
[H+] = [OH-]= 10-7 maka
pH = pOH = 7 (netral)
pH < 7 atau pOH > 7 bersifat asam
pH > 7 atau pOH < 7 bersifat basa
Rumus menghitung pH
pH = - log [H+] pH = 14 – pOH
pOH = -log [OH-] pOH = 14 – pH
Ingat,
Kw = [H+][OH-] = 10-14
pKw = - log 10-14
pKw = 14
pKw = pH + pOH = 14
Mencari [H+] dan [OH-]
a. [H+] asam kuat, tergantung pada konsentrasi larutan dan valensi
[H+] asam kuat = M x a Keterangan:
M = molaritas larutan asam
a = valensi asam = jumlah H
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 6
Contoh asam kuat H2SO4 dengan konsentrasi 0,1M
Konsentrasi H+ dapat dicari melalui reaksi seperti ini:
H2SO4 (aq) → 2H+(aq) + SO42-(aq)
0,1 M 0,2M
atau dapat dicari menggunakan rumus
[H+] = M x a
= 0,1 x 2
= 0,2
b. [OH-] basa kuat, tergantung pada konsentrasi larutan dan valensi
[OH-] basa kuat = M x b Keterangan:
M = molaritas larutan basa
b = valensi basa = jumlah OH
Apabila molaritas belum diketahui bisa dicari menggunakan rumus:
massa (g) 1000
M= g x
Mr ( ) V (mL)
mol
c. [H+] asam lemah, tergantung pada konsentrasi larutan dan konstanta asam lemah (Ka)
Contoh pada asam lemah HA yang dilarutkan dalam air mengalami ionisasi
sebagian
HA(aq) + H2O(l) ⇄ H3O+(aq) + A-(aq)
[H3 O+ ][A− ]
Ka = [HA]
Ka asam lemah berpengaruh pada [H+], sehingga didapatkan persamaan:
[H+] = √Ka . M
d. Pada basa lemah:
[OH-] = √Kb . M
[H+] dan [OH-] juga bisa dihitung apabila derajat ionisasi/derajat disosiasi (α)
diketahui.
[H+] = M . α
[OH-] = M . α
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 7
Silakan Dicoba!
1. Tunjukkan spesi yang bertindak sebagai asam dan basa serta pasangan asam-
basa konjugasinya dalam persamaan reaksi berikut !
a. H2O(l) + NH3(aq) ⇌ NH4+(aq) + OH-(aq)
b. H2PO4-(aq) + H2O(l) ⇌ H3PO4(aq) + OH-(aq)
c. HPO42-(aq) + H2O(l) ⇌ PO43-(aq) + H3O+(aq)
d. HCN(aq) + H2O(aq) ⇌ CN-(aq) + H3O+(aq)
e. NH3(l) + NH3(l) ⇌ NH4+(l) + NH2-(l)
2. Buatlah struktur Lewis dari persamaan reaksi berikut, kemudian tentukan spesi
yang berperan sebagai asam dan basa Lewis ! (Nomor atom S=16, H=1, O=8,
C=6)
a. SO3 + H2O → H2SO4
b. H2O + CO2 → H2CO3
3. Perhatikan tabel Ka dan beberapa asam berikut:
Berdasarkan data Ka, urutkan larutan asam di atas mulai dari asam paling lemah
ke larutan yang asamnya paling kuat!
4. Hitunglah pH dari:
a. Larutan HCl 2 M
b. Larutan H2SO4 0,5 M
c. Larutan HNO3 0,01 M
d. Larutan H2CO3 0,1 M (Ka H2CO3 = 4 x 10-7)
e. Larutan CH3COOH 0,1 M (Ka CH3COOH = 1 x 10-5)
f. Larutan H3PO4 0,2 M, derajat ionisasinya 60%
g. Larutan H2SO3 2 M, α = 0,5
h. Larutan yang dibuat dengan melarutkan 8 gram NaOH dalam 250 mL air. (Ar
Na=23, O=16, H=1)
D. INDIKATOR ASAM BASA
Indikator asam basa adalah senyawa khusus yang ditambahkan pada larutan,
dengan tujuan mengetahui kisaran pH dalam larutan tersebut. Indikator asam
basa biasanya adalah asam atau basa organik lemah. Senyawa indikator yang tak
terdisosiasi akan mempunyai warna berbeda dibanding dengan indikator yang
terionisasi. Sebuah indikator asam basa tidak mengubah warna dari larutan
murni asam ke murni basa pada konsentrasi ion hidrogen yang spesifik,
melainkan hanya pada kisaran konsentrasi ion hidrogen. Kisaran ini merupakan
suatu interval perubahan warna, yang menandakan kisaran pH.
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 8
1. Indikator Alami
Indikator alami terbuat dari ekstrak tumbuh-tumbuhan yang jika dimasukkan ke
dalam larutan asam dan larutan basa akan menghasilkan warna yang berbeda.
Beberapa contoh indikator alami
Perubahan warna pada larutan pH 2 sampai 11
ketika diberi indikator alami ekstrak kubis ungu
2. Indikator Buatan
a. Kertas Lakmus
Asam Basa Netral
Lakmus Merah Tetap Merah Menjadi Biru Tetap Merah
Lakmus Biru Menjadi Merah Tetap Biru Tetap Biru
b. Indikator Universal
Indikator universal merupakan campuran dari bermacam-macam indikator
yang dapat menunjukkan pH suatu larutan dari perubahan warnanya.
Indikator universal ada dua macam yaitu indikator yang berupa kertas dan
larutan. Indikator kertas berupa kertas serap dan tiap kotak kemasan indikator
jenis ini dilengkapi dengan peta warna. Penggunaannya sangat sederhana,
sehelai indikator dicelupkan ke dalam larutan yang akan diukur pH-nya.
Kemudian dibandingkan dengan peta warna yang tersedia.
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 9
c. Larutan Indikator
No. Indikator Perubahan Warna Trayek pH
1. Metil Merah(MM) Merah-Kuning 4,4 – 6,0
2. Metil Orange (MO) Merah-Kuning 3,2 – 4,4
3. Bromtimol Biru (BTB) Kuning-Biru 6,0 – 7,6
4. Fenolftalein (PP) Tak berwarna-Merah 8,3 – 10,0
Contoh, pada pengujian larutan X menggunakan beberapa indicator diperoleh
data sebagai berikut:
Larutan Warna Sampel Warna sampel setelah ditambahkan Indikator
No.
(sampel) mula-mula MM MO BTB PP
1. Larutan X Tak berwarna Kuning Kuning Biru Tak berwarna
Dari hasil di atas dapat diperoleh perkiraan pH larutan X:
No. Indikator Perubahan Warna Trayek pH Warna Hasil Perkiraan
Percobaan pH
1. Metil Merah Merah-Kuning 4,4 – 6,0 Kuning > 6,0
2. Metil Orange Merah-Kuning 3,2 – 4,4 Kuning > 4,4
3. Bromtimol Biru Kuning-Biru 6,0 – 7,6 Biru >7,6
4. Fenolftalein Tak berwarna-Merah 8,3 – 10,0 Tak berwarna <8,3
Rentang pH larutan X dapat diketahui dengan menggunakan garis bilangan
Sehingga perkiraan rentang pH larutan X adalah 7,6 < pH < 8,3
Silakan Dicoba!
1. Data percobaan penentuan pH suatu larutan sebagai berikut.
Trayek perubahan
Indikator Perubahan warna Warna larutan
warna
MO 3,1 – 4,4 Merah – kuning Jingga
MM 4,4 – 6,2 Merah – kuning Merah
BTB 6,0 – 7,6 Kuning – biru Kuning
PP 8,3 - 10 Tak berwarna –merah Tak berwarna
Dari data di atas, tentukan perkiraan pH larutan tersebut
2. Trayek pH indiktor klorofenol merah adalah 4,8 – 6,4 dengan warna kuning –
merah. Bagaimana warna indikator tersebut bila diteteskan pada larutan :
a. CH3COOH 0,1 M (Ka = 10-5)
b. NaOH 0,01 M
c. Air murni
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 10
E. REAKSI ASAM BASA
Bagaimana menghitung pH asam dan basa yang dicampur (direaksikan)?
asam + basa → garam + air
Cara menghitung pH:
Hitung masing-masing mol asam dan basa, kemudian gunakan M, R, S
Jika yang sisa adalah :
✓ Asam kuat, [H+] = Mcampuran x valensi
✓ Basa kuat, [OH-] = Mcampuran x valensi
✓ Asam lemah, dipelajari pada bab berikutnya
✓ Basa lemah, dipelajari pada bab berikutnya
✓ Tidak ada sisa, dipelajari pada bab berikutnya
Contoh:
Hitung pH campuran dari 10 mL larutan HCl 0,5M dan 15 mL larutan NaOH 0,1M!
Jawab :
Mol HCl = M x V = 0,5 M x 10 mL = 5 mmol
Mol NaOH = M x V = 0,1 M x 15 mL = 1,5 mmol (pereaksi pembatas)
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
M 5 mmol 1,5 mmol - -
R 1,5 mmol 1,5 mmol 1,5 mmol 1,5 mmol
S 3,5 mmol - 1,5 mmol 1,5 mmol
mol HCl sisa 3,5 mmol
M camp = = = 0,14 M
volume campuran 25 mL
[H+] = Mcampuran x valensi = 0,14 M x 1 = 0,14 M = 1,4 x 10-1
pH = - log [H+] = - log 1,4 x 10-1 = 1 – log 1,4
E. PENGENCERAN
Jika larutan asam ditambah dengan air maka tidak terjadi reaksi. Yang terjadi
hanya pengenceran larutan saja. Begitu juga dengan penambahan air pada
larutan basa. Untuk menghitung
atau larutan basa ditambah dengan air, maka dapat menggunakan rumus
pengenceran sebagai berikut:
V1 . M1 = V2 . M2
dimana V1 = volume mula-mula
M1 = molaritas mula-mula
V2 = volume setelah pengenceran
M2 = molaritas setelah pengenceran
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 11
Silakan Dicoba!
1. Sebanyak 150 mL larutan H2SO4 0,1 M dicampurkan dengan 50 mL larutan
Ca(OH)2 0,3 M. Tentukan pH campuran kedua larutan !
2. Hitunglah pH campuran yang terbentuk dari pencampuran larutan pH 1
sebanyak 60 mL dengan larutan pH 13 sebanyak 40 mL !
3. Larutan HClO4 2 M sebanyak 30 mL dapat dinetralkan oleh 60 mL larutan
Ca(OH)2. Hitunglah konsentrasi Ca(OH)2 tersebut !
4. Berapa gram Ca(OH)2 padat yang diperlukan untuk menetralkan 10 mL larutan
HNO3 0,05 M, jika diketahui Ar Ca = 40, O = 16, dan H = 1 !
5. Campuran NaOH dan KOH padat yang massanya 4,8 gram dapat menetralkan
100 mL larutan HCl 1 M. Berapa gram massa NaOH dan KOH dalam campuran
tersebut ! Ar Na = 23, K = 39, O = 16, H = 1.
6. Kedalam 100 mL larutan H2SO4 0,1 M ditambahkan 400 mL air, maka hitunglah
pH campuran yang terjadi!
G. TITRASI ASAM BASA
Titrasi adalah salah satu metode yang dipakai dalam analisis kimia kuantitatif
untuk menentukan konsentrasi suatu larutan yang belum diketahui
konsentrasinya dengan larutan yang sudah diketahui konsentrasinya.
Titrasi merupakan penarapan dari reaksi netralisasi.
Berikut ini beberapa istilah dalam titrasi.
• Larutan standar :
Larutan yang telah diketahui konsentrasinya secara akurat. Penentuan
konsenrasi larutan standar dilakukan melalui proses yang disebut dengan
standarisasi. Larutan standar ini juga bisa disebut sebagai titran.
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 12
• Analit :
Larutan zat yang akan ditentukan konsentrasinya secara titrimetri. Sebutan
lain dari analit adalah titer.
• Volume titrasi :
yaitu volume larutan standar yang diperlukan untuk melakukan satu kali
titrasi.
• Titik akhir titrasi :
Titik atau keadaaan dimana reaksi telah berjalan secara sempurna dimana
dapat kita amati dengan mengunakan mata telanjang. Titik akhir titrasi
merupakan signal dimana memberitahukan kita untuk memberhentikan
penambahan larutan standar.Titik akhir titrasi ini dapat diamati dengan
menggunakan indikator.
• Titik ekuivalen :
Titik atau keadaan dimana antara analit dengan larutan standar tepat bereaksi
secara stoikiometri. (asam tepat habis bereaksi dengan basa)
• Kesalahan titrasi :
perbedaan volume titik akhir titrasi dengan titik ekuivalen. Besar kecilnya
kesalahan titrasi ditentukan oleh pemilihan indikator, semakin tepat indikator,
semakin kecil kesalahan titrasinya.
Berikut ini kurva perubahan pH pada proses titrasi asam dan basa.
TITRASI ASAM KUAT DENGAN BASA KUAT TITRASI BASA KUAT DENGAN ASAM KUAT
TITRASI ASAM KUAT DENGAN BASA LEMAH TITRASI BASA LEMAH DENGAN ASAM KUAT
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 13
TITRASI BASA KUAT DENGAN ASAM LEMAH TITRASI ASAM LEMAH DENGAN BASA KUAT
Untuk menentukan konsentrasi larutan yang ingin diketahui melalui titrasi asam –
basa dapat digunakan rumus sebagai berikut.
a x Ma x Va = b x Mb x Vb
Keterangan :
a : valensi asam (jumlah ion H+)
Ma : konsentrasi asam
Va : volume asam
b : valensi basa (jumlah ion OH-)
Mb : konsentrasi basa
Vb : volume basa
Apabila molaritas suatu zat telah diketahui, dapat ditentukan kadar/persentase dari
zat tersebut menggunakan rumus :
Silakan Dicoba!
1. Berikut ini data hasil titrasi 25 mL asam karbonat (H2CO3) dengan natrium
hidroksida (NaOH) 0,1 M menggunakan indikator fenolftalein:
No. Volume H2CO3 (mL) Volume NaOH (mL)
1 25 19
2 25 20
3 25 21
Berdasarkan data di atas, hitunglah konsentrasi H2CO3 !
2. Sejumlah padatan NaOH (Ar Na=23, O=16, H=1) dilarutkan dalam 1000 mL air.
Dari larutan yang terbentuk diambil 20 mL larutan NaOH, kemudian dititrasi
dengan larutan H2SO4 0,1 M dan dibutuhkan 10 mL larutan H2SO4. Hitunglah
massa NaOH yang dilarutkan !
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 14
3. Berikut ini kurva titrasi 20 mL larutan NaOH
dengan larutan H2CO3 0,1 M. Jika volume
larutan H2CO3 yang diperlukan sebanyak 20
mL. Konsentrasi larutan NaOH yang dititrasi
adalah ?
4. Berikut ini kurva titrasi 20 mL larutan HCl
dengan larutan NH3 0,1 M. Jika volume
larutan NH3 yang diperlukan sebanyak 25
mL. Konsentrasi larutan HCl yang dititrasi
adalah ?
5. Perhatikan data percobaan titrasi 25 mL larutan asam sulfat dengan larutan
natrium hidroksida 0,1 M menggunakan indikator fenolftalein berikut ini!
Volum NaOH yang ditambahkan (mL) 17 19 20 21 23
Warna larutan setelah penambahan tak tak merah merah merah
NaOH berwarna berwarna muda
Konsentrasi larutan asam sulfat yang dititrasi tersebut adalah ...molar
6. Kadar asam asetat dalam cuka dapur merk X yang beredar di pasar Besar akan
ditentukan dengan metode titrasi. Buret diisi dengan larutan Ba(OH)2 0,1 M
hingga tepat 50 mL. Sebanyak 10 mL cuka dapur merk X diambil menggunakan
pipet volume kemudian diencerkan hingga volume tepat 100 mL menggunakan
labu ukur. Dari larutan yang telah diencerkan tersebut diambil 10 mL sampel
dan dimasukkan ke dalam erlenmeyer, diberi 3 tetes indikator fenolftalein,
kemudian dititrasi dengan mengunakan larutan standar yang tersedia. Titrasi
dilakukan sebanyak 3 kali. Gambar di bawah ini menunjukkan bagian buret 50
mL yang berisi larutan standar tersebut.
Percobaan 1 Percobaan 2 Percobaan 3
Jika massa jenis cuka dapur merk X adalah 1 kg/L, kadar asam asetat dalam
larutan cuka dapur tersebut adalah ....% (Mr CH3COOH = 60)
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 15
Latihan Yuk!
A. Pilihlah salah satu jawaban yang
tepat ! 5. Data percobaan penentuan pH suatu
limbah sebagai berikut.
1. Reaksi ionisasi yang tepat dari senyawa
asam/basa berikut dalam air menurut
teori Arrhenius adalah ... .
A. H2SO4(aq) → H+(aq) + SO4-(aq)
B. H3PO4(aq) → H3+(aq) + PO43-(aq)
Nilai pH dari limbah yang diuji adalah ... .
C. H2C2O4(aq) → 2H+(aq) + C2O42-(aq)
A. pH < 3,1 D. 3,1 < pH < 4,0
D. Ba(OH)2(aq) → Ba2+(aq) + OH2-(aq) B. 4,4 < pH < 6,2 E. pH > 10
E. NaOH(aq) → Na2+(aq) + OH2-(aq) C. 7,6 < pH < 8,3
2. Perhatikan reaksi berikut. 6. Enggo sedang membersihkan kaca
H2PO4-(aq) + H2O(l) ⇄ H3PO4(aq) + OH-(aq) jendela di rumahnya. Ia melihat
Pasangan asam basa konjugasi menurut komposisi larutan pembersih kaca yang
Bronsted-Lowry adalah ... . digunakan, salah satunya mengandung
- - -
A. H2PO4 dan H2O D. H2PO4 dan OH NH4OH, tetapi tulisan konsentrasi
-
B. H3PO4 dan H2PO4 E. H3PO4 dan H2O NH4OH pada label sudah tidak terlihat
C. H3PO4 dan OH- dengan jelas. Kemudian Enggo mencari
data dalam buku kimia tentang larutan
3. Perhatikan persamaan reaksi asam – NH4OH. Akhirnya Enggo mengetahui
basa dalam pelarut air berikut ini ! bahwa NH4OH merupakan basa lemah
H2CO3(aq) + H2O(l) HCO3-(aq) + H3O+(aq) dengan Kb sebesar 1 x 10-5. Untuk lebih
CO3 (aq) + H2O(l) HCO3 (aq) + OH (aq)
2- - -
meyakinkan dirinya, maka Enggo
Pernyataan yang benar mengenai kedua mengecek pHnya dengan kertas
reaksi di atas adalah .... indikator universal dan diperoleh data
A. HCO3- berlaku sebagai asam pada pH = 11. Berdasarkan data yang
reaksi I dan basa pada reaksi II diperoleh, Enggo dapat menghitung
B. HCO3- berlaku sebagai basa pada bahwa konsentrasi larutan NH4OH
reaksi I dan juga pada reaksi II sebesar ….
C. HCO3- berlaku sebagai asam pada A. 10 D. 0,01
reaksi I juga pada reaksi II B. 1 E. 0,001
D. HCO3- berlaku sebagai basa pada C. 0,1
reaksi I dan asam pada reaksi II
E. HCO3- tidak bisa bertindak sebagai 7. Sebanyak 37 gram padatan Ca(OH)2
asam menurut Bronsted Lowry dilarutkan dalam 2,5 liter air. pH
larutan yang terbentuk adalah ... (Ar Ca
4. Perhatikan tabel Ka dari beberapa = 40, O = 16, H = 1)
asam : A. 1 – log 2 D. 13
B. 1 E. 13 + log 4
C. 1 + log 2
Berdasarkan tabel di atas dapat ditarik
kesimpulan bahwa asam yang paling 8. pH 100 mL larutan H2CO3 0,1 M adalah ...
lemah adalah …. (Ka H2CO3 = 4 x 10-7)
A. HK A. 4 – log 2 D. 10 + log 2
B. HL B. 3,5 – log 2 E. 12 + log 4
C. HM C. 2 – log 2
D. HN
E. HP
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 16
9. Suatu obat baru yang diperoleh dari biji 14. 100 mL HBr 0,5 M bereaksi dengan 100
tanaman ternyata berupa asam organik mL KOH 0,3 M. pH larutan yang
yang lemah. Bila konsentrasi obat terbentuk adalah ... .
tersebut sebesar 0,16 M ternyata pH nya A. 2 – log 1,5 D. 1 – log 3
adalah 4 – log 4. Maka besarnya Ka dari B. 1 – log 1,5 E. 1
obat yang diuji tersebut adalah …. C. 1,5
A. 10-6
B. 10-5 15.Larutan NaOH 20 mL dititrasi dengan 40
C. 10 -4 mL HCl 0,2 M menggunakan indikator
D. 10-3 fenolftalein. Konsentrasi NaOH tersebut
E. 10-2 adalah ... .
A. 0,8 M D. 0,1 M
B. 0,4 M E. 0,04 M
10. Perhatikan gambar dua larutan berikut!
C. 0,2 M
16. Reaksi ionisasi yang tepat dari asam
nitrat dalam air menurut teori Arrhenius
adalah ... .
A. H2SO3(aq) → 2H+(aq) + SO42-(aq)
Pernyataan yang tepat mengenai kedua B. HNO3(aq) → H+(aq) + NO3-(aq)
larutan tersebut adalah …. C. H2C2O4(aq) → 2H+(aq) + C2O42-(aq)
A. Kedua larutan sama-sama memiliki D. Ba(OH)2(aq) → Ba2+(aq) + 2OH-(aq)
pH = 3 E. NaOH(aq) → Na+(aq) + OH-(aq)
B. Kedua larutan adalah basa lemah
C. Kedua larutan memiliki harga [OH-] 17. Perhatikan reaksi berikut.
yang sama HNO3(aq) + H2O(l) ⇄ H3O+(aq) + NO3-(aq)
D. Kedua larutan dapat mengubah Pasangan asam basa konjugasi menurut
warna lakmus biru Bronsted-Lowry adalah ... .
E. Kedua larutan dapat terionisasi A. HNO3 dan H2O D. HNO3 dan NO3-
sempurna B. HNO3 dan H3O+ E. H3O+ dan NO3-
C. H2O dan NO3-
11. Larutan HClO4 0,3 M sebanyak 200 mL 18. Berdasarkan pengujian sampel air limbah
dapat dinetralkan oleh 150 mL larutan diperoleh data sebagai berikut.
Ba(OH)2. Konsentrasi larutan Ba(OH)2
tersebut adalah ... .
A. 0,1 M C. 0,3 M E. 0,5 M
B. 0,2 M D. 0,4 M Harga pH sampel air limbah tersebut
adalah ... .
A. 6,0 ≤ pH ≤ 7,6
12. 100 mL larutan HCl 0,2 M dicampur B. 4,0 ≤ pH ≤ 6,0
dengan 100 mL larutan HI 0,6 M. pH C. 6,2 ≤ pH ≤ 7,6
campuran larutan asam tersebut adalah D. 8,3 ≤ pH ≤ 10
... . E. pH ≤ 8,3
A. 1 – log 4 C. 1 – log 2 E. 2 – log 4
B. 1 – log 8 D. 2 – log 2 19. pH dari 100 mL larutan Ca(OH)2 0,05 M
adalah ... .
13. Campuran asam dan basa berikut ini A. 14 C. 12 E. 1
yang dapat membirukan lakmus merah B. 13 D. 2
adalah..
20. pH dari 200 mL larutan asam sulfit
A. 50 mL HCl 0,1 M + 50 mL NaOH 0,1 M (H2SO3) 2 M adalah ...
B. 100 mL HNO3 0,2 M + 50 mL KOH 0,4 M (Ka H2SO3 = 2 x 10-2)
C. 600 mL HCl 0,1 M + 200 mL Ca(OH)2 0,1 M A. 13 + log 2 D. 2 – log 4
D. 30 mL H2SO4 1 M + 40 mL KOH 2 M
B. 11 + log 2 E. 1 – log 2
E. 300 mL H2SO4 0,1 M + 100 mL Ba(OH)2 0,2 M
C. 10 + log 2
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 17
21. 100 mL larutan H2SO4 2 M dapat B.
dinetralkan oleh 100 mL larutan KOH.
Konsentrasi larutan KOH yang
dibutuhkan adalah ... .
A. 1 M C. 3 M E. 5 M
B. 2 M D. 4 M
22. Sebanyak 80 mL larutan HBr 0,1 M
dicampur dengan 20 mL larutan HCl 0,6
M. pH campuran larutan asam tersebut
adalah ... . 25 mL NaOH
A. 1 – log 2 D. 13 + log 2
B. 1 – log 4 E. 12 + log 1
C. 2 – log 1 C.
23. 200 mL HNO3 0,04 M bereaksi dengan
200 mL NaOH 0,02 M. pH larutan yang
terbentuk adalah ... .
A. 13 C. 11 E. 2
B. 12 D. 3
24. Berikut data hasil titrasi larutan NaOH
dengan larutan HCl 2 M.
Volume Volume 25 mL NaOH
Percobaan NaOH yang HCl yang
dititrasi digunakan D.
1 40 mL 19 mL
2 40 mL 21 mL
3 40 mL 20 mL
Berdasarkan data tersebut, konsentrasi
larutan NaOH adalah ... .
A. 0,5 M D. 2 M
B. 1 M E. 4 M
C. 1,5 M
25 mL NaOH
25. Rafi melakukan titrasi 25 mL larutan
CH3COOH dengan larutan NaOH 0,1 M E.
dan membutuhkan NaOH sebanyak 25
mL. Perubahan volume larutan NaOH
yang ditambahkan menyebabkan
perubahan pH. Grafik yang menunjukkan
titrasi larutan asam dengan basa
tersebut adalah ... .
A.
25 mL NaOH
25 mL NaOH
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 18
SOAL SUPER!
Sifat Asam Basa dalam Buah dan Sayur
Pandemi COVID-19 menyebabkan banyak perubahan dalam
kehidupan sehari-hari. Menjaga pola makan yang sehat sangat penting
selama pandemic COVID-19. Sistem daya tahan tubuh harus tetap dijaga
agar kita bias terhindar dari penyakit. Ada beberapa cara untuk
mengingkatkan daya tahan tubuh, salah satunya adalah makan makanan
bergizi seimbang. Kecukupan gizi terutama vitamin dan mineral sangat
diperlukan dalam mempertahankan sistem kekebalan tubuh yang
optimal,sayuran dan buah-buahan merupakan sumber terbaik berbagai
vitamin, mineral, dan serat.
Sayuran berwarna hijau adalah sumber karoten yang baik untuk
antioksidan. Semakin hijau warna sayur maka semakin banyak
mengandung karoten, vitamin C, asam folat dan mineral. Contohnya daun
singkong, sawi hijau, bayam hijau, buncis, kangkung, kacang panjang, dll.
Sedangkan sayuran berwarna merah seperti bayam merah dan lobak merah
megandung banyak vitamin A dan vitamin E. Dalam buah-buahan juga
terdapat banyak vitamin. Buah berwarna merah mengandung banyak
vitamin C dan zat flavanoid. Contohnya semangka, apel, tomat, strawberry,
anggur merah, dan lain-lain. Vitamin C juga dikenal sebagai asam
askorbat. Asam askorbat merupakan suatu asam lemah dengan rumus
kimia C6H8O6.
Jeruk nipis yang sering kita konsumsi juga bersifat asam. Di dalam
jeruk nipis terdapat asam sitrai dengan rumus kimia C6H8O7. Selain untuk
penambah cita rasa pada makanan, ternyata jeruk nipis dapat
memutihkan gigi. Asam yang terkandung dalam jeruk nipis dapat
membantu membersihkan (menetralkan) plak yang bersifat basa dan
menempel pada lapisan gigi, sehingga gigi menjadi putih. Jeruk nipis
bersifat herbal dan tidak mengandung bahan kimia tambahan yang
berbahaya, sehingga dapat digunakan dalam jangka waktu yang panjang
dengan tidak menimbulkan efek samping.
Selain sifat asam, ada beberapa zat yang memiliki sifat basa. Cara
mengetahui sifat asam dan basa dalam suatu zat adalah dengan
menggunakan indikator. ndikator asam basa adalah senyawa khusus yang
ditambahkan pada larutan dengan tujuan menunjukkan sifat keasaman
larutan tersebut. Indikator asam basa biasanya adalah asam atau basa
organik lemah. Sebuah indikator asam basa dapat menunjukkan
perbedaan warna jika dimasukkan ke dalam zat yang bersifat asam dan zat
yang bersifat basa.
Macam-macam indikator yang paling banyak digunakan antara lain
kertas lakmus, indikator alami, larutan indikator dan pH meter. Kertas
lakmus terdiri dari dua jenis, yaitu lakmus merah dan lakmus biru. Dalam
larutan asam, lakmus merah tetap merah dan lakmus biru menjadi merah.
Pada larutan basa, lakmus merah menjadi biru dan lakmus biru tetap biru.
Sedangkan pada larutan yang bersifat netral, lakmus merah tetap merah
dan lakmus biru tetap biru.
Dalam percobaan, diuji beberapa larutan, yaitu jus tomat, air
mineral, dan air kapur. Hasil percobaan ditunjukkan pada gambar berikut.
Selain mengetahui sifat asam basa suatu zat, juga sering diuji pH
suatu larutan. pH adalah sebuah ukuran seberapa asam atau basa suatu
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 19
zat dengan nilai berkisar antara 0-14. Zat yang bersifat asam memiliki pH
di bawah 7, sedangkan pH di atas 7 dikatakan bersifat basa dan zat dengan
pH = 7 bersifat netral. pH suatu zat dapat diukur melalui percobaan
maupun perhitungan menggunakan rumus.
Percobaan penentuan pH larutan dapat menggunakan pH meter
dan pH stick. Sedangkan perhitungan pH secara teori menggunakan rumus
pH = - log [H+], sehingga jika suatu larutan memiliki [H+] = 10-2, maka
larutan tersebut memiliki pH = 2.
1. Berdasarkan informasi tersebut, maka dapat disimpulkan bahwa informasi
tersebut benar, karena ….
A. sifat asam dari jeruk dapat memutihkan gigi dan asam yang terkandung di
dalamnya tidak termasuk senyawa kimia
B. pH asam dari jeruk tidak terlalu tinggi, sehingga dapat memutihkan gigi
tanpa merusak email gigi jika digunakan dalam jangka waktu yang singkat
C. jeruk berasal dari tanaman, sehingga termasuk herbal yang memiliki
kelebihan tidak menimbulkan efek samping
D. sifat asam dari jeruk dapat memutihkan gigi seperti aslinya, dapat
menetralkan plak yang bersifat basa, dan membuat gigi lebih kuat
E. sifat asam dari jeruk dapat membersihkan plak pada gigi, tetapi menipiskan
lapisan email gigi, sehingga menimbulkan rasa ngilu pada gigi
2. Berdasarkan teks di atas, tentukan apakah buah/sayuran berikut mengandung
banyak senyawa C6H8O6. Beri jawaban dengan memberi tanda centang () pada
kolom yang tersedia
Banyak kandungan C6H8O6
Buah / sayuran
ya tidak
Bayam hijau
Bayam merah
Anggur merah
Lobak merah
3. Jika pH jus anggur = 4, maka [H+] jus tersebut sebesar…
4. Mengacu pada bacaan di atas, Hitunglah pH dari jus jambu yang memiliki [H+] = 10-3!
5. Perhatikan pernyataan 1 dan 2 berikut. Berdasarkan bacaan di atas, tentukan
pasangan pernyataan-1 dari pernyataan-2 yang tepat!
Pernyataan-1 Pernyataan-2
a. Air kapur bersifat .... (1) Asam
b. Air mineral bersifat .... (2) Basa
c. Jus tomat bersifat .... (3) Netral
Kimia – SMAK Kolese Santo Yusup Malang – Kelas XI – semester 1 Hal 20
Anda mungkin juga menyukai
- LAPORAN KurkuminDokumen7 halamanLAPORAN KurkuminBudi Hermanto MadjagaBelum ada peringkat
- JurnalDokumen9 halamanJurnalnafisateraBelum ada peringkat
- Pertemuan 1-2 PDFDokumen22 halamanPertemuan 1-2 PDFNanda ChaerunnisaBelum ada peringkat
- Laporan Tetap Ekstraksi Kafein Daun TehDokumen13 halamanLaporan Tetap Ekstraksi Kafein Daun TehSri BeasulaniBelum ada peringkat
- Laporan Praktikum Kimia Fisik II (6) AndrianaDokumen37 halamanLaporan Praktikum Kimia Fisik II (6) AndrianaAndrianaNurAiniBelum ada peringkat
- Ekstraksi KafeinDokumen20 halamanEkstraksi KafeinウィーヤBelum ada peringkat
- Analisis Ki KDDokumen13 halamanAnalisis Ki KDTriandini Cahya MutiaBelum ada peringkat
- KloridaDokumen42 halamanKloridaUpik NingrumBelum ada peringkat
- Asam Karboksilat LNDokumen13 halamanAsam Karboksilat LNGrace TambunanBelum ada peringkat
- Laporan 2 Pembuatan Dan Standarisasi LarutanDokumen12 halamanLaporan 2 Pembuatan Dan Standarisasi LarutanJossy Kumbara Muhammad JossyBelum ada peringkat
- Aldehid Dan KetonDokumen34 halamanAldehid Dan KetonKurnia BasoBelum ada peringkat
- Identifikasi Fenol Dan EterDokumen7 halamanIdentifikasi Fenol Dan EtersyifaBelum ada peringkat
- Bahan Ajar Polimer PDFDokumen40 halamanBahan Ajar Polimer PDFRizky Karomah100% (4)
- Oksidimetri 2Dokumen21 halamanOksidimetri 2Baiq Safika WulansariBelum ada peringkat
- IsolasiDokumen6 halamanIsolasieristya wardana0% (1)
- Laporan Aldehid KetonDokumen14 halamanLaporan Aldehid KetonAsniah DjufriBelum ada peringkat
- ALKANADokumen12 halamanALKANAIgede MichaelBelum ada peringkat
- Lapres Alkohol Fenol Alkena FixDokumen55 halamanLapres Alkohol Fenol Alkena FixAulia Hanaul IzzahBelum ada peringkat
- Identifikasi Gugus Fungsi EndangDokumen23 halamanIdentifikasi Gugus Fungsi EndangkuzaimahBelum ada peringkat
- Titrasi Asam BasaDokumen18 halamanTitrasi Asam BasaHendra IlamBelum ada peringkat
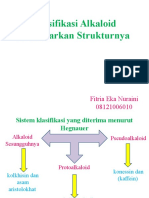
- Fitria Eka Nuraini (Alkaloid)Dokumen76 halamanFitria Eka Nuraini (Alkaloid)Fitria Eka NurainiBelum ada peringkat
- Lapres KarbohidratDokumen26 halamanLapres KarbohidratMarioBelum ada peringkat
- Kimia Fisik 6Dokumen8 halamanKimia Fisik 6KazuAiriBelum ada peringkat
- Sejarah Perkembangan Kimia OrganikDokumen2 halamanSejarah Perkembangan Kimia OrganikSri firawati012Belum ada peringkat
- Modul RedoksDokumen26 halamanModul Redoksdwiamelia_savitriBelum ada peringkat
- Aldehid Dan KetonDokumen20 halamanAldehid Dan KetonAri Rizki ChucoBelum ada peringkat
- Artikel Reaksi CannizzaroDokumen5 halamanArtikel Reaksi CannizzaroYogaPratamaBelum ada peringkat
- PEMURNIAN NaCLDokumen9 halamanPEMURNIAN NaCLresi syafiraBelum ada peringkat
- Asam KarboksilatDokumen11 halamanAsam KarboksilatFaqih naufalBelum ada peringkat
- BiomolekulDokumen31 halamanBiomolekulnur aliffahBelum ada peringkat
- 5-Laju ReaksiDokumen28 halaman5-Laju ReaksiSarif Faizal AmirBelum ada peringkat
- PENGUKURAN PHDokumen15 halamanPENGUKURAN PHAnisya Putri SentosaBelum ada peringkat
- Laporan Praktikum Laju ReaksiDokumen13 halamanLaporan Praktikum Laju Reaksi9B31ZAKIA ITSNA FATICHA DEWIBelum ada peringkat
- Laporan Praktikum Kimia OrganikDokumen10 halamanLaporan Praktikum Kimia OrganikZulitaBelum ada peringkat
- JudulDokumen35 halamanJudulAyu MilineaBelum ada peringkat
- Pemisahan Dan PemurnianDokumen19 halamanPemisahan Dan PemurnianaleeyagusBelum ada peringkat
- Praktikum 2 Alkohol Dan FenolDokumen21 halamanPraktikum 2 Alkohol Dan FenolRizkaaulyaaBelum ada peringkat
- Laporan Praktikum Pembuatan Etil AsetatDokumen15 halamanLaporan Praktikum Pembuatan Etil Asetatnicky_praditaBelum ada peringkat
- Susi Susilawati - 201030700173 - Aldehid&keton - P9Dokumen8 halamanSusi Susilawati - 201030700173 - Aldehid&keton - P9Liana AgustiaBelum ada peringkat
- Slide StoikiometriDokumen15 halamanSlide StoikiometriEkaPutraDiprajaBelum ada peringkat
- Laporan 3Dokumen11 halamanLaporan 3Putu AstiniBelum ada peringkat
- Laporan Praktikum Analisis Fisikokimia IIDokumen14 halamanLaporan Praktikum Analisis Fisikokimia IIKeshni DeviBelum ada peringkat
- Cara Kerja Kromatografi Kertas Belum FixDokumen5 halamanCara Kerja Kromatografi Kertas Belum FixminhajulqowimBelum ada peringkat
- Ikatan GlikosidikDokumen45 halamanIkatan GlikosidikHiLda HayatiiBelum ada peringkat
- PERAK (Ag)Dokumen19 halamanPERAK (Ag)Alisya FebriantiBelum ada peringkat
- ch05 - Oxidation Reduction Reactions - Copy-1Dokumen39 halamanch05 - Oxidation Reduction Reactions - Copy-1KUNMOBelum ada peringkat
- Titrasi Reduksi Dan OksidasiDokumen34 halamanTitrasi Reduksi Dan OksidasiCindy Novela100% (1)
- Uji Salting OutDokumen15 halamanUji Salting Outanon_942183317Belum ada peringkat
- TerpenoidDokumen5 halamanTerpenoidPuput CiipinkykittyBelum ada peringkat
- RPP Senyawa KarbonDokumen26 halamanRPP Senyawa KarbonFitri Ameita Sary100% (1)
- AminaDokumen12 halamanAminaTrio YudhaBelum ada peringkat
- Makalah Polarografi K7Dokumen15 halamanMakalah Polarografi K7AstianaBelum ada peringkat
- Analisis Konsep Tata Nama Senyawa Hidrokarbon (Repaired)Dokumen2 halamanAnalisis Konsep Tata Nama Senyawa Hidrokarbon (Repaired)anggrianiBelum ada peringkat
- Bahan Ajar Kimia Organik IDokumen26 halamanBahan Ajar Kimia Organik IElfi Susanti VH78% (9)
- Karbohidrat (2019)Dokumen29 halamanKarbohidrat (2019)Triana AuliasavitriBelum ada peringkat
- Proses Ekstraksi Biji Nikel Untuk Mendapatkan Kobalt (Tugas Eksmet Buk Eva)Dokumen9 halamanProses Ekstraksi Biji Nikel Untuk Mendapatkan Kobalt (Tugas Eksmet Buk Eva)Ardy RinaldiBelum ada peringkat
- Laporan Praktikum AlkoholDokumen3 halamanLaporan Praktikum AlkoholRaid Azhar MBelum ada peringkat
- Modul Asam Dan Basa3Dokumen5 halamanModul Asam Dan Basa3erlya aryaBelum ada peringkat
- Asam Dan Basa 1Dokumen11 halamanAsam Dan Basa 1Annisa AwaliyaBelum ada peringkat
- Konsep Asam BasaDokumen87 halamanKonsep Asam BasaAnggia IsnainiBelum ada peringkat