Makalah Peluara
Diunggah oleh
Fury zerotw0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
21 tayangan2 halamanOk
Judul Asli
Makalah peluara
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniOk
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
21 tayangan2 halamanMakalah Peluara
Diunggah oleh
Fury zerotwOk
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
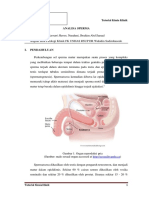
PENATALAKSANAAN SPESIMEN EFUSI PLEURA
Sumber:
Jurnal 2013 Jose M. Porcel “Handling Pleural Fluid Samples For Routine Analyses
I. Proses pengambilang Efusi Pleura dinamakan THORACENTESIS
II. Cairan diambil sekitar 20-40mL untuk analisa lengkap di laboratorium (kimia, sitologi,
mikrobiologi) untuk mengatahui jenisnya termasuk transudat atau eksudat, penegakkan
diagnose penyebab efusi, dan lanjutan terapi yang diambil
III. Jika terapi yang diambil ada drainase maka dipasang kateter interkostal ditampung di wadah
steril (Urine Bag Sterile)
IV. Cairan pada umumnya diambil dengan syringe steril dan dikirim ke laboratorium
V. Cairan harus sudah berada di laboratorium dalam kurun 2 jam setelah sampling dan dalam
kondisi suhu kamar, jika butuh waktu lebih maka pengiriman dilakukan dalam kondisi suhu 4℃
kecuali yang diperuntukkan pemeriksaan mikrobiologi harus tetap suhu ruang.
*Penyimpanan spesimen >48 jam dalam suhu 4℃ tidak akan memberi efek signifikan pada
hitung leukosit, CDC, kimia (kecuali LDH), dan sitologi
VI. Persiapan Spesimen
1. Pindahkan cairan pleura dari syringe ke tabung dengan antikoagulan EDTA atau Heparin
untuk mencegah pembekuan untuk keperluan px CDC karena berpengaruh banget ke
hitung leukosit. Hindari kontak terlalu lama dengan udara!
2. Jumlah yang dibutuhkan tiap px:
Pemeriksaan hitung sel 3-5 Ml dari tabung heparin atau EDTA
Pemeriksaan pH dengan heparinised syringe (yg biasa digunakan AGD) kalau ada,
atau ikut tabung px lain
Pemeriksaan kimia 5 mL pakai tabung Heparin atau EDTA atau non aditif
Pemeriksaan mikrobiologi
- 2-5 mL ke tabung darah kultur aerob dan anaerob masing-masing
- 1 tabung steril untuk pewarnaan Gram
- 5 mL untuk inokulasi ke media cair (lebih sensitif dr media padat) untuk diagnosa TB
3. Pemeriksaan Sitologi sekitar 20 mL tergantung besar sedimen yang diperkirakan,
makin besar maka volume makin banyak
VII. Langkah Pemeriksaan
1. Cek pH idealnya di BGA tapi lihat kondisi spesimen takutnya bikin probe tersumbat
karena komponen di dalamnya (jika ada permintaan px)
2. Lanjut Cell Counting dari eritrosit, leukosit, dan Diffcount MN dan PMN
3. Lanjut Tabung disentrifus 3000 rpm selama 15 menit suhu ruang:
Supernatan untuk periksa kimia (protein, LDH, glukosa, dan enzim Adenosine
Deaminase)
Opt. tambahan px kimia: albumin dan kolesterol (kecurigaan spesimen bukan
transudat); amilase (pankreasitis & kelainan esofagus); Trigliserida (chylothorax)
Sedimen untuk pewarnaan gram, ZN, dan diinokulasi ke media BAP, Chocolate
Agar, MacConkey, kalau ada juga ke media anaerob (ga disebut). Inkubasi media
di suhu 35°-37℃ selama minimal 4 hari atau dengan cara lain, botol kultur
diinkubasi kalau positif dikultur di media padat.
Untuk pemeriksaan Mycobacterium bisa pakai BACTEC atau MODS
(Microscopic-Observation Drug Suspectibility) yang lebih cepat daripada tanam
di Lowenstein Jensen
4. Pemeriksaan Sitologi, ketahanan sampel sampai 72 jam suhu 2-8℃,
Pemeriksaan sitologi pakai metode cytospin (disentrifus, sedimen dijadikan sediaan) dan
cell block (teknik smear). Teknik fiksasi dan pewarnaan beragam yang biasa dipakai
Cytospin fiksasi di isopropyl alkohol 95% dan diwarnai metode Papanicolaou
(ada gambar udah di share di grup)
Cell block fiksasi formalin diwarnai dengan Haematoxylin & Eosin
Anda mungkin juga menyukai
- Pengendalian Mutu LaboratoriumDokumen6 halamanPengendalian Mutu LaboratoriumYosep Prandiko71% (14)
- Teknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Dari EverandTeknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Penilaian: 5 dari 5 bintang5/5 (2)
- Mikrobiologi DiagnostikDokumen18 halamanMikrobiologi Diagnostikwidia febrinaBelum ada peringkat
- Kultur DarahDokumen3 halamanKultur DarahMirahBelum ada peringkat
- Cara Pengambilan, Penyimpanan Dan Pemeriksaan Laboratorium Mikrobiologi Klinik (Mycoplasma SP.)Dokumen3 halamanCara Pengambilan, Penyimpanan Dan Pemeriksaan Laboratorium Mikrobiologi Klinik (Mycoplasma SP.)Flonschy TamakaBelum ada peringkat
- Manajemen Laboratorium: Praktikum 5-6: Manajemen Spesimen (Pengelolaan Dan Penyimpanan)Dokumen16 halamanManajemen Laboratorium: Praktikum 5-6: Manajemen Spesimen (Pengelolaan Dan Penyimpanan)RhmaaBelum ada peringkat
- Cara Pengiriman Sampel Untuk Kebutuhan LaboratoriumDokumen6 halamanCara Pengiriman Sampel Untuk Kebutuhan LaboratoriumalmiraBelum ada peringkat
- Vitamin NNDokumen25 halamanVitamin NNisnarnursamBelum ada peringkat
- Pertumbuhan Pembiakan Dan MetabolismeDokumen14 halamanPertumbuhan Pembiakan Dan MetabolismeshafariyahBelum ada peringkat
- Penerapan Pilar Good Laboratory Practice FixDokumen16 halamanPenerapan Pilar Good Laboratory Practice FixAdian Permatta100% (1)
- Pakan Darah PT 13 BDokumen13 halamanPakan Darah PT 13 Bmeysi ismiBelum ada peringkat
- Transudat EksudatDokumen20 halamanTransudat EksudatDebby ElviraBelum ada peringkat
- Penuntun UrogeniltaliaDokumen21 halamanPenuntun UrogeniltaliaVia IbadBelum ada peringkat
- Kriteria Penolakan Spesimen UrineDokumen23 halamanKriteria Penolakan Spesimen UrineYuniati ValentinaBelum ada peringkat
- FR Analis Kesehatan 2021Dokumen3 halamanFR Analis Kesehatan 2021Yeni YulyaniBelum ada peringkat
- Laporan PPDHDokumen21 halamanLaporan PPDHIndah Suryadewi100% (1)
- Pedoman Analisa SpermatozoaDokumen27 halamanPedoman Analisa SpermatozoaGolden Flower ATLMBelum ada peringkat
- Analisis Cairan Otak FixDokumen29 halamanAnalisis Cairan Otak FixMuhammad Raihand100% (1)
- Adinda Maulidya Safira - 1910911320021 - Kel 15Dokumen17 halamanAdinda Maulidya Safira - 1910911320021 - Kel 15adindamsBelum ada peringkat
- Makalah FlebotomiDokumen9 halamanMakalah FlebotomiBendy WijayaBelum ada peringkat
- TM 8 Pengelolaan Spesimen Cairan TubuhDokumen24 halamanTM 8 Pengelolaan Spesimen Cairan TubuhMiftha Putri100% (1)
- Cara Pengiriman Sampel Untuk Kebutuhan LaboratoriumDokumen4 halamanCara Pengiriman Sampel Untuk Kebutuhan LaboratoriumAinun Mardiah100% (1)
- FR PPPKDokumen3 halamanFR PPPKuliBelum ada peringkat
- Transudat EksudatDokumen10 halamanTransudat EksudatAnggista MayangBelum ada peringkat
- Analisa Cairan PleuraDokumen39 halamanAnalisa Cairan PleuraMuhammad RaihandBelum ada peringkat
- Laporan Praktikum Hematologi - Eva KhaerunisaDokumen25 halamanLaporan Praktikum Hematologi - Eva KhaerunisaEva KhaerunisaBelum ada peringkat
- Vit Bentuk WordDokumen8 halamanVit Bentuk Worddedik nurcahyoBelum ada peringkat
- Pemeriksaan FesesDokumen14 halamanPemeriksaan Feseskukuh0% (1)
- Penatalaksanaan Spesimen Dan Pemeriksaan PenunjangDokumen42 halamanPenatalaksanaan Spesimen Dan Pemeriksaan PenunjangNi Putu Ari FebriantariBelum ada peringkat
- Analisa Dalam Matriks BiologiDokumen53 halamanAnalisa Dalam Matriks BiologiAulya NurulBelum ada peringkat
- MikroDokumen15 halamanMikroEndah Dwi sitaresmiBelum ada peringkat
- Uji Stabilitas BiologiDokumen10 halamanUji Stabilitas Biologidesi0% (1)
- Pemeriksaan AIHDokumen16 halamanPemeriksaan AIHAlfina AlfianiBelum ada peringkat
- Rev Buku Praktikum Blok 245 Digestive Disorders InstrukturDokumen111 halamanRev Buku Praktikum Blok 245 Digestive Disorders InstrukturNovaBelum ada peringkat
- Pengendalian Pra AnalitikDokumen15 halamanPengendalian Pra AnalitikAnonymous qDteDzBelum ada peringkat
- Pengelolaan LabDokumen5 halamanPengelolaan LabRsu Sis AljufriBelum ada peringkat
- Biologi Molekuler TK 2Dokumen12 halamanBiologi Molekuler TK 2Zahratul Haya jannahBelum ada peringkat
- Biomol Kelompok 15Dokumen22 halamanBiomol Kelompok 15IntandwiBelum ada peringkat
- Pemantapan Mutu LabDokumen16 halamanPemantapan Mutu LabYani SitinurbayaniBelum ada peringkat
- Bu Hapipah Idk 2Dokumen56 halamanBu Hapipah Idk 2YusrilBelum ada peringkat
- So 2Dokumen9 halamanSo 2Miftah YusufBelum ada peringkat
- Makalah Spesimen Cairan Lambung Dan Cairan Otak (Waode Yumna 15020170168)Dokumen12 halamanMakalah Spesimen Cairan Lambung Dan Cairan Otak (Waode Yumna 15020170168)Yumnakarno 31Belum ada peringkat
- Persiapan Pasien Untuk Pengambilan Specimen Pemeriksaan Mikroba 81Dokumen22 halamanPersiapan Pasien Untuk Pengambilan Specimen Pemeriksaan Mikroba 81Yusmar ZaiBelum ada peringkat
- Tes Dan Interpretasi Cairan OtakDokumen14 halamanTes Dan Interpretasi Cairan OtakKatou Jeffrey Shigehito100% (1)
- Pertemuan 4 PERSIAPAN PEMERIKSAAN PENUNJANGDokumen36 halamanPertemuan 4 PERSIAPAN PEMERIKSAAN PENUNJANGSatriyaGintaMcCoyBelum ada peringkat
- Makalah Pemeriksaan Kimia Dan Carik Celup Urin DR NurulDokumen5 halamanMakalah Pemeriksaan Kimia Dan Carik Celup Urin DR NurulFebi SuantariBelum ada peringkat
- Pra Analitik Darah Dan Non DarahDokumen51 halamanPra Analitik Darah Dan Non DarahNur iffahBelum ada peringkat
- Materi Pengelolaan SpesimenDokumen11 halamanMateri Pengelolaan SpesimenBudi AstawanBelum ada peringkat
- Bac TDokumen30 halamanBac TRastu KaryanaBelum ada peringkat
- Alifiyah Y.P. - P27834118043 - Tugas ToksikologiDokumen11 halamanAlifiyah Y.P. - P27834118043 - Tugas Toksikologialivia yunandaBelum ada peringkat
- Tilik UrinDokumen10 halamanTilik UrinNajla NabilaBelum ada peringkat
- LAB-8.1.7 EP 1-Pengendalian Mutu Pelayanan Laboratorium OkDokumen6 halamanLAB-8.1.7 EP 1-Pengendalian Mutu Pelayanan Laboratorium OkI Ketut SujanaBelum ada peringkat
- Body Fluids AnalysisDokumen35 halamanBody Fluids AnalysisLaboratorium PH DepokBelum ada peringkat
- Mikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaDari EverandMikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaPenilaian: 2.5 dari 5 bintang2.5/5 (2)
- Mikrobiologi Medis I: Patogen dan Mikrobioma ManusiaDari EverandMikrobiologi Medis I: Patogen dan Mikrobioma ManusiaPenilaian: 4 dari 5 bintang4/5 (11)