Kompleks Nikel(II) Tetraamin
Diunggah oleh
Muhammad Arham YunusJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kompleks Nikel(II) Tetraamin
Diunggah oleh
Muhammad Arham YunusHak Cipta:
Format Tersedia
MUH. ARHAM YUNUS No.
Urut 43
Dari buku : Dalam kation kompleks tetraamin nikel (II) dijumpai ada 2 elektron yang tidak berpasangan dalam orbital 3d, karena itu senyawa kompleks ini bersifat paramagnetic. Ion kompleks ini mempunyai suatu struktur tetrahedral, dimana ke empat molekul amoniak berada di empat sudut tetrahedral.
Sumber lain : Sifat kemagnetan Diamagnetik (jika semua elektron berpasangan) : ditolak (amat lemah) oleh medan magnet Paramagnetik (jika ada elektron yang tak berpasangan) : ditarik oleh medan magnet Feromagnetik (pada Fe, Co, Ni): ditarik (sangat kuat) oleh medan magnet. Secara kuantitatif ditunjukkan oleh momen magnetik () : = [n(n+2)] BM dengan n = jumlah elektron tak berpasangan BM= Bohr Magneton (satuan untuk momenmagnetik)
Ikatan antara ion pusat dengan ligan merupakan ikatan koordinasi Struktur kompleks ditentukan oleh hibridisasi yang terjadi pada ion pusatnya. linier
sp
sp2 trigonal planar sp3 tetrahedral sp3d bipiramida segitiga
sp3d2 oktahedral dsp2 bujur sangkar (www. Chem.-is-try.org)
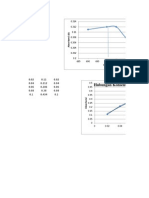
Magnetisasi, M, (momen magnet per satuan volume) suatu sampel dalam medan magnet, H, berbanding lurus dengan besarnya H, dan tetapan perbandingannya adalah, , yang bergantung pada sampel. M = H disebut dengan suseptibilitas volume dan hasil kali dan volume molar sampel Vm disebut dengan susceptibilitas molar m. Dinyatakan dalam persamaan menjadi: m = .Vm Semua zat memiliki sifat diamagnetik, dan selain diamagnetisme, zat dengan elektron tidak berpasangan juga menunjukkan sifat paramagnetisme, besar sifat paramagnetisme sekitar 100 kali lebih besar daripada sifat diamagnetisme. Hukum Curie menunjukkan bahwa paramagnetisme berbanding terbalik dengan suhu: T A C m = + T adalah temperatur mutlak dan A dan C adalah konstanta. Dalam metoda Gouy atau Faraday, momen magnet dihitung dari perubahan berat sampel bila digantungkan dalam pengaruh medan magnet. Selain metoda ini, metoda yang lebih sensitif adalah SQUID (superconducting quantum interference device) yang telah banyak digunakan untuk melakukan pengukuran sifat magnet. Paramagnetisme diinduksi oleh momen magnet permanen elektron tak berpasangan dalam molekul dan suseptibilitas molarnya berbanding lurus dengan momentum sudut spin elektron. Paramagnetisme kompleks logam transisi blok d yang memiliki elektron tak berpasangan dengan bilangan kuantum spin 1/2, dan setengah jumlah elektron tak berpasangan adalah bilangan kuantum spin total S. Oleh karena itu, momen magnet hanya berdasarkan spin secara teori dapat diturunkan mengikuti persamaan: = 2 S(S + 1) = n(n + 2)B = 9.274 x 10-24 JT-1 adalah Bohr magneton. Banyak kompleks logam 3d menunjukkan kecocokan yang baik antara momen magnet yang diukur dengan neraca magnetik dan yang dihasilkan dari persamaan di atas. dari hasil pengukuran magnetiknya. sekitar 1.7 B adalah kompleks spin rendah dengan satu elektron tak berpasangan, tetapi Fe3+ d5 dengan momen magnet sekitar 5.9 B adalah kompleks spin tinggi dengan 5 elektron tak berpasangan. (bab-6-kimia-logam transisi-pdf)
Anda mungkin juga menyukai
- Diamagnetisme LandauDokumen12 halamanDiamagnetisme LandauSiLvi KotokalahBelum ada peringkat
- Sifat Magnetik Zat PadatDokumen13 halamanSifat Magnetik Zat PadatAninditya riskiBelum ada peringkat
- Ferromagnetik, Paramagnetik, DiamagnetikDokumen20 halamanFerromagnetik, Paramagnetik, DiamagnetikFitri CahyaniBelum ada peringkat
- Bab X Sifat Kemagnetan BahanDokumen6 halamanBab X Sifat Kemagnetan BahanGek SukmaBelum ada peringkat
- Bella Nelyndasari (16-63)Dokumen6 halamanBella Nelyndasari (16-63)Andre KurniawanBelum ada peringkat
- Sifat MagnetikDokumen8 halamanSifat MagnetikNovanto Eka WahyuBelum ada peringkat
- Tugas Resum Magnetisme Dalam MateriDokumen4 halamanTugas Resum Magnetisme Dalam MateriabdauBelum ada peringkat
- ZAT PADATDokumen24 halamanZAT PADATMasyitah Fitrida100% (1)
- SIFATKEMAGNETANDokumen8 halamanSIFATKEMAGNETANAyhat KhairanBelum ada peringkat
- Makalah Sifat Magnet Zat Padat - Yolanda Wulandari (19036046)Dokumen13 halamanMakalah Sifat Magnet Zat Padat - Yolanda Wulandari (19036046)Yolanda WulandariBelum ada peringkat
- Sifat Zat PadatDokumen10 halamanSifat Zat PadatAlfa Dina PrianotoBelum ada peringkat
- Laporan Suscepsibilitas Dan PermaebilitasDokumen20 halamanLaporan Suscepsibilitas Dan PermaebilitasFaried LatiefBelum ada peringkat
- Laporan Akhir M3Dokumen19 halamanLaporan Akhir M3Vika MarcelinaBelum ada peringkat
- Materi Sifat Kemagnetan KristalDokumen6 halamanMateri Sifat Kemagnetan Kristalindah sriwhyuniBelum ada peringkat
- MAGNETDokumen14 halamanMAGNETBenelux ModeBelum ada peringkat
- Menentukan Suseptibilitas Dan Permeabilitas Berbagai BahanDokumen18 halamanMenentukan Suseptibilitas Dan Permeabilitas Berbagai BahanMaria OktavianiBelum ada peringkat
- Rizaldi Haga Maulana - M0319067 - PERCOBAAN 5 ANOR PDFDokumen18 halamanRizaldi Haga Maulana - M0319067 - PERCOBAAN 5 ANOR PDFRizaldi Haga MaulanaBelum ada peringkat
- Sifat Magnetik MaterialDokumen23 halamanSifat Magnetik MaterialRahayu NovitasariBelum ada peringkat
- FEROMAGNETIK MINERALDokumen17 halamanFEROMAGNETIK MINERALLydia Liestiana KarlimanBelum ada peringkat
- Persamaan MagnetikDokumen8 halamanPersamaan MagnetikCerel Ca FitriaBelum ada peringkat
- DiamagnetikDokumen40 halamanDiamagnetikTuti AlawiyahBelum ada peringkat
- MagnetismDokumen26 halamanMagnetismdsw27100% (1)
- MAGNETDokumen16 halamanMAGNETDhita Rurin AdistyaningsihBelum ada peringkat
- FEROMAGNETIKDokumen32 halamanFEROMAGNETIKgita100% (3)
- Translet BukuDokumen11 halamanTranslet BukuDinda PratiwiBelum ada peringkat
- Medan Magnet Dan Induksi ElektromagnetikDokumen40 halamanMedan Magnet Dan Induksi ElektromagnetikZulfikar Pikar SBelum ada peringkat
- MAGNET DAN DIELEKTRIKDokumen12 halamanMAGNET DAN DIELEKTRIKJackSchmeichelBelum ada peringkat
- Bahan DiamagetikDokumen4 halamanBahan DiamagetikAnjar WidaningrumBelum ada peringkat
- Sifat Kemagnetan BahanDokumen19 halamanSifat Kemagnetan BahanIllavi Pebrian Praseti100% (2)
- Sifat Bahan MagnetikDokumen16 halamanSifat Bahan MagnetikNanda Rizky KumaraBelum ada peringkat
- SIFAT BAHAN MAGNETIKDokumen17 halamanSIFAT BAHAN MAGNETIKsudarumaBelum ada peringkat
- Bab IiDokumen22 halamanBab IiEtty HerfiyanaBelum ada peringkat
- Sifat Kemagnetan BahanDokumen22 halamanSifat Kemagnetan BahanIllavi Pebrian PrasetiBelum ada peringkat
- MATERIAL MAGNETIKDokumen23 halamanMATERIAL MAGNETIKBenelux ModeBelum ada peringkat
- Medan Ligan Teori Orbital Molekul Nuris BambangDokumen35 halamanMedan Ligan Teori Orbital Molekul Nuris BambangAtiq RosyidiiBelum ada peringkat
- Bahan MagnetikDokumen22 halamanBahan MagnetikNurhabibah PurbaBelum ada peringkat
- OPTIMASIDokumen9 halamanOPTIMASIListiana CahyantariBelum ada peringkat
- Kimia Unsur Transisi PDFDokumen34 halamanKimia Unsur Transisi PDFFans decky metbokiBelum ada peringkat
- Tugas 1 - Fisika Magnetik - BALEANA INTAN P - 210322607213Dokumen3 halamanTugas 1 - Fisika Magnetik - BALEANA INTAN P - 210322607213BALEANA INTANBelum ada peringkat
- MATRIAL PARAMAGNETIKKLOMPOK 14Dokumen17 halamanMATRIAL PARAMAGNETIKKLOMPOK 14Syahdinda Restu PutraBelum ada peringkat
- Sifat Kemagnetan BahanDokumen22 halamanSifat Kemagnetan BahanIllavi Pebrian PrasetiBelum ada peringkat
- FEROMAGNETIKDokumen17 halamanFEROMAGNETIKLintang Ayu100% (1)
- Tugas 1.Dokumen19 halamanTugas 1.MiftahulhusnahBelum ada peringkat
- ZAT PADATDokumen25 halamanZAT PADATCho Tina Yamazaki ElfBelum ada peringkat
- SISTEM TERMODINAMIKADokumen5 halamanSISTEM TERMODINAMIKADzurriyyah SyakurBelum ada peringkat
- SIFATKEMAGNETANDokumen21 halamanSIFATKEMAGNETANNanda NovitaBelum ada peringkat
- Bahan Magnetik: PendahuluanDokumen24 halamanBahan Magnetik: PendahuluanAzwar AzBelum ada peringkat
- Rangkuman IPA Kelas 9Dokumen7 halamanRangkuman IPA Kelas 9mozet mcBelum ada peringkat
- Efek Zeeman K-2Dokumen26 halamanEfek Zeeman K-2Maria Elvina TrividaBelum ada peringkat
- Magnetisasi Dalam MateriDokumen18 halamanMagnetisasi Dalam MateriThe FootstepsBelum ada peringkat
- ANTFERROMAGNETISMEDokumen6 halamanANTFERROMAGNETISMEanamariana04Belum ada peringkat
- Perilaku Material MagnetikDokumen5 halamanPerilaku Material MagnetikwindaBelum ada peringkat
- Resonansi Magnetik Inti Spektrometer NMRDokumen6 halamanResonansi Magnetik Inti Spektrometer NMRMelyana MeliBelum ada peringkat
- AnorganikDokumen9 halamanAnorganikWidyaBelum ada peringkat
- TEORI MEDAN KRISTALDokumen33 halamanTEORI MEDAN KRISTALKB20044Ashabul KahfiBelum ada peringkat
- NMRDokumen50 halamanNMRrheeyfiiBelum ada peringkat
- Translate Nya BukuDokumen1 halamanTranslate Nya BukuMuhammad Arham YunusBelum ada peringkat
- 6035c 9. KHOLID JadiDokumen8 halaman6035c 9. KHOLID JadiMuhammad Arham YunusBelum ada peringkat
- Pengantar EsterDokumen2 halamanPengantar EsterMuhammad Arham YunusBelum ada peringkat
- Artikel Dipa Olly Norita 2009Dokumen15 halamanArtikel Dipa Olly Norita 2009Tiska BeatriceBelum ada peringkat
- Bab IIDokumen16 halamanBab IIMuhammad Arham YunusBelum ada peringkat
- Secara FisisDokumen1 halamanSecara FisisMuhammad Arham YunusBelum ada peringkat
- Kembar TugasDokumen2 halamanKembar TugasMuhammad Arham YunusBelum ada peringkat
- Forensik BaruDokumen3 halamanForensik BaruMuhammad Arham YunusBelum ada peringkat
- TETANGGADokumen2 halamanTETANGGAMuhammad Arham Yunus100% (1)
- Translate Nya BukuDokumen1 halamanTranslate Nya BukuMuhammad Arham YunusBelum ada peringkat
- Secara FisisDokumen1 halamanSecara FisisMuhammad Arham YunusBelum ada peringkat
- TETANGGADokumen2 halamanTETANGGAMuhammad Arham Yunus100% (1)
- Kompleks Nikel(II) TetraaminDokumen2 halamanKompleks Nikel(II) TetraaminMuhammad Arham YunusBelum ada peringkat
- Book 1Dokumen2 halamanBook 1Muhammad Arham YunusBelum ada peringkat
- KimiaDokumen1 halamanKimiaMuhammad Arham YunusBelum ada peringkat
- KimiaDokumen2 halamanKimiaMuhammad Arham YunusBelum ada peringkat
- KarbohidratDokumen3 halamanKarbohidratMuhammad Arham YunusBelum ada peringkat
- Tugas 2 KF IiDokumen1 halamanTugas 2 KF Iirukman musliminBelum ada peringkat
- Tugas Kimia FisikaDokumen1 halamanTugas Kimia FisikaMuhammad Arham YunusBelum ada peringkat
- Tugas Kimia FisikaDokumen1 halamanTugas Kimia FisikaMuhammad Arham YunusBelum ada peringkat