0% menganggap dokumen ini bermanfaat (0 suara)
267 tayangan15 halamanPertemuan 1
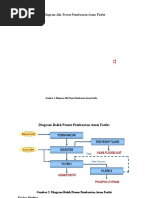
Proses pembuatan asam fosfat dari batuan fosfat dan asam sulfat melibatkan reaksi batuan fosfat dengan asam sulfat yang menghasilkan asam fosfat, gypsum, dan gas-gas lainnya. Batuan fosfat direaksikan dengan asam sulfat dalam ball mill dan tangki reaksi untuk menghasilkan filtrat yang mengandung asam fosfat. Filtrat kemudian difilter dan diuapkan untuk menghasilkan asam fosfat konsentrasi tinggi.
Diunggah oleh
Naufal ZharfanHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd
0% menganggap dokumen ini bermanfaat (0 suara)
267 tayangan15 halamanPertemuan 1
Proses pembuatan asam fosfat dari batuan fosfat dan asam sulfat melibatkan reaksi batuan fosfat dengan asam sulfat yang menghasilkan asam fosfat, gypsum, dan gas-gas lainnya. Batuan fosfat direaksikan dengan asam sulfat dalam ball mill dan tangki reaksi untuk menghasilkan filtrat yang mengandung asam fosfat. Filtrat kemudian difilter dan diuapkan untuk menghasilkan asam fosfat konsentrasi tinggi.
Diunggah oleh
Naufal ZharfanHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd