Rumus Kimia
Diunggah oleh
AKATIRTA_MAGELANG0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
15 tayangan3 halamanstokometri
Judul Asli
kimia dasar
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inistokometri
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
15 tayangan3 halamanRumus Kimia
Diunggah oleh
AKATIRTA_MAGELANGstokometri
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 3
Oct 2, '07 6:31 AM
STOKIOMETRI KIMIA untuk semuanya
Stokiometri atau Hitungan kimia adalah cara-
cara perhitungan yang berorientasi pada hukum-hukum dasar ilmu
kimia. Perlu disadari bersama bahwa ukuran materi yang dipelajari
dalam kimia begitu sangat kecilnya, sehingga ada satuan khusus
untuk menunjukkan jumlah maupun konsentrasi suatu zat.
Disamping itu suatu unsur memiliki masa atom relatif (Ar) yang
khas begitupula massa molekul relatif (Mr) suatu senyawa dan
semua ini terkait dengan konsep mol.
Jelas bahwa ada kemampuan dasar yang harus dikuasai dalam
mempelajari stokiometri yaitu konsep mol dan hukum dasar ilmu
kimia. Dalam hal ini akan diberikan bermacam-macam contoh soal
hitungan kimia beserta pembahasanya.
Contoh-contoh soal :
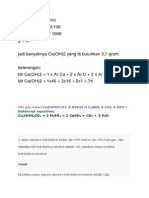
1. Berapa persen kadar kalsium (Ca) dalam kalsium karbonat ?
(Ar: C = 12 ; O= 16 ; Ca=40)
Jawab :
1 mol CaCO, mengandung 1 mol Ca + 1 mol C + 3 mol O
Mr CaCO3 = 40 + 12 + 48 = 100
Jadi kadar kalsium dalam CaCO3 = 40/100 x 100% = 40%
2. Sebanyak 5.4 gram logam alumunium (Ar = 27) direaksikan
dengan asam klorida encer berlebih sesuai reaksi :
2 Al (s) + 6 HCl (aq) 2 AlCl3 (aq) + 3 H2 (g)
Berapa gram aluminium klorida dan berapa liter gas hidrogen
yang dihasilkan pada kondisi standar ?
Jawab:
Dari persamaan reaksi dapat dinyatakan
2 mol Al x 2 mol AlCl3 3 mol H2
5.4 gram Al = 5.4/27 = 0.2 mol
Jadi:
AlCl3 yang terbentuk = 0.2 x Mr AlCl3 = 0.2 x 133.5 = 26.7
gram
Volume gas H2 yang dihasilkan (0o C, 1 atm) = 3/2 x 0.2 x 22.4
= 6.72 liter
3. Suatu bijih besi mengandung 80% Fe2O3 (Ar: Fe=56; O=16).
Oksida ini direduksi dengan gas CO sehingga dihasilkan besi.
Berapa ton bijih besi diperlukan untuk membuat 224 ton besi ?
Jawab:
1 mol Fe2O3 mengandung 2 mol Fe
maka : massa Fe2O3 = ( Mr Fe2O3/2 Ar Fe ) x massa Fe =
(160/112) x 224 = 320 ton
Jadi bijih besi yang diperlukan = (100 / 80) x 320 ton = 400 ton
4. Untuk menentukan air kristal tembaga sulfat 24.95 gram garam
tersebut dipanaskan sampai semua air kristalnya menguap.
Setelah pemanasan massa garam tersebut menjadi 15.95 gram.
Berapa banyak air kristal yang terkandung dalam garam
tersebut ?
Jawab :
misalkan rumus garamnya adalah CuSO4 . xH2O
CuSO4 . xH2O CuSO4 + xH2O
24.95 gram CuSO4 . xH2O = 159.5 + 18x mol
15.95 gram CuSO4 = 159.5 mol = 0.1 mol
menurut persamaan reaksi di atas dapat dinyatakan bahwa:
banyaknya mol CuS04 . xH2O = mol CuSO4; sehingga
persamaannya
24.95/ (159.5 + 18x) = 0.1 x = 5
Jadi rumus garamnya adalah CuS04 . 5H2O
Rumus Empiris dan Rumus Molekul
Rumus empiris adalah rumus yang paling sederhana dari suatu
senyawa.
Rumus ini hanya menyatakan perbandingan jumlah atom-atom
yang terdapat dalam molekul.
Rumus empiris suatu senyawa dapat ditentukan apabila diketahui
salah satu:
- massa dan Ar masing-masing unsurnya
- % massa dan Ar masing-masing unsurnya
- perbandingan massa dan Ar masing-masing unsurnya
Rumus molekul: bila rumus empirisnya sudah diketahui dan Mr juga
diketahui maka rumus molekulnya dapat ditentukan.
Contoh: Suatu senyawa C den H mengandung 6 gram C dan 1
gram H.
Tentukanlah rumus empiris dan rumus molekul
senyawa tersebut bila diketahui Mr nya = 28 !
Jawab: mol C : mol H = 6/12 : 1/1 = 1/2 : 1 = 1 : 2
Jadi rumus empirisnya: (CH2)n
Bila Mr senyawa tersebut = 28 maka: 12n + 2n =
28 14n = 28 n = 2
Jadi rumus molekulnya : (CH2)2 = C2H4
Contoh: Untuk mengoksidasi 20 ml suatu hidrokarbon (CxHy)
dalam keadaan gas diperlukan oksigen sebanyak 100
ml dan dihasilkan CO2 sebanyak 60 ml. Tentukan
rumus molekul hidrokarbon tersebut !
Jawab: Persamaan reaksi pembakaran hidrokarbon secara
umum
CxHy (g) + (x + 1/4 y) O2 (g) x CO2 (g) + 1/2 y
H2O (l)
Koefisien reaksi menunjukkan perbandingan mol zat-
zat yang terlibat dalam reaksi.
Menurut Gay Lussac gas-gas pada p, t yang sama,
jumlah mol berbanding lurus dengan volumenya
Maka:
mol CxHy : mol O2 : mol CO2 = 1 : (x + 1/4y) : x
20 : 100 : 60 = 1 : (x + 1/4y) : x
1 :5 :3 = 1 : (x + 1/4y) : x
atau:
1 : 3 = 1 : x x = 3
1 : 5 = 1 : (x + 1/4y) y = 8
Jadi rumus hidrokarbon tersebut adalah : C3H8
Anda mungkin juga menyukai
- SURVEI DAN PEMETAANDokumen180 halamanSURVEI DAN PEMETAANRizky Riz100% (1)
- STOKIOMETRIDokumen2 halamanSTOKIOMETRICitra CicitcuitBelum ada peringkat
- 2 - Hitungan KimiaDokumen14 halaman2 - Hitungan KimiaKustomo AlzilazafiBelum ada peringkat
- Contoh Perhitungan KimiaDokumen5 halamanContoh Perhitungan KimiaRidwan Bin SunusiBelum ada peringkat
- STOIKIOMETRIDokumen23 halamanSTOIKIOMETRIqolipBelum ada peringkat
- StoikiometriDokumen24 halamanStoikiometriMila SyafitriBelum ada peringkat
- JUDULDokumen6 halamanJUDULelisofiatiBelum ada peringkat
- STOIKIOMETRI KIMIADokumen19 halamanSTOIKIOMETRI KIMIASyahrir MuhsalBelum ada peringkat
- HUKUM DASAR KIMIADokumen9 halamanHUKUM DASAR KIMIAIP ManBelum ada peringkat
- STOIKIOMETRI KIMIADokumen28 halamanSTOIKIOMETRI KIMIAFaridul FuadiBelum ada peringkat
- Bab I StoikiometriDokumen35 halamanBab I StoikiometriMuhammad Afnan MBelum ada peringkat
- Soal StoikiometriDokumen68 halamanSoal StoikiometriSahril SangajiBelum ada peringkat
- Lecture - Note - Sesi-13 - STOIKIOMETRIDokumen23 halamanLecture - Note - Sesi-13 - STOIKIOMETRIberkasmengajardanangBelum ada peringkat
- STOIKIOMETRIDokumen52 halamanSTOIKIOMETRIFriedrich Rabin SitumorangBelum ada peringkat
- Kimia DasarDokumen32 halamanKimia DasarnbiellaBelum ada peringkat
- KimiaDokumen51 halamanKimiaSi DoelBelum ada peringkat
- Lecture - Note - Sesi-13 - STOIKIOMETRIDokumen23 halamanLecture - Note - Sesi-13 - STOIKIOMETRIberkasmengajardanangBelum ada peringkat
- STOIKIOMETRIDokumen63 halamanSTOIKIOMETRINovia Anjani SafitriBelum ada peringkat
- Materi BimbelDokumen98 halamanMateri BimbelSangkala MarosBelum ada peringkat
- 2.3 Konsep Mol PenerapannyaDokumen54 halaman2.3 Konsep Mol Penerapannyasalsabilla oktaliBelum ada peringkat
- Konsep Mol & StoikiometriDokumen35 halamanKonsep Mol & StoikiometriRosa MarselinaBelum ada peringkat
- 3584 2.stoikiometriDokumen31 halaman3584 2.stoikiometriDewi Ashri OktavianiBelum ada peringkat
- Konsep MolDokumen35 halamanKonsep MolMona Triputri SuardiBelum ada peringkat
- Contoh Soal 1 StoikioDokumen8 halamanContoh Soal 1 StoikioArdisha TapiyaBelum ada peringkat
- 2.3 Konsep Mol & PenerapannyaDokumen57 halaman2.3 Konsep Mol & PenerapannyaFirda LudfiyahBelum ada peringkat
- Pers - Kimia & Rumus Kimia (Stoikiometri)Dokumen28 halamanPers - Kimia & Rumus Kimia (Stoikiometri)XXAQWEMKLBelum ada peringkat
- 3584 2.stoikiometriDokumen31 halaman3584 2.stoikiometriJulianto JulzBelum ada peringkat
- KONSEP MOLDokumen36 halamanKONSEP MOLAnggi Prinandi100% (1)
- Materi MidDokumen15 halamanMateri MidWinandela Bregystiend Viona LawalataBelum ada peringkat
- STOIKIOMETRIDokumen37 halamanSTOIKIOMETRInadya syafiraBelum ada peringkat
- KimiaDokumen12 halamanKimiaNoevitha Jmblhwti Pncricnta100% (1)
- Rumus EmpirisDokumen45 halamanRumus EmpirisAde Ilham Khaled100% (1)
- Konsep Mol dan Stoikiometri DasarDokumen19 halamanKonsep Mol dan Stoikiometri DasarfridaBelum ada peringkat
- STOIKIOMETRI KIMIADokumen71 halamanSTOIKIOMETRI KIMIAPuteri100% (1)
- Konsep MolDokumen37 halamanKonsep MolNabila ulfahBelum ada peringkat
- 02 StoikiometriDokumen21 halaman02 StoikiometriPandu HariyantoBelum ada peringkat
- STOIKIOMETRIDokumen53 halamanSTOIKIOMETRIErwin Tallu SangrapuBelum ada peringkat
- STOIKIOMETRIDokumen27 halamanSTOIKIOMETRISeptika Trizha ListiaBelum ada peringkat
- MASSA ATOMDokumen9 halamanMASSA ATOMlatif hidayatBelum ada peringkat
- Kimia Dasar Pertemuan 5Dokumen33 halamanKimia Dasar Pertemuan 5FREDERICO WIDJAJA (00000067121)Belum ada peringkat
- STOIKIOMETRI DAN HUKUM GASDokumen31 halamanSTOIKIOMETRI DAN HUKUM GASMuliansyah NihinBelum ada peringkat
- STOIKIOMETRIDokumen31 halamanSTOIKIOMETRINandya AristaBelum ada peringkat
- KIMIA (Stoikiometri)Dokumen72 halamanKIMIA (Stoikiometri)AdnanLasuardaBelum ada peringkat
- KONSEP MOL DAN BILANGAN AVOGADRODokumen13 halamanKONSEP MOL DAN BILANGAN AVOGADROmaisarah ambiya ar100% (1)
- STOIKIOMETRIDokumen55 halamanSTOIKIOMETRIStuart YoungBelum ada peringkat
- Perhitungan ClorinDokumen20 halamanPerhitungan ClorinAzzamKhalilBelum ada peringkat
- 3584 2.stoikiometriDokumen31 halaman3584 2.stoikiometriPedi ApriansyahBelum ada peringkat
- 10 Hukum KimiaDokumen7 halaman10 Hukum KimiaseptianaBelum ada peringkat
- Konsep Mol FixDokumen30 halamanKonsep Mol FixSatriyani Hastuti RahayuBelum ada peringkat
- RUMUS KIMIADokumen22 halamanRUMUS KIMIAMuliansyah NihinBelum ada peringkat
- Stokiometri - Buat MhsDokumen20 halamanStokiometri - Buat MhsChristofel BaraBelum ada peringkat
- Perhitungan ClorinDokumen20 halamanPerhitungan ClorinDanu Itsnan HabibiBelum ada peringkat
- Konsep MolDokumen27 halamanKonsep MolRafi ArdoBelum ada peringkat
- STOIKIOMETRIDokumen42 halamanSTOIKIOMETRIGunawan KristiyantoBelum ada peringkat
- STOIKIOMETRIDokumen29 halamanSTOIKIOMETRIAdinda Rizki AmeliaBelum ada peringkat
- HUKUM-HUKUM KIMIA DASARDokumen22 halamanHUKUM-HUKUM KIMIA DASARRickyFernando0% (1)
- Slide StoikiometriDokumen15 halamanSlide StoikiometriEkaPutraDiprajaBelum ada peringkat
- Kata Pengantar Pak NasirDokumen2 halamanKata Pengantar Pak NasirAKATIRTA_MAGELANGBelum ada peringkat
- FUNGSI LIMITDokumen12 halamanFUNGSI LIMITSuri KaruniawatiBelum ada peringkat
- HIDRODINAMIKA DASARDokumen75 halamanHIDRODINAMIKA DASARAKATIRTA_MAGELANGBelum ada peringkat
- Hidrologi Siap PDokumen5 halamanHidrologi Siap PAKATIRTA_MAGELANGBelum ada peringkat
- Hidrologi Siap PDokumen26 halamanHidrologi Siap PAKATIRTA_MAGELANGBelum ada peringkat
- Bab III StatikafluidaDokumen19 halamanBab III StatikafluidaAzura ArizaBelum ada peringkat
- Tugas Iii MatematikaDokumen6 halamanTugas Iii MatematikaAKATIRTA_MAGELANGBelum ada peringkat
- Fisika Dasar 1Dokumen5 halamanFisika Dasar 1AKATIRTA_MAGELANGBelum ada peringkat
- Fisika-Gerak LurusDokumen17 halamanFisika-Gerak LurusAKATIRTA_MAGELANGBelum ada peringkat
- Diskusi 6Dokumen5 halamanDiskusi 6AKATIRTA_MAGELANGBelum ada peringkat
- Tututramadhan 030437809 Tugas1 MSDMDokumen7 halamanTututramadhan 030437809 Tugas1 MSDMAKATIRTA_MAGELANGBelum ada peringkat
- IndoDokumen10 halamanIndoAKATIRTA_MAGELANGBelum ada peringkat
- 2.tentang Perencanaan PompaDokumen81 halaman2.tentang Perencanaan PompaAKATIRTA_MAGELANGBelum ada peringkat
- Tutut Ramadhan-030437809-Tugas 1 - Pengantar Ekonomi MakroDokumen3 halamanTutut Ramadhan-030437809-Tugas 1 - Pengantar Ekonomi MakroAKATIRTA_MAGELANGBelum ada peringkat
- PERENCANAAN JARINGAN TRANSMISI... IdaDokumen20 halamanPERENCANAAN JARINGAN TRANSMISI... IdaAKATIRTA_MAGELANGBelum ada peringkat
- Perencanaan Jaringan TransmisiDokumen25 halamanPerencanaan Jaringan TransmisiAKATIRTA_MAGELANGBelum ada peringkat
- Tututramadhan 030437809 Tugas3 KomunikasibisnisDokumen8 halamanTututramadhan 030437809 Tugas3 KomunikasibisnisAKATIRTA_MAGELANGBelum ada peringkat
- 2.tentang Perencanaan PompaDokumen81 halaman2.tentang Perencanaan PompaAKATIRTA_MAGELANGBelum ada peringkat
- Materi Ukl Upl PDFDokumen19 halamanMateri Ukl Upl PDFAKATIRTA_MAGELANGBelum ada peringkat
- Iut Pertemuan 1Dokumen18 halamanIut Pertemuan 1Ahmad Fauzi TanjungBelum ada peringkat
- Materi Ukl Upl PDFDokumen19 halamanMateri Ukl Upl PDFAKATIRTA_MAGELANGBelum ada peringkat